瑞戈非尼对肝癌细胞凋亡及琥珀酸脱氢酶D表达的影响*
2022-12-09吴亚菲刁文婧周鹤鸣李琴
吴亚菲,刁文婧,周鹤鸣,李琴
(上海交通大学附属第一人民医院临床药学科,上海 200080)
肝细胞癌 (hepatocellular carcinoma,HCC)是肝癌主要的组织学亚型,以高复发、难治愈的特征成为全球第二大致死肿瘤[1]。肝癌治疗指导原则建议[2-3]:早期肝癌患者优选外科切除、肝移植及射频消融等治疗方式;对于疾病进展期但肝功能尚可且无血道转移的患者优先选择化疗栓塞;对于无法进行局部治疗的患者,推荐采取以口服索拉非尼为代表的全身治疗方式[4]。早期肝癌症状通常不明显,当症状出现时,大多数患者已发展至晚期。然而,晚期患者索拉非尼药物治疗效果不佳,索拉非尼耐药后使用瑞戈非尼能在一定程度上延长患者生存期,但其疗效依旧有限[5]。因此,寻找肝癌药物治疗的新靶点至关重要。琥珀酸脱氢酶(succinate dehydrogenase,SDH)是含4个亚单位(A、B、C、D)的蛋白复合物,主要定位在线粒体内膜上[6]。研究表明,SDH各个亚单位参与三羧酸循环及线粒体呼吸链。其中SDHA催化琥珀酸生成富马酸;SDHB作为重要组分参与电子传递链中泛醌到泛醇的氧化过程;SDHC及SDHD主要协助SDH蛋白锚定在线粒体上,保证电子传递链工作井然有序。研究发现SDH各亚单位表达异常引起细胞代谢紊乱及肿瘤发生[7-9];SDHD/PTEN/自噬轴参与调控甲状腺癌的发生与发展[10];TGF-β/SDHD/HIF-1α轴影响骨肉瘤化疗耐药[11]。SDHD可能是调控肿瘤发生与发展的重要靶点。然而,SDHD在肝癌发展中的作用尚不明确。本研究旨在探究瑞戈非尼对肝癌细胞凋亡及对SDHD表达水平的影响,观察SDHD对肝癌细胞增殖、瑞戈非尼药物作用及肝癌预后的影响。
1 材料与方法
1.1药物与试剂 瑞戈非尼(MedChemExpress公司,批号:HY-10331,纯度≥99.0%);二甲亚砜(Sigma-Aldrich公司,批号:RNBF8134);AKT信号通路激动剂SC79(MedChemExpress公司,批号:HY-10358,含量≥98.0%);AKT信号通路抑制剂MK2206(MedChemExpress公司,批号:HY-18749,含量≥99.0%);胎牛血清(Gibco公司,批号:10099-141);青霉素-链霉素溶液(苏州新赛美公司,批号:C100C5);达尔伯克改良伊格尔培养基(Dulbecco's modified eagle's medium,DMEM,Gibco公司,批号:C11995500BT);细胞计数试剂盒(cell counting kit-8,CCK-8,MedChemExpress公司,批号:HY-K0301);细胞增殖成像分析试剂盒(Edu试剂盒,锐博生物公司,批号:R11053.10);凋亡试剂盒(联科生物公司,批号:AP105);Trizol裂解液(Invitrogen公司,批号:15596-026);RIPA裂解液(苏州新赛美公司,批号:WB3100);蛋白酶和磷酸酶抑制剂混合液(苏州新赛美公司,批号:P002);转染培养基 Opti-MEM(Gibco公司,批号:31985070);脂质体2000(Lipofectamine 2000,Invitrogen公司,批号:11668-019);抗体SDHD(CST公司,批号:#45849);抗体AKT(CST公司,批号:4685);抗体p-AKT(Ser473)(CST公司,批号:4060);抗体β-actin(CST公司,批号:58169);抗体GAPDH(CST公司,批号:97166)。
1.2设备与仪器 细胞培养箱(Thermo Scientific公司,型号:BB150);酶标仪(BIOTEK 公司,型号:ELX-800);倒置荧光显微镜(Leica公司,型号:DMi8);流式细胞仪(BD公司,型号:Accuri C6);实时荧光定量PCR仪(Applied Biosystems公司,型号:ABI QuantStudioTM6 Flex)。
1.3细胞培养 人肝癌细胞株Huh7购自中国科学院生物化学与细胞生物学研究所,后由实验室保存。人肝癌细胞株Huh7培养于含10% 胎牛血清、1%青霉素-链霉素溶液的DMEM培养基中,并在含5%二氧化碳(CO2)、37 ℃恒温细胞培养箱中培养。细胞生长达到约80%覆盖率时进行传代。
1.4转染过表达(overexpression,OE)质粒构建SDHD过表达细胞模型 细胞铺板及预处理:以6孔板为例,取状态良好的Huh7细胞铺板,待细胞生长至40%~50%覆盖率后进行转染,转染前2 h换成转染培养基Opti-MEM进行预处理。质粒稀释:以100 μL Opti-MEM稀释OE质粒(4 μL)和Lipofectamine 2000(4 μL)。转染步骤:两组稀释液室温静置5 min后混匀,混合液室温静置15 min后加入6孔板中,6~8 h更换成正常培养基。48 h后收集细胞并验证转染效率,获得SDHD过表达细胞模型。OE-SDHD序列见表1。

表1 本研究中使用的质粒序列 Tab.1 Oligos used in the research
1.5转染小干扰RNA(small interfering RNA,siRNA)质粒构建SDHD敲减细胞模型 细胞铺板及预处理同“1.4”。质粒稀释:以100 μL Opti-MEM稀释siRNA(5 μL)和Lipofectamine 2000(5 μL)。转染步骤同“1.4”。48 h后收集细胞验证转染效率,获得SDHD敲减细胞模型。3组siRNA-SDHD序列见表1。
1.6CCK-8检测细胞活性 为验证SDHD过表达对细胞活力的影响,将实验分为阴性对照组(NC)及SDHD过表达组(OE)。为验证SDHD敲减对细胞活力的影响,将实验分为对照组(ctr)及SDHD敲减组(si-2及si-3)。各组细胞以每孔5×103个的密度接种于96孔板中培养24 h。24 h后弃去原始培养基,加入含10% CCK-8的完全培养基100 μL,并继续孵育2~4 h。孵育结束后在酶标仪波长450 nm下检测各孔吸光度(A)值。
1.7流式细胞术检测细胞凋亡情况 为考察瑞戈非尼对肝癌细胞凋亡的影响,将Huh7细胞铺板并分为空白处理组和不同浓度(2,4,6,8,10 μmol·L-1)瑞戈非尼处理组,处理时间为24 h。为考察过表达SDHD对瑞戈非尼药物作用下细胞凋亡的影响,分组为NC-control组、OE-control 组、NC-6 μmol·L-1组和OE-6 μmol·L-1组,其中NC-control组及OE-control 组均无药物处理,NC-6 μmol·L-1组和OE-6 μmol·L-1组均给予6 μmol·L-1瑞戈非尼处理,处理时间为24 h。为考察MK2206对SDHD促瑞戈非尼作用下细胞凋亡的影响,分组为NC组、OE组、OE+SC79组和OE+MK2206组,其中NC组及OE组加入6 μmol·L-1瑞戈非尼处理,OE+SC79组加入6 μmol·L-1瑞戈非尼及5 μmol·L-1SC79处理,OE+MK2206组加入6 μmol·L-1瑞戈非尼及10 μmol·L-1MK2206处理,处理时间为24 h。各组细胞经实验处理后,消化离心收集细胞沉淀。随后使用预冷的流式缓冲液重悬,并将细胞悬液转移至1.5 mL的Ep管中,加入凋亡试剂盒中的凋亡染料混匀后避光染色15 min。染色结束后通过流式细胞仪检测细胞凋亡。通过计算早期凋亡率与晚期凋亡率的总和分析各组细胞凋亡情况。
1.8蛋白质印迹法(Western blotting,WB)检测蛋白表达 为检测瑞戈非尼对SDHD蛋白表达水平的影响,Huh7细胞铺板后分为空白处理组及6 μmol·L-1瑞戈非尼处理组,经24 h及48 h分别处理后收集细胞样品。为检测SDHD过表达细胞模型中SDHD、AKT及p-AKT(Ser473)的表达水平,实验分为NC组及OE组。为检测SDHD敲减细胞模型中SDHD、AKT及p-AKT(Ser473)的表达水平,实验分组为ctr组、si-1组、si-2组及si-3组。细胞收样后经磷酸盐缓冲液(PBS)清洗两遍,使用含1%蛋白酶和磷酸酶抑制剂混合液的RIPA裂解后离心获得蛋白上清液。取样品蛋白30 μg,依次进行电泳、转膜、封闭、抗体孵育及显影操作,使用ImageJ软件分析目标条带的灰度值。
1.9实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测mRNA的表达 实验分为空白处理组及6 μmol·L-1瑞戈非尼处理组,经24 h及48 h分别处理后获取细胞样品。细胞样品首先经Trizol裂解液裂解,依次加入三氯甲烷、异丙醇、75%乙醇处理后获得RNA溶液并定量。经反转录获得cDNA模板,并以cDNA模板进行RT-qPCR。反应条件为 95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,40个循环。引物均由上海新贝生物科技有限公司设计合成,引物序列如表2。

表2 RT-qPCR引物序列 Tab.2 Primer sequence of RT-qPCR
1.10Edu试剂盒检测细胞增殖情况 实验分组同“1.6”项。各组细胞培养24 h后,根据Edu试剂盒说明书进行Edu染色2 h。染色结束后去除染色液,PBS轻柔清洗后加入细胞固定液室温孵育30 min,经PBS清洗后加入含0.5% TritonX-100的PBS孵育10 min。孵育结束后PBS清洗一次,随后加入1X Apollo®反应液孵育30 min,PBS清洗并加入Edu试剂盒中的1×Hoechst33342 反应液继续染色。染色结束后于倒置荧光显微镜下进行观察并拍照,记录阳性细胞率。阳性细胞率为每视野下红色荧光数与蓝色荧光数比值。阳性细胞率越高,细胞增殖能力越强。
1.11GEPIA分析肝癌组织中SDHD与AKT1基因表达的相关性 首先搜索并打开GEPIA在线工具(http://gepia.cancer-pku.cn/),点击选择“Multiple Gene Analysis”,然后选择“Correlation Analysis”。依次填写基因“SDHD”及“AKT1”“TCGA Tumor” 项选择“LIHC Tumor”并添加到“Used Expression Datasets”中。最后点击“Plot”输出结果,分析肝癌组织中SDHD与AKT1基因表达的相关性。
1.12Kaplan Meier-plotter 分析SDHD mRNA表达与肝癌预后的相关性 首先进入Kaplan Meier-plotter网站(http://kmplot.com/analysis),点击“Start KM Plotter for liver cancer”进入参数设置页面。然后在“Affy id/Gene symbol”对话框中输入“SDHD”,“Survival”分别选择“OS”“RFS”,其余选项维持默认值。点击“Draw Kaplan-Meier Plot”输出结果,分析SDHD的mRNA表达水平与肝癌患者总生存期(OS)及无复发生存时间(RFS)的相关性。
1.13统计学方法 采用SPSS 20.0版统计软件对数据进行分析与处理。对于两组之间差异比较,采用t检验。对于多组间差异比较采用单因素方差分析。每组实验重复3次。以P<0.05为差异具有统计学意义。
2 结果
2.1瑞戈非尼对肝癌细胞凋亡及SDHD表达的影响 见图1。流式结果显示,与空白处理组相比,4,6,8,10 μmol·L-1瑞戈非尼处理组细胞凋亡率均升高,且差异有统计学意义(P<0.05,见图1A-B)。此外,与空白处理组相比,6 μmol·L-1瑞戈非尼24 h 48 h给药处理均能促进SDHD mRNA及蛋白表达上调(P<0.05,见图1C-D)。以上结果提示SDHD可能在瑞戈非尼药物作用下的细胞凋亡过程中发挥重要作用。
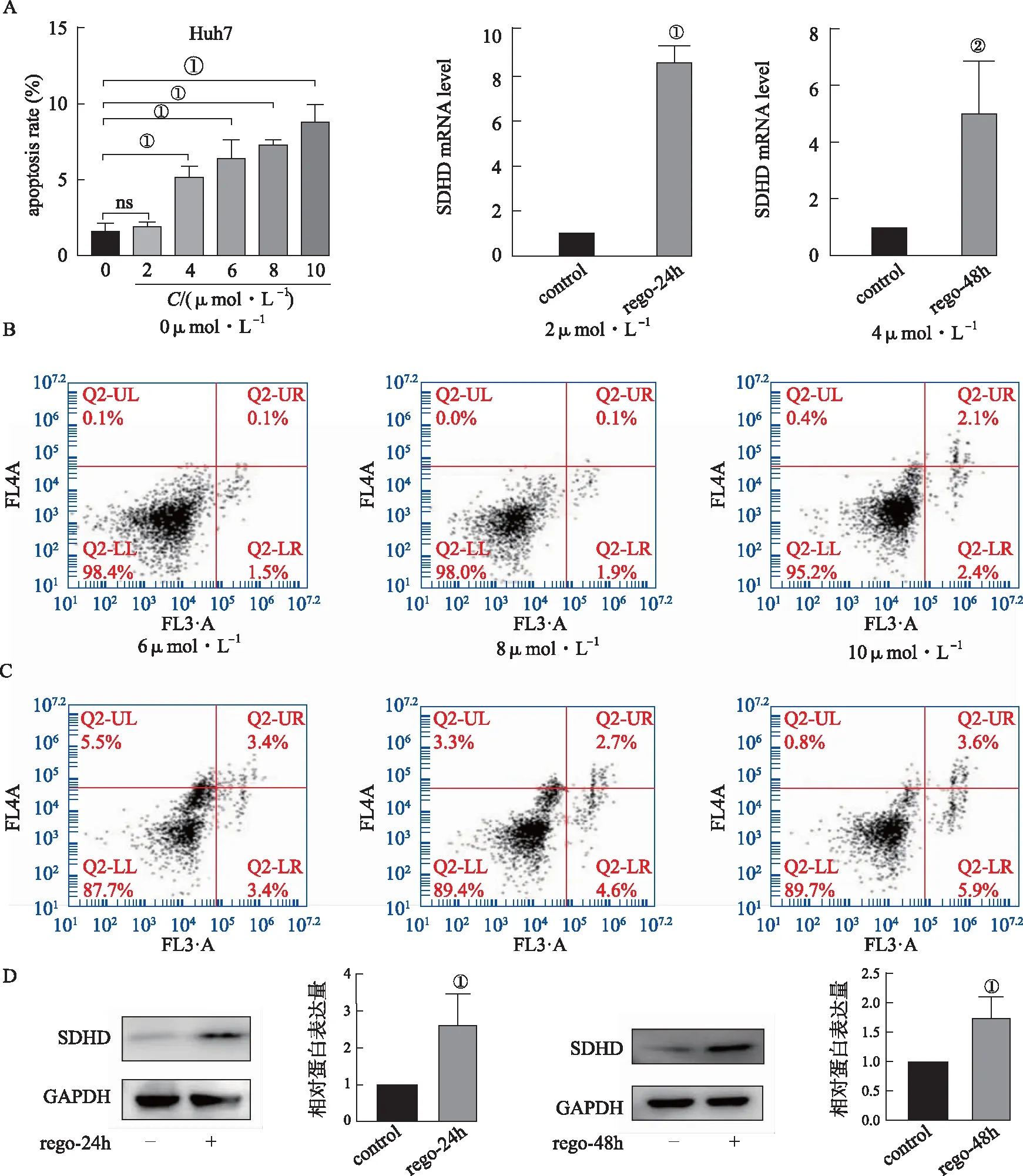
A&B.不同浓度瑞戈非尼对Huh7细胞凋亡的影响;C.瑞戈非尼24 h及48 h给药对SDHD mRNA表达的影响;D.瑞戈非尼24 h及48 h给药对SDHD蛋白质表达的影响;①P<0.01;②P<0.05。图1 瑞戈非尼对Huh7细胞凋亡及SDHD表达水平的影响A&B.Effect of different concentrations of regorafenib on cell apoptosis of Huh7;C.Effect of 24 h or 48 h regorafenib treatment on mRNA level of SDHD;D.Effect of 24 h or 48 h regorafenib treatment on protein level of SDHD;①P<0.01;②P<0.05。Fig.1 The effect of regorafenib on cell apoptosis and SDHD expression in
2.2构建SDHD过表达及敲减细胞模型 WB结果显示,OE组SDHD表达水平高于NC组(t=3.603,P<0.05,见图2A),说明SDHD过表达细胞模型构建成功。si-1、si-2和si-3组SDHD表达水平均低于ctr组(P<0.05,见图2B),说明SDHD敲减细胞模型构建成功,且si-2和si-3敲减效果更为理想,后续使用si-2及si-3验证SDHD敲减对细胞增殖的影响。
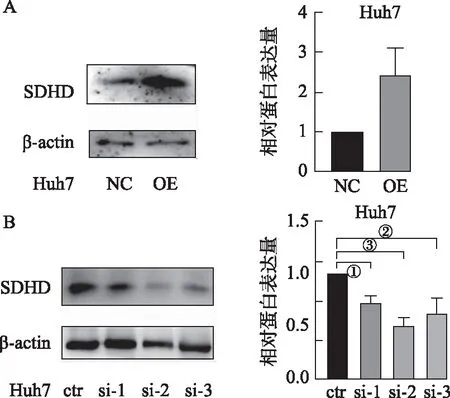
A.WB验证SDHD过表达效率;B.WB验证SDHD敲减效率;①P<0.05;②P<0.01;③P<0.001。图2 构建SDHD过表达和敲减细胞模型A.The efficiency of SDHD over expression was validated by WB;B.The efficiency of SDHD knockdown was valdated by WB;①P<0.05;②P<0.01;③P<0.001。Fig.2 Construction of SDHD overexpression model and SDHD knockdown
2.3SDHD对肝癌细胞增殖的影响 CCK-8实验结果显示,与NC组比较,OE组细胞活力降低(t=4.243,P<0.05,见图3A);与ctr组比较,si-2及si-3组细胞活力均增高(P<0.05,见图3A)。Edu实验结果显示,OE组Edu阳性细胞率低于NC组(t=6.736,P<0.05,见图3B,3D),si-2及si-3组阳性细胞率均高于ctr组(P<0.05,见图3C,3E)。以上数据结果提示过表达SDHD 抑制细胞增殖,敲减SDHD促进细胞增殖。
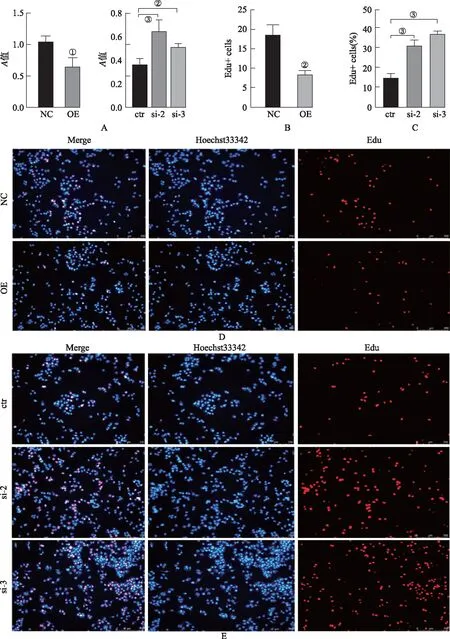
A.CCK-8检测SDHD对Huh7细胞活力的影响;B&D.Edu实验检测过表达SDHD对Huh7细胞增殖的影响;C&E.Edu实验检测敲减SDHD对Huh7细胞增殖的影响;①P<0.05;②P<0.01;③P<0.001;④P<0.000 1。图3 SDHD对Huh7细胞增殖的影响A.Effect of SDHD on the viability of Huh7 cell was quantified by CCK-8;B&D.Effect of SDHD knockdown on the proliferation of Huh7 cell was quantifitecl by Edu;C&E.Effect of SDHD knockdown on the proliferation of Huh7 cell was quantifiecl by Edu;①P<0.05;②P<0.01;③P<0.001;④P<0.000 1.Fig.3 Effect of SDHD on Huh7
2.4过表达SDHD对瑞戈非尼药物作用下细胞凋亡的影响 流式实验结果提示NC-control组与OE-control组细胞凋亡率无明显差异(P>0.05),但OE-6 μmol·L-1组细胞凋亡率高于NC-6 μmol·L-1(P<0.05),见图4A-B。这一结果提示过表达SDHD不影响细胞基础凋亡率,但能提高细胞在瑞戈非尼作用下的凋亡率。
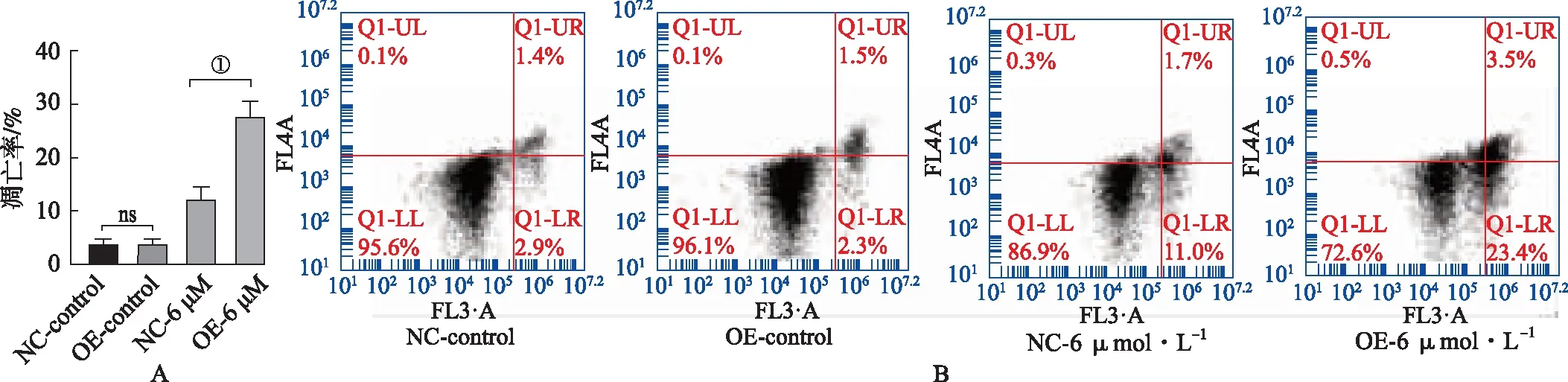
A&B.流式细胞术检测过表达SDHD对细胞凋亡的影响;①P<0.000 1。图4 过表达SDHD对Huh7细胞凋亡率的影响(n=3) A&B.Effect of SDHD overexpresion on cell apoptosis of Huh7 was analyzed by flow cytometry ;①P<0.000 1。Fig.4 Effect of SDHD overexpression on the apoptosis rate in Huh7(n=3)
2.5MK2206对SDHD促瑞戈非尼作用下细胞凋亡的影响 AKT信号通路参与肝癌增殖、迁移、侵袭及耐药过程[12-14],对于肝癌发生、发展、耐药及预后具有重要意义。为明确SDHD对肝癌细胞AKT信号通路的影响,本研究对p-AKT(Ser473)的表达水平进行检测。WB结果显示,OE组 p-AKT(Ser473)表达高于NC组(P<0.05,见图5A);si-1、si-2和si-3组p-AKT(Ser473)表达均低于ctr组(P<0.05,见图5B)。以上数据提示SDHD能通过提高p-AKT(Ser473)的表达水平激活AKT信号通路。
随后采用流式细胞术进一步分析AKT信号通路抑制剂MK2206对SDHD促瑞戈非尼作用下细胞凋亡的影响。结果显示,与OE组比较,OE+MK2206组细胞凋亡进一步增多(P<0.000 1),而OE+SC79组的细胞凋亡与OE组无明显差异,见图5C-D。以上结果提示MK2206能够协同SDHD过表达促进肝癌细胞在瑞戈非尼作用下发生凋亡。此外,通过GEPIA网站上的数据库分析SDHD与AKT1基因表达的相关性。结果显示,肝癌肿瘤组织中SDHD与AKT1表达呈正相关(P<0.05,R=0.33,见图5E),随着SDHD的表达增多,AKT1的表达也随之增加。

A.过表达SDHD对AKT信号通路的影响;B.敲减SDHD对AKT信号通路的影响;C&D.流式细胞术检测SC79和MK2206对SDHD促瑞戈非尼药物作用的影响;E.肝癌组织中SDHD与AKT1基因表达的相关性;①P<0.05;②P<0.01;③P<0.001;④P<0.000 1。图5 观察SDHD对AKT信号通路的影响A.Effect of SDHD overexpression on AKT signaling pathway;B.Effect of SDHD knockdown on AKT signaling pathway;C&D.Effect of SC79 or MK2206 on the promotion of SDHD in regorafenib-related apptosis was analyzed by flow cyrometry;E.Correlation between SDHD and AKT1 gene expression in liver concer;①P<0.05;②P<0.01;③P<0.001;④P<0.000 1.Fig.5 The effect of SDHD on AKT signaling
2.6SDHD mRNA表达水平与肝癌临床预后的关系 通过分析Kaplan Merier-plotter网站的数据发现高表达SDHD患者组的总生存期(overall survival,OS)及无复发生存时间(recurrence free survival,RFS)长于低表达SDHD患者组(P<0.05,见图6A-B),提示高表达SDHD的肝癌患者预后更好。
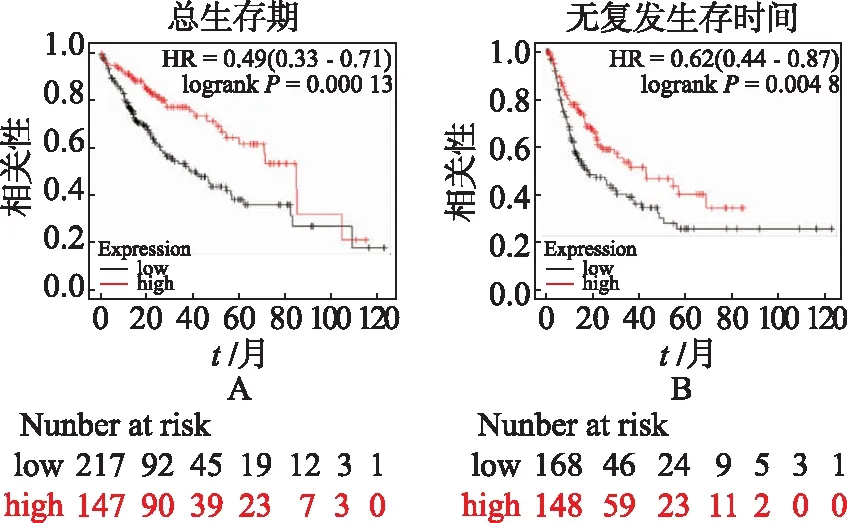
A.SDHD表达与肝癌患者OS的相关性;B.SDHD表达与肝癌患者RFS的相关性。图6 SDHD表达高低与肝癌临床预后的关系 A.Representatior of overall survival depending on SDHD expression in patients with liver cancer;B.Representation of recurrence free survival depending on SDHD expression in patients with liver cancer.Fig.6 Relationship between SDHD and clinical prognosis in HCC
3 讨论
肝细胞癌是高复发、难治愈的恶性肿瘤之一,其5年生存率仅为18%。晚期肝癌的首选治疗药物索拉非尼虽然具有一定的临床疗效,但耐药的出现给肝癌治疗带来了巨大挑战。临床Ⅲ期实验表明索拉非尼耐药后采用瑞戈非尼进行治疗能够在一定程度上提高肝癌患者的总生存期[15]。但随着研究进一步深入,瑞戈非尼耐药问题也日渐凸显:SphK2/S1P通过激活NF-κB和STAT3介导肝癌瑞戈非尼耐药[16];ADAMTSL5作为主要的调节因子参与肝癌瑞戈非尼耐药[17]。因此,继续挖掘肝癌治疗的新靶点具有重要的临床意义。
SDHD作为琥珀酸脱氢酶复合体中的关键亚单位,通过影响PTEN-AKT-FOXO3a轴参与甲状腺癌的肿瘤调控过程[10]。已有文献报道SDHD参与TGF-β介导的骨肉瘤化疗耐药:TGF-β引起SDHD表达下调,并通过上调HIF-1α引起骨肉瘤化疗耐药[11]。然而,SDHD在肝癌中的作用尚未完全阐明。本研究通过验证瑞戈非尼对肝癌细胞凋亡及SDHD表达的影响,探索SDHD对肝癌细胞增殖及瑞戈非尼药物作用的影响,提示SDHD或许是肝癌治疗的新靶点。
肝癌细胞的增殖能力与药物作用下的细胞凋亡水平在一定程度预示着肿瘤的生长及药物治疗效果。本研究发现瑞戈非尼在诱导细胞凋亡的过程中引起SDHD表达上调,提示SDHD可能是瑞戈非尼刺激下的积极响应因子。随后发现过表达SDHD抑制细胞增殖,同时提高细胞在瑞戈非尼药物作用下的凋亡率。结合临床大数据分析SDHD与肝癌患者总生存期及无复发生存时间的关系,发现高表达SDHD的肝癌患者预后更好,提示SDHD发挥抑癌因子的作用。
AKT信号通路参与调控多种恶性肿瘤的发生、发展、迁移、耐药及复发过程,是经典的肿瘤信号通路[18-20]。AKT存在2个磷酸化位点,分别为Thr 308位点及Ser 473位点。AKT被磷酸化激活后促使一系列底物磷酸化,进而调节细胞增殖、生长及代谢过程[21,22]。文献报道瑞戈非尼处理能够激活肝癌细胞AKT信号通路,瑞戈非尼联合骆驼蓬碱能够通过抑制AKT信号通路进一步杀伤细胞[23]。此外,结肠癌细胞瑞戈非尼耐药株在瑞戈非尼刺激后激活AKT信号通路[24];瑞戈非尼诱导非小细胞肺癌肿瘤干细胞富集及耐药依赖于AKT/FOXM1/STMN1 信号通路的激活[25]。以上文献提示瑞戈非尼刺激引起AKT信号通路激活,瑞戈非尼耐药与AKT信号通路激活之间存在十分重要的联系。本研究发现瑞戈非尼刺激引起肝癌细胞SDHD表达增多,随后通过WB实验发现外源过表达SDHD提高p-AKT(Ser473)的表达,而敲减SDHD降低p-AKT(Ser473)的表达,这表明SDHD能通过磷酸化AKT激活该信号通路。此外,本研究还发现AKT信号通路激动剂不影响SDHD过表达对瑞戈非尼诱导细胞凋亡的促进作用,这可能是由于SDHD已经激活了AKT信号通路,在此基础上再次激活AKT信号通路则不会进一步诱导细胞凋亡;反之,抑制AKT通路能够协同SDHD过表达进一步提高细胞在瑞戈非尼作用下的凋亡水平。
综上所述,本研究发现瑞戈非尼促进肝癌细胞凋亡,提高SDHD的表达水平,过表达SDHD能抑制肝癌细胞增殖,提高细胞在瑞戈非尼作用下的凋亡水平。SDHD可能是肝癌治疗的潜在靶点,但其具体机制仍需进一步阐明。
