生物菌剂对根际盐碱土壤理化性质和微生物区系的影响
2022-12-09张晓丽王国丽常芳弟张宏媛逄焕成张建丽王婧冀宏杰李玉义
张晓丽 ,王国丽,常芳弟,张宏媛,逄焕成,张建丽,王婧,冀宏杰,李玉义*
1. 中国农业科学院农业资源与农业区划研究所,北京 100081;2. 河套学院生态与资源工程系,内蒙古 巴彦淖尔 015000;3. 北京理工大学生命学院,北京 100081
中国盐渍土壤面积大、分布广,同时还有大面积的潜在盐渍化土壤,而作物在盐渍化土壤上生长会表现出不良状态,比如抑制生长、破坏光合作用、从而使植物细胞膜受到伤害、营养失衡等,严重时可能会造成作物绝产等(葛诚等,1994)。所以改良盐碱土对促进农村区域发展,保障中国粮食安全的意义不容忽视(俞仁培等,1999)。近些年,改良盐碱土主要有工程、农艺、生物以及化学等措施,但由于其有一定的不足之处,比如工程措施投入和工程量大;农艺措施具有潜在的返盐危险;化学措施易造成二次污染,不能解决根本性问题(Qadir et al.,2000;Barter-Lennard,2002;刘广明等,2001;李刚等,2004);而生物措施是近些年来迅速发展的最具生态和经济效益且切实可行的技术。由于菌剂中的微生物能在土壤中繁殖,改善土壤养分状况、提高土壤酶活性、增加微生物多样性、改变微生物菌群,从而为作物生长提供一个良好的生活环境;由于施用微生物菌剂具有良好的生态效益,所以其在改良盐碱地中的应用不断加强(逄焕成等,2009)。微生物菌剂的施用还可提高土壤细菌数、改良作物生长、提高作物生物量、增加土壤中的有效养分等(邓松华等,2018;邓天天等,2019)。易克等(2019)研究表明,微生物菌剂的施用可在一定程度上提高烤烟中后期的生长以及外观质量和经济性状。而施用复合微生物菌剂可改变土壤pH值,使根际微生物群落的数量和结构得到改善,从而提高土壤酶活性和有效养分含量,进一步优化根际土壤环境,增强植物的光合和抗逆能力,最终实现养地增产的效果(宋以玲等,2019)。于占东等(2003)研究发现生物菌剂可明显降低土壤盐分含量,改善土壤微生物的多样性与群落组成,可一定程度上减轻黄瓜枯萎病。微生物菌剂的施用可为钾细菌和枯草芽孢杆菌的生长繁殖提供一个良好的土壤环境,降低土壤含盐量,改善作物生长(刘广明等,2011)。可见,施用微生物菌剂不仅可以改变土壤微生物区系、提高土壤环境条件,还可增强作物的抗逆性,从而减轻作物病虫害的发生。以上研究充分显示了微生物菌剂在盐碱地改良上的应用潜力。所以本研究选择符合生产要求的两种微生物菌剂作为研究对象,来探讨丹路生物菌剂与自制复合微生物菌剂BZ1T(芽孢杆菌)/1-15(芽单孢菌)在内蒙古河套灌区中度盐渍土改良中的作用,分析其对土壤盐分、pH、土壤养分、微生物和作物产量的影响及其差异,以期为抗盐微生物菌剂在生产中的应用提供充分依据。
1 材料与方法
1.1 研究区域概况
试验在内蒙古河套灌区五原县隆兴昌镇进行,该地位于 40°46′′30′—41°16′′45′N,107°35′′70′′—108°37′′50′′E,东与五原县胜丰镇、和胜乡接壤,北靠乌拉特中旗乌加河镇、德岭山镇,西与五原县新公中镇毗邻,南与五原县套海镇、胜丰镇相望,总土地面积 2493 km2。年均降雨量和蒸发量分别为177 mm和2039.2 mm,且蒸发量是降雨量的11.5倍,年均气温6.1 ℃,全年日照时数3230.9 h,平均日照百分率73%,作物生长期(4—9月)的日照时数为1813.9 h,占全年日照时数的56%,该试验地为中温带大陆性气候,具有光能丰富、日照充足且光温不同步、利用率低等特点。供试土壤0—40 cm土层的基本理化性质为盐分、pH、有机质、碱解氮、速效钾、有效磷,分别为 3.80 g·kg-1、8.92、11.04 g·kg-1、29.92 mg·kg-1、297 mg·kg-1、7.47 mg·kg-1。
1.2 供试材料
供试微生物有两种,一是芽单孢菌属 1-15(Halomonas)和芽孢杆菌属BZ1T(Nesterenkonia),二是丹路菌剂。1-15和BZ1T两个菌种是由北京理工大学生命学院微生物系统学与资源实验室提供,是从盐碱土壤中分离出的具有耐盐碱以及分泌IAA等的能力,经平板交叉实验表明两种菌株之间无拮抗作用后,将筛选出的两个菌种分别扩大培养,按1∶1质量比例混合后用灭菌后的秸秆粉、糠醛渣吸附制成复合生物菌剂[活性有益菌≥106cfu·g-1(以干物质量计),简称BL]。供试丹路菌剂是由北京丹路生物科技有限公司提供,主要以蓖麻饼为载体制备而成(活性有益菌≥106cfu·g-1,简称DL)。供试肥料为NPK≥18—20—10的有机硅水溶缓释肥复合肥料,供试作物为食葵(Helianthus annuusL.),品种为LD1335。
1.3 试验设计与管理
试验于2018年布置,采用完全随机区组设计,共设4个处理,分别为有机硅水溶缓释肥复合肥料675 kg·hm-2(CK)、有机硅水溶缓释肥复合肥料675 kg·hm-2+丹路生物菌剂 570 kg·hm-2(DL)、有机硅水溶缓释肥复合肥料 675 kg·hm-2+BZ1T/1-15复合生物菌剂 570 kg·hm-2(BL1)、施有机硅水溶缓释肥复合肥料 675 kg·hm-2+BZ1T/1-15复合生物菌剂1140 kg·hm-2(BL2)。每个小区处理3次重复、随机排列、面积35 m2(7 m×5 m)。肥料均作为底肥一次性条施,施肥深度为20 cm,施肥与覆膜用当地机械同步进行,试验布置完后与当地农田统一进行春灌压盐,灌溉时间为2018年5月11日,待灌溉水渗到一定程度时,于2018年6月15日进行人工点播(播种深度7—8 cm),播种后穴口用细沙覆盖,种植密度为27000 plants·hm-2。2018年9月23日收获食葵,其他管理措施与当地农户一致。
1.4 取样方法与数据测定
1.4.1 土壤全盐、pH的测定
食葵收获后在食葵根际取土,将其自然风干,磨碎,过2 mm筛,用土水比(1∶5)提取土壤上清液,分别用pH计(FE20)和电导率仪(DDS-307)测定土壤pH和电导率。
土壤盐分含量根据电导率(Zhang et al.,2020)换算:y=3.0111x,式中:y为土壤含盐量(g·kg-1);x是土壤提取物中水土质量比为 1∶5下的电导率(mS·cm-1);换算系数为 3.0111。
1.4.2 土壤养分的测定
食葵收获后取根际土壤样品,将其自然风干,粉碎过筛后,参照《土壤农化分析》(鲍士旦,2005)测定土壤有机质、碱解氮和有效磷、速效钾,具体测定方法为重铬酸钾外加热法、碱解法和乙酸铵提取法。
1.4.3 土壤细菌群落测定
在食葵收获后取根际土壤样品,将土样放入牛皮纸袋并迅速保存于 4 ℃冷藏箱带回实验室进行土壤细菌群落的测定。称取约0.33 g经冷冻干燥处理的土壤样品,使用Fast DNA SPin Kit for Soil DNA提取试剂盒(MP Biomedicals,USA),参照试剂盒使用说明提取样品中的总 DNA。并用质量分数为1%凝胶电泳检测提取的 DNA质量,同时用 Nano Drop 2000 UV-Vis Spectrophotometer(Thermo Fisher Scientific,USA)测定浓度。
细菌使用 16S rRNA 基因通用引物 515F(5'-GTGCCAGCMGCCGCGGTAA-3')和 907R(5'-CCGTCAATTCCTTTGAGTTT-3')进行目的基因扩增。PCR反应条件为:98 ℃预变性1 min,98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸30 s,共30个循环,最后在72 ℃下延伸5 min。反应产物用质量分数 2%琼脂糖凝胶电泳检测。通过 Hiseq 2500平台(Illumina,SanDiego,CA,USA)进行测序(诺禾致源生物信息科技有限公司,北京)。
1.4.4 数据处理与分析
利用UPARSE(Edgar 2013)将获得的高质量条带在相似度 97%水平上进行操作分类单元(OTU)划分,多样性及聚类等后续分析均采用QIIME完成。利用土壤细菌种类数(OTUs)和16S rDNA序列数(Reads)计算土壤细菌的Alpha多样性;菌群丰度指数:ACE、Chao 1;菌群多样性指数:Shannon、Simpson。软件平台mothur(version v.1.30.1)用于指数分析(Schloss et al.,2009;Bokulich et al.,2012;Quast et al.,2013)。采用Office Excel 2010对试验数据进行整理,运用DPS 6.5和SPSS 13.0分别进行方差(采用LSD法进行单因素分析)和相关性分析。采用Canoco软件对不同处理间微生物群落分布差异进行主成分分析(PCA),对微生物群落多样性与环境因子的相互关系进行冗余分析(RDA)。
2 结果与分析
2.1 不同微生物菌剂对根际土壤盐分、pH及养分含量的影响
如表1所示,与对照CK相比,各菌剂处理盐分含量均显著下降,DL、BL1和BL2较CK分别显著降低10.03%、9.34% 和13.84%(P<0.05),其中BL2处理盐分含量下降效果最显著;各处理土壤pH值在8.5左右。与对照CK相比,微生物菌剂处理的pH均显著下降,下降了0.14—0.21(P<0.05),但各微生物菌剂处理间的差异不显著,这说明微生物菌剂可以改善土壤碱性环境。表1的方差分析结果表明,各处理的有机质含量无显著差异;BL2、BL1、DL处理的碱解氮较CK处理分别显著增加了49.41%、31.77%、20.00%;BL2处理的有效磷含量较CK、DL、BL1分别显著增加17.07%、6.67%、9.09%(P<0.05),且DL与BL1处理间无显著差异;BL2和BL1处理的速效钾含量较CK分别显著提高了23.84%、17.39%,较DL分别显著提高了25.43%、18.89%(P<0.05)。

表1 收获后不同处理根际土壤pH及养分含量Table 1 pH and nutrient contents in rhizosphere soil of different treatments after harvest
2.2 不同菌剂处理高通量测序方法分析
2.2.1 测序结果和多样性指数
通过表2所示的不同处理的土壤多样性和丰富度指数发现,不同菌剂处理的多样性(Shannon和Simpson)指数差异均不显著(P>0.05)。而BL2处理的丰富度(ACE和Chao1)指数较CK、DL、BL1处理分别显著降低1.83%和1.04%、2.72%和1.59%、1.67%和1.04%(P<0.05),CK、DL与BL1处理间差异不显著。

表2 土壤样品基因组DNA测序数据统计及Alpha多样性分析Table 2 Genomic DNA sequence data statistics and alpha diversity analysis for soil samples
2.2.2 不同处理对土壤门水平细菌相对含量的影响
由图1可知,在土壤微生物门水平上总共获得11种菌群。其中,变形菌门(Proteobacteria)相对丰度为26.28%—28.50%、放线菌门(Actinobacteria)为16.28%—20.83%、酸杆菌门(Acidobacteria)为13.61%—17.12%、绿弯菌门(Chloroflexi)为14.16%—17.26%、芽单胞菌门(Gemmatimonadetes)为8.76%—11.74%,合计为86.95%—88.07%,称为优势菌群。其次是拟杆菌门(Bacteroidetes)相对丰度为2.76%—3.30%、硝化螺旋菌门(Nitrospirae)为 2.02%—2.50%、浮霉菌门(Planctomycetes)为1.55%—2.64%、厚壁菌门(Firmicutes)为1.16%—1.93%,合计为 8.23%—9.70%。而蓝细菌门(Cyanobacteria)相对丰度为 0.22%—1.59%、螺旋体菌门(Saccharibacteria)为0.33%—0.82%,合计为0.55%—2.24%,在土壤中以较低的丰度存在。不同菌门在不同处理间的响应不同。具体表现为,BL2处理有利于增加放线菌门、厚壁菌门和蓝细菌门以及降低酸杆菌门的相对丰度;BL1和BL2处理降低了芽单胞菌门、拟杆菌门、硝化螺旋菌门和浮霉菌门的相对丰度;BL1处理有利于增加绿弯菌门和螺旋体菌门的相对丰度。这说明在细菌群落组成前10的菌门中,BL2处理增加了相对丰度第二的放线菌门以及降低了相对丰度第三的酸杆菌门相对丰度;BL1和BL2处理降低了相对丰度居中芽单胞菌门、拟杆菌门、硝化螺旋菌门和浮霉菌门的的相对丰度。

图1 门水平土壤细菌群落结构Figure 1 Soil bacterial community at the phylum levels
2.3 影响盐碱土壤细菌群落的因子分析
由图2a可知,土壤盐分、pH等6个土壤理化因子覆盖了 96.78%的土壤环境信息。第Ⅰ轴(PCA1)的特征值为83.78%,同时土壤碱解氮、速效钾、有效磷与pH在第一轴存在相关性,这说明土壤理化因子在水平方向影响了土壤细菌群落的分布,从而将施用菌剂的处理与对照处理的土壤区分开。第Ⅱ轴(PCA2)的特征值为 13.00%,且土壤有机质与第Ⅱ轴存在显著相关性,这说明土壤有机质是垂直方向上土壤细菌群落组成的关键因子。
由图2b发现,土壤pH对土壤多样性(Chao1)指数具有较强的正相关性,同时土壤速效钾、有效磷、碱解氮、有机质 4个养分因子与多样性(Simpson)指数呈正相关,但相关性不显著,另外土壤pH值与土壤细菌群落多样性指数(Chao1)存在极显著正相关。而土壤盐分与多样性(Shannon)和丰富度(ACE和 Chao 1)指数呈显著正相关关系,由此可见盐分可影响土壤细菌菌群的变化。所有理化因子总共解释了67.00%的群落变化,影响顺序依次为:土壤有机质>盐分>速效钾>pH>有效磷>碱解氮,因此土壤有机质和盐分是改变盐碱土壤细菌群落结构的主控环境因子。

图2 土壤化学性质参数与细菌群落组成的主分量分析(a)及与细菌群落多样性的冗余分析(b)Figure 2 Principal component analyses (PCA) of bacterial community composition in soils from different treatments (a), and redundancy analyses (RDA) of the correlations between soil parameters and bacterial community diversity (b)
由表3可知,除芽单胞菌门(Gemmatimonadetes)和厚壁菌门(Firmicutes)与理化因子都不具相关性外,其他菌门细菌对土壤化学性质均有不同的响应。其中,相对丰度靠前的变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)与土壤速效钾与分别呈极显著负相关和显著正相关;放线菌门(Actinobacteria)与土壤pH和碱解氮分别呈显著负相关和正相关;硝化螺旋菌门(Nitrospirae)与有机质呈显著负相关关系;浮霉菌门(Planctomycetes)与土壤pH呈显著正相关;碱解氮与放线菌门和蓝细菌门呈显著正相关、与拟杆菌门呈显著负相关关系。这说明土壤碱解氮的提高有利于放线菌门和蓝细菌门的生长繁殖,而土壤盐分、pH、有机质和速效磷对细菌群落的影响具有差异性。

表3 细菌群落结构与土壤理化性质的相关性分析Table 3 Correlation analysis among physico-chemistry characteristics and bacteria on phylum
2.4 不同菌剂对向日葵生长的影响以及产量与土壤化学性质的相关性分析
由表4可知,与对照(CK)相比,微生物菌剂处理对提高盐碱土壤中向日葵的、植株干物质重和产量均有显著作用,其中BL2处理效果最显著,分别显著提高了37.36%、357.08%和39.85%,而微生物菌剂处理的花盘数显著低于CK,DL、BL1、BL2较其分别显著低 22.00%、34.00%、46.00%(P<0.05)。由表 5可知,食葵产量与有机质呈显著正相关(P<0.05),与土壤碱解氮、速效磷和速效钾呈极显著正相关关系(P<0.01),这表明通过施微生物菌剂可增加土壤养分含量从而有助于提高土壤生产力和作物产量。另外土壤盐分与养分含量呈显著负相关以及各个养分之间存在显著正相关关系(P<0.05)。
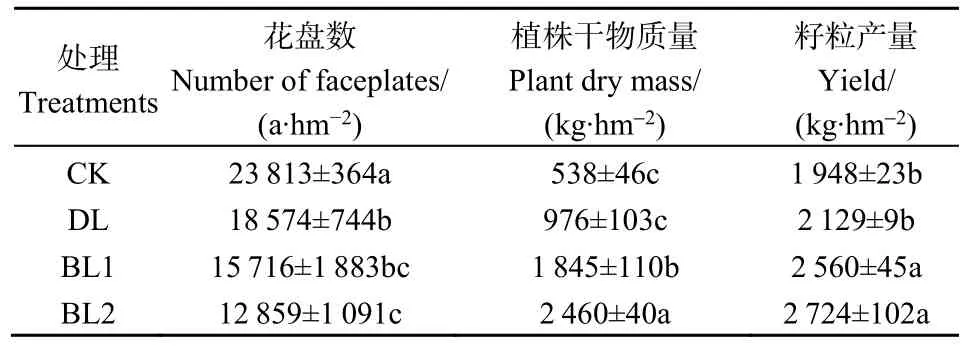
表4 不同处理对盐碱土壤向日葵生长效果的影响Table 4 Effects on the growth of sunflower in saline-alkali soil under different treatments

表5 土壤化学指标与产量的相关分析Table 5 Correlation coefficients between yield and soil physical properties
3 讨论
3.1 不同菌剂处理对根际土壤盐分、pH值和养分分布特征的影响
本研究结果表明,微生物菌剂对土壤盐分的降低显著作用,其降低效果表现为 BL2>BL1>DL>CK,这是因为土壤中的有机载体颗粒可为各种盐碱土壤微生物活动创造适宜的微生态环境,从而微生物可通过分泌一些有机物质和死亡菌体的分解,使土壤周围微粒的有机成分增加,因此降低盐碱程度(王婧等,2012)。BZ1T中存在较多的芽孢杆菌,是现下应用最普遍的生防微生物,另外芽孢杆菌在促进土壤团聚体形成与稳定性这一方面有着不可替代的重要作用,可使土壤环境特征较大幅度的得到改善(Griffiyhs et al.,2013)。有研究表明施用微生物菌剂可提高土壤脱盐率(中度盐碱土),是因为盐碱地中有一些有益微生物在活动的过程中能产生多糖和粘胶,形成土壤粘结剂,影响团粒结构,降低容重和土壤非毛细管孔隙,从而加速土壤淋盐,降低土壤含盐量(逄焕成等,2011;严慧峻等,2008),这与本研究结果表明的BL2处理的脱盐效果最好的结果一致。而土壤pH值与微生物的活性、有机质的分解、土壤养分的释放与固定等密切相关,是表征盐碱土壤改良情况的重要指标(张金柱等,2007)。本研究结果表明施用微生物菌剂处理的土壤pH值均显著低于CK,且各个菌剂处理间均没有显著差异,由此可见施用微生物菌剂对降低土壤pH值还是有一定影响的。
本试验地区土壤缺磷少氮,2018年试验开始前有机质、土壤碱解氮、速效磷、速效钾分别为11.04 g·kg-1、29.92 mg·kg-1、7.47 mg·kg-1、297 mg·kg-1。有研究表明作物的生长离不开养分的供给,而土壤养分的供应情况与其含量和土壤微生物数量、多样性、酶活性密切相关(刘健等,2001;邢世和等,2004)。本研究结果表明施用微生物菌剂均可不同程度的增加土壤碱解氮含量,其中BL2、BL1、DL较CK处理的土壤碱解氮含量分别增加了50.31%、26.09%、11.80%,这是因为微生物菌剂可降低土壤pH、提高土壤有机质含量,使微生物数量增多,酶活性增强,从而可促进土壤氮素的有效转化。BL2处理中碱解氮含量最高,是因为其含有最多的具有固氮作用的芽孢杆菌(覃小红,2013)。本研究结果还发现速效钾含量在BL2处理中含量最高,这是因为微生物菌剂可提高土壤有机质含量,减少钾素固定,从而对难溶性钾的转化起到了重要的作用(王劲松等,2012)。
3.2 不同菌剂处理对根际土壤细菌群落多样性及组成的影响
赵柏霞等(2018)、马慧媛等(2020)研究表明,微生物菌剂对提高土壤细菌群落的丰富度有显著性作用。但本研究发现,施用微生物菌剂对多样性指数(Shannon和 Simpson)无影响,而对于丰富度(Chao1和ACE)指数来说BL2处理显著高于其他处理,这可能是因为菌剂的施入还不到一年,微生物对环境改变的作用还没有发挥出来,有研究表明菌剂中的微生物改变环境需要一定的适应时间,且微生物多样性的变化需要一定的时间期限(Griffiyhs et al.,2013)。本试验根际盐碱土壤细菌检测显示不同菌剂处理中各优势菌群丰度存在差异,由图 1可知,变形菌门、放线菌门、酸杆菌门、绿弯菌门和芽单胞菌门细菌相对丰度均超过10%,是4种处理共有的优势菌群,且其占所有优势菌门的87%以上,这表明变形菌、放线菌、酸杆菌、绿弯菌和芽单胞菌在河套地区盐碱土壤中的生长能力较强,是盐碱土壤中的优势菌群。而变形菌门的相对丰度在盐碱土壤中最高,这与李新等(2016)的研究结果一致,这可能是因为变形菌门中含有多种病原菌和固氮菌,可以将有机物分解产生的氨气、甲烷等营养物质用于生长代谢活动,从而在盐碱地中的耐盐性较好,这也与本研究结果表明的的变形菌门细菌的相对丰度在 CK处理中最高的结果一致。放线菌门在参与土壤动植物残体的腐烂以及氮素循环方面有积极作用,其可显著提高土壤质量、促进作物生长(鲁奥,2019),这与本研究结果表明的放线菌门细菌的相对丰度在BL2处理中最高是一致的。由于酸杆菌门属于嗜酸性细菌,再加上内蒙古河套地区属于弱碱性环境,所以一些酸杆菌门细菌的生长会被遏制,同时碱性土壤对于一些嗜碱细菌的生长有促进作用,这样可提高土壤细菌之间的竞争压力,使得酸杆菌门从土壤中获取的营养物质减少(黄雅丽等,2018),因此造成了酸杆菌门细菌在BL2处理中的相对丰度最低,这与一些研究表明的酸杆菌门在酸性环境以及养分较缺的土壤中生长较好的结果一致(Sait et al.,2006)。本研究结果还表明芽单胞菌门细菌在CK和DL处理中的相对丰度最高,这与高圣超等(2017)研究结果表明的芽单胞菌门细菌在碱性环境中有较好的适应能力,能在碱性土壤中促进其代谢活动的结果一致。而拟杆菌门细菌的相对丰度与土壤盐分含量呈显著正相关,在盐分较高的盐碱地中具有较强的抵抗能力,所以拟杆菌门细菌是盐碱土壤中的优势菌群,另外浮霉菌门在盐碱胁迫的环境条件下其相对丰度呈增加趋势,有研究表明消化螺旋菌门在盐分较高的环境中变化比较敏感,所以低盐环境下消化螺旋菌门细菌的相对丰度会显著减少(Staff,2014;Zheng et al.,2017;张慧敏等,2018),这与本研究表明的BL1和BL2处理可降低拟杆菌门、浮霉菌门细菌的相对丰度结果一致。
3.3 土壤化学性质与细菌群落多样性的冗余分析以及与群落组成的相关性分析
土壤细菌多样性与化学因子的冗余分析(图2)表明,土壤盐分含量对细菌群落丰富度(ACE和Chao 1)和多样性(Shannon)指数具有显著性的影响,这与李岩等(2018)的研究结果一致。而土壤有机质、碱解氮和速效钾对细菌群落也有一定的影响,与细菌群落丰富度指数(Chao1和ACE)和多样性指数(Shannon)呈较强的负相关性。本研究的相关性分析(表3)表明,大多数细菌菌门与土壤化学因子具有相关性,除厚壁菌门与芽单胞菌门外。其中变形菌门(Proteobacteria)与土壤速效钾呈极显著负相关关系,同时有研究表明变形菌门在盐碱土壤中具有较好的耐盐性,是一种优势种群,在一定范围内与土壤盐分含量成显著正相关关系(张慧敏等,2018);放线菌门(Actinobacteria)与土壤pH值、碱解氮呈显著负、正相关;酸杆菌门(Acidobacteria)与土壤速效钾、绿弯菌门(Chloroflexi)与有机质和速效钾呈显著正相关;硝化螺旋菌门(NitrosPirae)、浮霉菌门(Planctomycetes)、蓝细菌门(Cyanobacteria)分别与土壤有机质、土壤pH值、土壤碱解氮呈显著负相关、正相关、正相关关系。这说明放线菌门和浮霉菌门细菌的相对丰度受土壤pH值的影响较大;而变形菌门、酸杆菌门和绿弯菌门细菌的相对丰度受土壤速效钾的影响较大;放线菌门和蓝细菌门受土壤碱解氮的影响较大。由此可见,不同菌剂处理的群落组成是通过影响土壤pH值以及土壤养分等化学性质来实现的。
4 结论
(1)微生物菌剂处理可明显降低土壤盐分和pH值,同时显著提高土壤碱解氮、有效磷和速效钾养分含量。
(2)施用微生物菌剂可以使不同处理门水平细菌相对含量及组成发生一定的变化,其中BL2处理丰富度指数(ACE和Chao1)显著高于其他处理,显著提高了放线菌门、蓝细菌门和厚壁菌门3种优势菌群相对丰度;BL1和BL2处理显著降低了酸杆菌门、芽单胞菌门、拟杆菌门、硝化螺旋菌门和浮霉菌门细菌菌群相对丰度。
(3)相关性分析表明,土壤pH、有机质、有效磷、速效钾与盐碱土壤中优势细菌群落组成(门水平)呈显著或极显著正相关或者负相关(除芽单胞菌门和厚壁菌门外);可见土壤有机质、pH以及养分含量是改变盐碱土壤细菌群落结构的主控环境因子。
综上所述,施用微生物菌剂不仅可以降低土壤盐分、pH值,而且还可以提高土壤养分含量以及改善微生物群落组成和提高产量,因此施用BL2微生物菌剂可以成为改良河套地区盐碱地的有效措施。
