菠萝R2R3-MYB基因家族S20亚族的鉴定
2022-12-07刘传和邵雪花匡石滋肖维强
贺 涵,刘传和,邵雪花,赖 多,匡石滋,肖维强
(广东省农业科学院 果树研究所,农业农村部南亚热带果树生物学与遗传资源利用重点实验室,广东省热带亚热带果树研究重点实验室,广东 广州 510640)
转录因子又称为反式作用因子,是真核生物中能与靶基因上游特定序列(顺式作用元件)结合的一类DNA结合蛋白[1]。MYB是植物中一类数目众多、功能多样的转录因子超家族,在多种生理过程中发挥着重要的调控作用[2]。人们从拟南芥(Arabidopsisthaliana)中已鉴定出300多种MYB转录因子,约占转录因子总数的9%[3]。MYB转录因子的共同特征是氨基端具有高度保守的MYB结构域,根据MYB结构域数目的不同,可将其分为1R-MYB、R2R3-MYB、3R-MYB和4R-MYB 4大类。R2R3-MYB是植物特有且数量最多(约占MYB转录因子总数的一半)的MYB转录因子,广泛参与调控植物次级代谢、激素信号转导、生物与非生物逆境响应等生理过程[4]。目前研究人员已完成了多种植物R2R3-MYB转录因子的系统鉴定,如拟南芥有125个R2R3-MYB转录因子[5],葡萄有108个R2R3-MYB转录因子[6],菠萝有103个与激素响应、生长发育和开花调控等过程有关的R2R3-MYB转录因子[7]。
由于R2R3-MYB基因家族成员众多,人们依据R2R3-MYB蛋白羧基端的保守基序,将拟南芥R2R3-MYB基因家族进一步细分为22个亚族[5],其中S20亚族包括MYB2、MYB62、MYB78、MYB108、MYB112和MYB116,与植物逆境胁迫响应、衰老及后续的细胞凋亡过程有关。拟南芥AtMYB2参与缺氧反应调控,能与缺氧响应基因上游的MYB结合位点(MBS)结合并诱导相关基因的表达[8];桉树EgMYB2能与木质素合成相关的肉桂酰辅酶A还原酶(CCR)以及肉桂醇脱氢酶(CAD)基因的启动子结合,调控木质素生物合成和次生细胞壁形成[9]。AtMYB62受低磷信号(Pi starvation)诱导并参与维持磷稳态,能与赤霉素降解基因GA2OX的启动子结合并激活GA2OX基因表达,是赤霉素信号途径的重要负调控因子[10]。MYB78能通过影响活性氧相关及防御相关基因的转录,调控活性氧依赖的细胞凋亡过程[11]。MYB108参与植物应对病原菌感染(生物胁迫)的早期细胞程序性死亡(PCD)过程,缺失MYB108可导致早期PCD失效并诱发植物细胞坏死过程(Necrosis)[12];MYB108还与叶片衰老过程中的细胞程序性死亡过程有关,AtMYB108能与NAC003基因的启动子结合介导叶片衰老过程[13]。玫瑰RhMYB108能与RhNAC053、RhNAC092和RhSAG113等凋亡相关基因的启动子结合,调控玫瑰花瓣的衰老过程,抑制RhMYB108基因的表达能延缓乙烯与茉莉酸介导的花瓣衰老过程[14]。拟南芥AtMYB112与盐胁迫、高光胁迫响应有关[15];而葡萄VvMYB112受NaCl、低温(4 ℃)以及PEG诱导,参与多种非生物胁迫响应过程[16]。MYB116与干旱胁迫响应有关,超表达甘薯IbMYB116能提高拟南芥IbMYB116转基因植株的干旱胁迫抗性[17]。
菠萝(AnanascomosusL. Merr.)又称凤梨、黄梨、王梨,是单子叶凤梨科凤梨属的多年生常绿草本果树,为世界第三大热带水果。菠萝原产于中南美洲的巴西、巴拉圭及阿根廷等国家,于16世纪引入我国,现主要分布于广东、广西、海南、福建、云南、台湾等省(区)。我国现有菠萝种植面积约66 000 hm2,年产量约167万t,产值近40亿元。菠萝香味浓郁,甜酸适口,具有较高的经济价值,已成为我国热带、亚热带地区农业经济发展的重要支柱之一。菠萝在采后贮藏和运输过程中易发生黑心病(一种采后生理性病害),导致果肉褐变并失去商品性,严重影响菠萝的流通与销售,然而菠萝黑心病的分子机理尚不清楚。最近,有研究者认为蔬果采后劣变过程的实质是逆境胁迫与衰老诱发的细胞凋亡过程[18]。作者前期研究发现,拟南芥S20亚族基因AtMYB108的菠萝同源基因AcMYB108a(基因ID:109718059)在菠萝果实采后劣变过程中显著上调,系统鉴别分析菠萝S20亚族基因将有助于了解其在菠萝采后劣变过程中的作用。本研究基于已报道的菠萝基因组数据库,分离鉴定菠萝S20亚族的全体成员,分析相关成员的转录本、蛋白结构与启动子元件,克隆AcMYB108a基因并进行原核表达,以期为进一步研究菠萝S20亚族基因的生物学功能,解析其与菠萝果实采后劣变的关系,及初步阐明菠萝果实采后劣变的分子机理奠定基础。
1 材料与方法
1.1 试验材料
‘神湾菠萝’无菌苗和原核表达载体pET28a,本课题组保存;大肠杆菌DH5α与Rossetta(DE3)感受态细胞,上海唯地生物技术有限公司;RNA提取试剂盒(货号DP452),天根生物;RNA反转录试剂盒(货号R312-01),诺维赞;TBST漂洗液、Anti-His单抗和AP偶联羊抗鼠多抗,生工生物。
1.2 菠萝S20亚族基因的鉴定
选取拟南芥S20亚族基因AtMYB2、AtMYB62、AtMYB78、AtMYB108、AtMYB112和AtMYB116的蛋白序列,利用TBtools软件[19]的Find Best homology程序比对菠萝蛋白质数据库,获取菠萝S20亚族候选蛋白。从Pfam下载MYB结构域的隐马可夫模型(PF02701),利用Hmmer 3.0软件的Hmmsearch程序搜索菠萝蛋白质数据库,去除冗余序列后利用Pfam进行筛选,得到菠萝MYB蛋白序列集。将TBtools鉴定到的菠萝S20亚族候选蛋白与Hmmsearch获得的菠萝MYB蛋白序列集进行联合分析,确定菠萝基因组中S20亚族成员。
1.3 菠萝S20亚族的系统进化分析
利用ClustalW软件将菠萝、水稻、玉米、番茄、拟南芥等植物的S20亚族蛋白以及作为外群的拟南芥S18、S19亚族蛋白进行序列相似性比对,并通过邻接法(NJ)构建系统进化树,自展法(Bootstrap=1 000)进行检验,最后利用iTOL工具(https://itol.embl.de/)美化。
1.4 菠萝S20亚族基因的结构分析
根据基因组注释信息,获取菠萝S20亚族基因的染色体位置与核苷酸组成等信息。从NCBI下载相关基因的DNA序列,并利用在线工具GSDS2.0(http://gsds.cbi.pku.edu.cn/)绘制基因结构图,展示相关基因的UTR、外显子、内含子等信息。利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析相关基因启动子(基因转录起始ATG前1 500 bp序列),预测各基因启动子的顺式作用元件。
1.5 菠萝S20亚族的基因表达分析
从NCBI-SRA数据库(https://www.ncbi.nlm.nih.gov/sra)下载菠萝RNA-seq数据,根据RNA-seq数据中菠萝S20亚族基因的每千个碱基的转录每百万映射读取的转录本数(TPM值),构建矩阵并绘制基因表达量热图。
1.6 菠萝S20亚族的蛋白序列特征分析
根据菠萝S20亚族基因的蛋白序列,采用ExPASy的ProtParam功能(https://web.expasy.org/compute_pi/)预测相关蛋白的等电点与分子质量(molecular weight, MW),用TargetP(http://www.cbs.dtu.dk/services/TargetP/)预测相关蛋白的亚细胞定位,用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预测相关蛋白的跨膜结构域,用SPOMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测相关蛋白的二级结构。利用MEME软件(https://meme-suite.org/meme/tools/meme)鉴定菠萝S20亚族蛋白的保守基序(motif),相关参数为经典模式,zoops分布,最大结构域数=10。
1.7 菠萝AcMYB108a原核表达载体的构建与诱导表达
以‘神湾菠萝’无菌苗幼叶为材料,采用RNA试剂盒提取叶片总RNA,并利用反转录试剂盒逆转录合成cDNA,于-80 ℃冰箱保存备用。根据NCBI数据库上AcMYB108a的基因序列(NCBI登录号109718059),用primer premier 5软件设计引物pET28a-MYB108a-F和pET28a-MYB108a-R,引物序列为pET28a-MYB108a-F:5′-tataGGATCCATGGAGGACCATGAAAGGGTC-3′,pET28a-MYB108a-R:5′-tataAAGCTTTTATTGGTGCATGAACAGTATGTCC-3′。pET28a-MYB108a-F和pET-28a-MYB108a-R序列中下划线部分分别为BamH Ⅰ、Hind Ⅲ酶切位点,tata为保护碱基,引物由生工生物合成。以菠萝cDNA为模板,PCR扩增菠萝AcMYB108a基因序列。PCR反应体系参考诺维赞2×Phanta Master Mix高保真酶说明书配制。PCR反应程序为:94 ℃预变性4 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,共32个循环;72 ℃延伸5 min。对扩增产物进行琼脂糖凝胶电泳后,切胶回收目的片段,用BamH Ⅰ、Hind Ⅲ双酶切后与经同样双酶切的pET28a载体连接至并转化DH5α感受态,涂布LB平板(含50 mg/L 卡那霉素)后倒置培养12~16 h直至菌落长出。次日,通过菌液PCR筛选阳性克隆,提取重组质粒进行BamH Ⅰ、Hind Ⅲ双酶切和测序验证,验证正确的质粒命名为pET28a-MYB108a。
将pET28a-MYB108a重组质粒转化原核表达菌株Rossetta (DE3) 感受态细胞并涂布LB平板(含50 mg/L卡那霉素),过夜培养后挑取转化子接种于含50 mg/L卡那霉素的液体LB培养基中,37 ℃、200 r/min培养过夜。次日,将种子液按照1∶50的比例加入到含50 mg/L卡那霉素的液体LB培养基中,并继续培养至菌液在600 nm处吸光度(OD600)为0.4~0.6时,加入终浓度为0.5 mmol/L的IPTG诱导表达重组蛋白,对表达产物进行SDS-PAGE电泳检测。
1.8 AcMYB108a重组蛋白的优化表达
为进一步提高AcMYB108a重组蛋白的表达效率,对AcMYB108a的编码序列进行了密码子分析与优化。利用赛默飞公司研发的密码子优化工具Geneoptimizer,在不改变编码氨基酸的前提下,依据大肠杆菌密码子的偏好性对AcMYB108a的基因序列进行碱基替换。密码子优化前,AcMYB108a含有较多稀有密码子,其适应指数(CAI)为0.56,密码子优化后重组蛋白编码序列的CAI为0.81,且避免了稀有密码子的使用。优化后的基因序列由广州艾基生物公司合成并克隆至pET28a载体上,命名为pET28a-MYB108R,对pET28a-MYB108R进行诱导表达、检测,方法同1.7节。
1.9 AcMYB108a重组蛋白的Western blot验证
对pET28a-MYB108a和pET28a-MYB108R诱导表达的总蛋白进行SDS-PAGE电泳(12.5%分离胶)分离,通过电转印转移至PVDF膜上。将转印后的PVDF膜在封闭液(TBST+50 g/L脱脂奶粉)中封闭2 h后,依次在一抗(TBST+30 g/L脱脂奶粉+Anti-His单抗)、二抗(TBST+30 g/L脱脂奶粉+AP偶联羊抗鼠多抗)中各孵育1 h,最后采用NBT/BCIP法对目标条带(AcMYB108a重组蛋白)进行显色。
2 结果与分析
2.1 菠萝S20亚族基因的鉴定
比对结果(表1)显示,在菠萝基因组(F153品种)中共鉴定到5个S20亚族基因成员,分布在染色体Chr4、Chr5、Chr12、Chr18和Chr23上。不同菠萝S20亚族基因的长度差异较大,最短的基因(ID:109723847)长度为1 672 bp,最长的基因(ID:109728373)长度为6 959 bp,平均长度为3 025 bp。菠萝S20亚族基因的平均GC含量为39.28%,与菠萝基因组平均GC含量(38.2%)相近。S20亚族中GC含量最高的是ID为109709211的基因(45.54%),GC含量最低的是ID为109728373的基因(34.14%)。

表1 菠萝S20亚族基因的位置与核苷酸组成
2.2 菠萝S20亚族的系统进化分析
以菠萝、水稻、玉米、番茄、拟南芥的S20亚族蛋白和作为外群的拟南芥S18、S19亚族蛋白序列为样本,通过邻接法(NJ)构建系统进化树。由系统进化分析结果(图1)可知:菠萝、水稻、玉米、番茄等物种的S20亚族蛋白均与拟南芥S20亚族蛋白聚类在一起,进一步证实了本研究鉴定的S20亚族基因的可靠性;双子叶植物拟南芥与番茄S20蛋白的亲缘关系较近,单子叶植物水稻与玉米S20蛋白的亲缘关系较近,而菠萝S20蛋白则倾向于单独聚类;除番茄XP_004240646蛋白外,S20亚族蛋白可进一步划分为2大类群,第Ⅰ类由AtMYB62、AtMYB116、XP_004236420、XP_004239413、XP_020089219、XP_015633684、NP_001334575和NP_001141174组成,第Ⅱ类由AtMYB2、AtMYB78、AtMYB108、AtMYB112等25个S20亚族蛋白组成,表明S20亚族蛋白间存在功能差异。

图1 菠萝S20亚族蛋白的系统进化分析
2.3 菠萝S20亚族成员的基因结构与启动子顺式作用元件分析
通过比对菠萝基因组,确定了S20亚族基因转录本的外显子-内含子结构,结果如图2所示。由图2可知,大多数S20亚族基因(除ID为109728373的基因外)的转录本结构较为相似,均由3个外显子、2个内含子与序列两端的5′UTR和3′UTR序列组成,而ID为109728373的基因转录本由5个外显子、4个内含子(包括1个4 kb的长内含子)与UTR组成。启动子PlantCARE顺式作用元件预测结果(图3)显示,菠萝S20亚族基因启动子均具有MYB、MYC与STRE元件,各基因启动子还分别具有W box、WUN motif等逆境响应元件,说明菠萝S20亚族基因与植物逆境胁迫响应过程有关。除ID为109723847的基因外,其余4个S20亚族基因的启动子具有ERE元件,表明乙烯可能诱导S20亚族基因表达并参与调控与S20亚族相关的生物学过程。
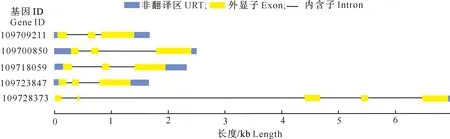
图2 菠萝S20亚族成员的基因结构

图中数字代表各基因具有的顺式作用元件数量
2.4 菠萝S20亚族基因的表达分析
检索NCBI-SRA数据库,选取注释信息明确的PRJNA305042、PRJNA356904和PRJNA393610共3组RNA-seq数据进行分析,其中PRJNA305042为菠萝根、叶、花、不同发育时期果实(未成熟期果实UF-1、UF-2、UF-3,成熟期果实RF-1、RF-2)的转录组数据;PRJNA393610为乙烯处理菠萝茎尖的转录组数据,分为对照组(CK-1、CK-2、CK-3)、低乙烯组(LE-1、LE-2、LE-3)、高乙烯组(HE-1、HE-2、HE-3);PRJNA356904为采后短时热处理菠萝果实的转录组数据,包括2个对照组(CK-1、CK-2)与2个热处理组(ETP-1和ETP-2)。另外,本研究还分析了菠萝果实褐变进程的转录组数据(即菠萝果实褐变转录组数据),包括对照组(CK-1、CK-2、CK-3)、即将褐变组(AB-1、AB-2、AB-3)、褐变组(BH-1、BH-2、BH-3)。根据菠萝S20亚族成员的基因ID检索上述转录组数据,获取相关基因在不同条件下的表达水平。从基因表达热图(图4)可以看出:1)菠萝S20亚族基因的表达具有组织特异性,ID为109718059的基因在各时期菠萝果实中的表达水平均显著高于其他组织,而ID为109709211的基因在花、叶中的表达水平较高,ID为109723847的基因在菠萝根中的表达水平较高;2)尽管S20亚族基因在茎尖生长点(PRJNA393610)的整体表达水平较低,乙烯处理仍提高了部分S20亚族基因(ID为109709211和109728373)的表达量;3)菠萝S20亚族基因的表达水平与果实采后劣变过程正相关,即其表达水平随菠萝果实采后劣变进程的推移逐步升高,而采后短时热处理不仅可以延缓菠萝果实采后的劣变进程,还可以降低菠萝S20亚族基因的表达水平(PRJNA356904)。

TPM.每千个碱基的转录每百万映射读取的转录本数
2.5 菠萝S20亚族蛋白的序列分析
根据菠萝S20亚族基因的蛋白序列,利用ExPASy的ProtParam功能分析相关蛋白的等电点与分子量。由表2可知,除ID为XP_020114354的蛋白外,菠萝S20亚族其余蛋白的分子质量(31.2~32.8 ku)及等电点(4.82~6.47)均较为接近;而ID为XP_020114354的蛋白的氨基酸数目显著多于同家族蛋白,等电点也与其他蛋白存在较大差异;蛋白质二级结构预测表明,菠萝S20亚族蛋白主要由α螺旋(33.45%~54.76%)与无规则卷曲(34.87%~56.21%)组成,其他结构占比较小。TMHMM分析表明,所有菠萝S20亚族蛋白均不具有跨膜结构域,不属于膜蛋白或分泌蛋白。经亚细胞定位预测显示,所有菠萝S20亚族蛋白均定位于细胞核,这与菠萝S20蛋白为转录因子蛋白的生物学功能相符。

表2 菠萝S20亚族蛋白的序列及结构分析
2.6 菠萝S20亚族蛋白的保守基序分析
保守基序(motif)是蛋白质中一段高度保守的氨基酸残基,同一家族蛋白通常具有相似的保守基序。为进一步研究S20亚族蛋白的结构特征,采用MEME软件分析了菠萝与拟南芥、水稻、玉米、番茄S20亚族蛋白的保守基序,并利用TBtools软件绘制了S20亚族蛋白的保守基序分布图。结果(图5)显示,motif3在所有植物的S20亚族蛋白间高度保守,同时拟南芥S18亚族蛋白(AtMYB21、AtMYB24)与S19亚族蛋白(AtMYB120等)均不具有motif3,推测motif3为S20亚族的特征motif,查询Interpro数据库进一步确认motif3归属于MYB转录因子家族中的MYB108亚族(PTHR45675:SF45)。

图5 不同物种S20亚族蛋白的保守基序分析
2.7 菠萝AcMYB108a的基因克隆与原核表达载体构建
根据基因表达分析结果,选取果实褐变过程中表达量最高的ID为109718059的基因进行原核表达分析,参考数据库与系统进化分析结果将该基因命名为AcMYB108a。以菠萝无菌苗RNA逆转录合成的cDNA为模板,PCR扩增AcMYB108a基因片段,结果显示扩增产物长度为750~1 000 bp(图6),与理论大小831 bp相符。pET28a-MYB108a的双酶切结果和pET28a-MYB108R的双酶切结果均在750~1 000 bp处出现一清晰酶切条带,证明插入序列完全正确(图6)。

M.DNA标样;1.AcMYB108a基因的扩增结果;2.重组质粒pET28a-MYB108a双酶切结果;3.重组质粒pET28a-MYB108R双酶切结果
2.8 菠萝AcMYB108a的原核表达
SDS-PAGE结果显示,与IPTG诱导前菌样相比,转化pET28a-MYB108a、pET28a-MYB108R质粒的Rossetta(DE3)菌株诱导2和4 h菌样均在35~48 ku处鉴定到目的蛋白AcMYB108a,且pET28a-MYB108R的蛋白表达量明显高于pET28a-MYB108a(图7),表明密码子优化提升了AcMYB108a重组蛋白的翻译效率和表达量。

M.蛋白分子量标准;1.诱导前菌样;2,3.分别为诱导2和4 h的菌样
2.9 菠萝AcMYB108a重组蛋白的Western blot验证
由于SDS-PAGE分析中目标蛋白条带的分子质量(35~48 ku)大于AcMYB108a重组蛋白的理论分子质量(约35 ku),故需要对其进行二次验证。本研究利用组氨酸标签(His-tag)抗体进行Western杂交,结果在SDS-PAGE电泳提示的蛋白条带位置检测到显色条带(图8),证明该条带确为AcMYB108a重组蛋白。唐威华等[20]认为,重组蛋白表达中常用的组氨酸标签(具有较强正电荷)是造成重组蛋白在SDS-PAGE电泳中出现迁移率异常的主要原因,此外迁移率还与特定蛋白序列有关,DNA结合蛋白常发生迁移率异常现象。P73-His重组蛋白在SDS-PAGE电泳中的表观分子质量为33 ku,远大于其实际分子质量17.3 ku[20]。苹果转录因子MdHB1重组蛋白在电泳中的表观分子质量为55 ku,大于其实际分子质量44.4 ku[21]。因此,AcMYB108a重组蛋白所具有的组氨酸标签与DNA结合域可能是造成本研究中重组蛋白表观分子量大于其实际值的原因。

M.蛋白分子量标准;1.诱导前菌样;2,3.分别为诱导2和4 h的菌样
3 讨论与结论
S20亚族是R2R3-MYB转录因子家族的一个重要分支,在植物组织发育与逆境胁迫响应过程中发挥着重要作用[8,10,14-15,17]。本研究基于菠萝基因组与蛋白质数据库,共鉴定到5个菠萝S20亚族基因(其中ID为109709211的基因具有可变剪切),数目与拟南芥(6个)相近,但少于番茄(7个)、水稻(7个)和玉米(9个)。研究菠萝S20亚族成员的进化与功能对于探讨菠萝逆境胁迫响应与果实品质形成具有重要意义。S20亚族蛋白的系统进化分析显示,菠萝及其他物种的S20亚族蛋白均可分为2大类群。这一方面说明S20亚族蛋白在菠萝与其他物种间具有较高的保守性,不同物种S20亚族蛋白均具有保守结构域motif3就进一步印证了这一点;另一方面说明菠萝S20亚族内部各蛋白间也存在功能差异。不同物种的S20亚族蛋白数目不同,这可能是不同植物基因复制与进化模式不同所致。
顺式作用元件在基因转录起始调控中发挥着重要作用,启动子中顺式元件的类型和数量直接影响着基因的表达模式。GST1基因、香蕉MA-ACS1和MA-ACO1基因的启动子区均具有乙烯响应元件ERE,可接受外源乙烯的诱导[22-23];极端pH、乙醇等胁迫信号经由HOG信号通路作用于酵母相关基因启动子的STRE元件,进而调控下游基因的表达[24];Manimaran等[25]采用不同长度的OsIPP3启动子(具有数量不同的顺式作用元件)驱动GUS基因的表达,证实GUS的表达水平随着顺式作用元件数量的减少而降低。本研究发现,菠萝S20亚族基因的启动子区具有MYB、MYC、STRE等逆境响应元件以及乙烯响应元件ERE,初步说明菠萝S20亚族基因与逆境胁迫响应有关,并且乙烯参与调控S20亚族基因的表达及其相关生物学过程。
转录组学是研究基因结构、功能与表达的重要手段。近年来,随着高通量测序技术的不断发展,转录组测序技术实现了由基因芯片技术、基因表达系列分析技术(SAGE)、大规模平行测序技术(MPSS)到RNA测序技术(RNA-seq)的跨越式发展。目前应用最广泛的转录组技术是基于二代测序的RNA-seq技术,具有高分辨率、高通量与高灵敏度等优点,利用RNA-seq鉴定不同品种或不同处理间的差异基因已成为发掘功能基因的常见思路[26-27]。本研究通过分析不同来源的RNA-seq数据证实,乙烯能诱导部分菠萝S20亚族基因表达(PRJNA356904);菠萝S20亚族基因的表达水平与菠萝果实的褐变进程正相关,采后热处理不仅延缓了菠萝果实的褐变进程,而且也抑制了其S20亚族基因的表达(PRJNA393610)。
为进一步研究菠萝S20亚族基因的生物学功能,阐明相关基因与菠萝果实采后褐变的关联性,本研究选取果实中表达水平最高的S20基因AcMYB108a,采用pET表达系统在大肠杆菌中诱导表达AcMYB108a重组蛋白。与真核表达系统相比,原核表达系统具有操作简单、繁殖快、蛋白表达量高等优点[28]。外源基因在大肠杆菌中的高效表达,受到片段GC含量、密码子偏好性、诱导条件等多重因素的共同影响[29]。本研究针对原核表达系统对菠萝AcMYB108a的编码序列进行了优化,筛选了合适的诱导条件,成功诱导了AcMYB108a重组蛋白,并通过Western blot进行了杂交验证。后续将进一步表达、纯化AcMYB108a重组蛋白,用于AcMYB108a的EMSA等试验。
