CFH基因突变致不典型溶血尿毒综合征一例
2022-12-07郭建群董蓓君谢文辉马颐姣高晓洁
郭建群,董蓓君,谢文辉,马颐姣,高晓洁
深圳市儿童医院肾脏内科,广东 深圳 518038
溶血尿毒综合征(hemolytic uremic syndrome,HUS)是儿科肾脏科的危重症之一,临床特点为微血管病性溶血性贫血、血小板减少及急性肾损伤,可引起肾功能异常并严重影响患儿预后[1]。HUS可分为典型(腹泻相关性) HUS 和非典型(非腹泻相关性) HUS(atypical hemolytic uremic syndrome,aHUS),aHUS 占HUS病例的5%~10%[2],总体预后较差,25%的患者在急性期死亡,50%以上患者进展至ESRD[3]。已知aHUS 与补体结构和功能异常有关,多种补体相关基因,如CFH基因、CFI基因、MCP基因突变均可以导致aHUS,其中以CFH 基因突变最为常见。为分析CFH基因突变导致aHUS 的特点及预后,本文回顾性分析1 例CFH 基因突变导致aHUS 的病例,并结合病例进行文献复习,以加强对该病的认识,为广大儿科医务工作者提供参考借鉴。
1 病例简介
1.1 病史 患儿男性,9 个月龄,因“发热2 d,口唇苍白半天”入院。患儿以发热为主要表现,伴口唇苍白,进行性加重,无咳嗽,无皮疹,无尿色异常,无排尿时哭闹,无腹泻,尿量较前减少,约为平时量的1/2,在家予自备“布洛芬”退热治疗,体温可降至正常,易反复。患儿既往体质一般,否认葡萄糖-6-磷酸脱氢酶缺乏症病史,其母既往因胎停流产2 胎,原因不详,家族中无类似疾病家族史。
1.2 入院查体 脉搏(P) 124 次/min,体温(T)39.4℃,R 28 次/min,血压(Bp)95/60 mmHg(1 mmHg=0.133kPa)。神志清楚,精神可,口唇苍白,面色苍黄,全身未见皮疹及出血点,心肺腹及神经系统查体无特殊。
1.3 入院后检查 血常规:白细胞9.33×109/L,中性粒细胞百分比42.7%,血红蛋白60 g/L,血小板48×109/L,超敏C 反应蛋白2.0 mg/L;网织红细胞比率15.3%;尿常规:蛋白3+,潜血3+,红细胞924.8/μL;生化:总胆红素41.2 μmol/L,间接胆红素35.1 μmol/L,尿素20.18 mmol/L,肌酐100.8 μmol/L,乳酸脱氢酶1 806 IU/L,补体C3 0.81 g/L,补体C4 0.16 g/L;降钙素原0.71 ng/ml;直接抗人球蛋白试验阴性;血涂片可见红细胞大小不一,可见约10%裂红细胞;血液串联质谱、尿筛查未见异常;骨髓涂片提示成熟红细胞大小不等,可见椭圆形、靶形、裂片形、点彩形红细胞,裂红细胞占比11.5%;泌尿系超声检查提示双肾实质弥漫性损伤;血管性血友病因子裂解蛋白酶13(a disintegrin and metalloprotease with a thrombospondin type 1 motif,member 13,ADAMTS13)活性96.6%,ADAMTS13 抗体阴性;肾活检符合血栓性微血管病改变,见图1和图2;粪便培养提示肺炎克雷伯菌;全基因检测提示CFH 基因杂合变异(c.3572C>T),见图3。

图1 CFH-aHUS患儿肾活检病理光镜图像
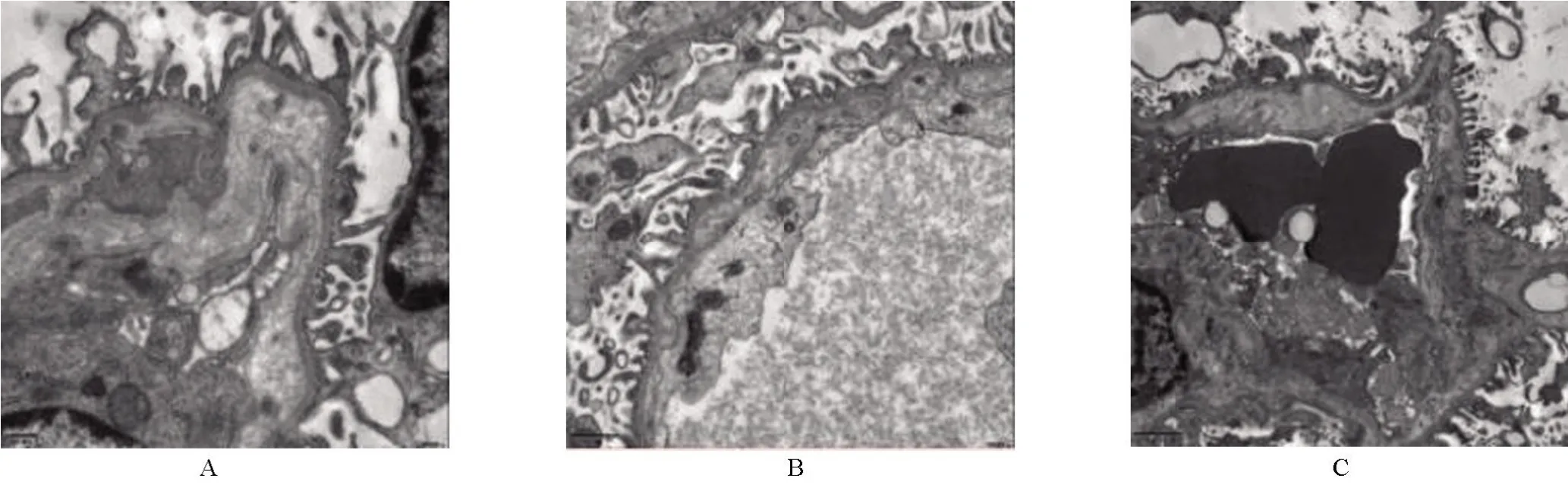
图2 CFH-aHUS患儿肾活检病理电镜图像

图3 CFH-aHUS患儿的基因检测结果
1.4 诊治经过 入院后根据患儿有溶血性贫血、血小板减少及急性肾损伤,考虑HUS,因患儿无典型前驱腹泻病史,粪培养未培养出O157:H7 大肠埃细菌,不支持典型HUS;患儿血液串联质谱、尿筛查未见异常,不支持维生素B12缺乏导致HUS;患儿无肺炎链球菌感染证据,不支持肺炎链球菌相关HUS;患儿无器官移植及恶性肿瘤病史,不支持继发性HUS;ADAMTS13活性正常,不支持血栓性血小板减少性紫癜,经过以上鉴别诊断过程,诊断aHUS,根据全基因检测提示CFH基因杂合变异(c.3572C>T),最终诊断为CFH基因突变导致的aHUS(CFH-aHUS)。治疗上:患儿初期诊断aHUS 后行血浆置换17 次,并间断输注血浆、去白细胞悬浮红细细胞,积极抗感染,并以地塞米松、泼尼松治疗,患儿病情好转出院,出院时肾功能正常,后因感染后再次复发3 次,复发后继续血浆置换,期间以CTX冲击治疗,效果欠佳,尿素、肌酐进行性升高,估计肾小球滤过率(estimated glomerular filtration,eGFR)进行性下降,并有少尿、高血压脑病、心力衰竭、呼吸衰竭、急性肺水肿,经气管插管呼吸机辅助通气、强心、利尿、多种药物降压等治疗后病情稳定,后自动出院至外院治疗,在外院治疗期间死亡。
2 讨论
aHUS几乎都由补体替代途径的遗传性或获得性缺陷引起,表现为失控的补体激活和补体相关自身抗体的产生,导致包括肾脏在内的器官损伤和衰竭。aHUS 的病因包括基因异常、感染、自身免疫、移植和药物等因素,涉及基因包括CFH、CFI、MCP、C3、CFB、THBD、DGKE和CFHR等[4],在基因异常所致的aHUS中,以CFH基因突变所致者最为常见,占aHUS总病例的23%~27%[5]。携带CFH 基因突变的患儿的平均发病年龄在6个月,此类患儿随访3~5年ESRD或死亡的风险高达77%[6],故CFH 基因突变与aHUS 的不良预后密切相关[7]。
CFH是补体旁路途径中重要的负调控因子,可与沉积在细胞表面上的C3b 结合,抑制补体旁路途径激活[8],影响C3 及C5 转化酶形成,在控制补体激活中起关键作用,并能保护自身细胞免受免疫攻击[9]。此外,CFH作为一种重要的先天免疫的效应分子,在鉴别自我细胞和微生物方面起核心作用[10]。
CFH-aHUS的一线治疗是血浆置换和血浆输注[11],且前者疗效优于后者,血浆治疗可以提供正常的CFH来弥补因CFH 基因变异或存在抗CFH 抗体引起的CFH不足或功能异常,通过该治疗至少70%患者的血液学指标可以得到缓解,虽然血浆治疗降低了CFH-aHUS患者的死亡率,但48%的儿童和67%的成人患者在3年的随访时间内死亡或达到ESRD。依库珠单抗是一种针对补体C5 的单克隆人源化抗体,通过阻断C5 的裂解,可以减少补体激活、炎症、内皮损伤及膜攻击复合物C5b-9的形成,可使肾功能显著改善,减少或停止血浆治疗[12]。因儿童在血浆置换过程中出现导管相关并发症的风险较成人高,已有文献建议在儿科病例中使用依库珠单抗作为CFH-aHUS 的一线治疗方案[13]。治疗上暂不推荐肾移植,原因有CFH-aHUS 的不完全外显率及CFH的基因多态性,肾移植不能改善CFH缺乏或功能异常的状况,有研究显示50%~100%的CFH-aHUS 患者接受肾移植后再次出现HUS,且于复发后多进展至ESRD。因CFH 主要由肝脏产生,肝肾联合移植已被证实可以改善CFH-aHUS 的病情及预后[14],将来可能会有更广阔的应用空间。本病例在确诊后行血浆置换病情可缓解,后因感染多次复发,虽经积极血浆置换治疗,肾功能仍进行性恶化,最终导致死亡。如能在避免感染的基础上应用衣库珠单抗治疗或行肝肾联合移植,预后可能不同。
aHUS 通过排除典型HUS、血栓性血小板减少性紫癜和继发性血栓性微血管病等进行诊断。对可引起aHUS的基因进行筛查对确定aHUS诊断、决定治疗策略、估计治疗效果和预后很重要,应尽早完善基因检测[15]。CFH-aHUS 治疗以血浆置换为主,依库珠单抗可以改善病情,肝肾联合移植值得期待。
