壳聚糖-卡那霉素接枝物的制备及抑菌性能研究
2022-12-06何俊鹏欧阳茜茜王艺瑾盛军田洋高斌
何俊鹏 欧阳茜茜 王艺瑾 盛军 田洋 高斌
壳聚糖-卡那霉素接枝物的制备及抑菌性能研究
何俊鹏1,2,3欧阳茜茜4,5王艺瑾1,2,3盛军2,3田洋1,2,3高斌1
(1. 云南农业大学食品科学技术学院 云南昆明 650201;2. 食药同源资源开发与利用教育部工程研究中心 云南昆明 650201;3. 云南省生物大数据重点实验室 云南昆明 650201;4. 广东医科大学海洋医药研究院 广东湛江 524023;5. 广东湛江海洋医药研究院 广东湛江 524023)
壳聚糖被广泛应用于食品中,但其抑菌性能较弱。为了提高壳聚糖的抑菌性能,接枝卡那霉素,制备壳聚糖-卡那霉素接枝物,将其作为一种理想的抑菌材料应用到食品中。以壳聚糖和卡那霉素为主要原料,通过单因素试验研究反应温度、反应时间及高碘酸钠用量对壳聚糖氧化醛基含量的影响,结合响应面试验优化确定壳聚糖氧化的最佳条件;将氧化的壳聚糖粉末溶液与卡那霉素溶液混合,在60℃的油浴锅中反应6 h,得到壳聚糖-卡那霉素接枝物溶液;经透析冷冻干燥得到接枝物,将壳聚糖和接枝物进行抑菌性能比较。结果表明:壳聚糖氧化的最佳条件为反应时间4 h、高碘酸钠用量4.8 g、反应温度40℃,在此条件下计算出醛基含量为4.89 mmol/g,理论值(4.07 mmol/g)与试验值的相对偏差为0.82%;将氧化的壳聚糖与卡那霉素进行席夫碱反应,显示卡那霉素成功接枝上,元素分析计算得知,接枝物中卡那霉素的接枝率达到52%;通过抑菌试验可知,接枝物的抑菌性能优于壳聚糖。
壳聚糖;卡那霉素;响应面法;结构表征;抑菌性能
壳聚糖(Chitosan,CS)具有优异的降解性、相容性及一定的抑菌性,在许多领域(食品、医药)被应用[1-3],也常作为保鲜剂用于食品中;但是由于其溶解性较差,只能在酸性介质中溶解,限制了其抑菌性能和在食品中的应用。卡那霉素具有很强的抑菌性能,因此可通过接枝卡那霉素来改性壳聚糖,并且壳聚糖基抗菌材料是当前的研究热点,具有良好的抑菌性能[4-6];研究者采用化学改性的方法来改善壳聚糖的溶解性和抑菌性能,使其具有更广泛的应用前景[7-8]。目前对壳聚糖改性的方法有在壳聚糖的羟基部分引入烷基,生成衍生物[9]。壳聚糖衍生物有3种合成方法:N-邻苯二甲酰化法[10]、生成席夫碱法[11]、金属模板合成法等[12],也可以利用等离子体对材料进行改性,改变其抗菌性[13-14]。壳聚糖衍生物被认为是增加壳聚糖抑菌性能的最佳选择之一,因为醛或酮的羰基可以与壳聚糖的-NH2基团有效偶合,形成具有亚胺基团特征的壳聚糖席夫碱[15]。壳聚糖席夫碱衍生物改变了壳聚糖的分子结构,增强了其亲水性并增加了带正电荷的离子数量,与未改性壳聚糖相比,壳聚糖席夫碱衍生物的抑菌活性更优异[16-17]。
卡那霉素(Kanamycin,KANA),属于氨基糖苷类抗生素[18]。氨基糖苷类(aminoglycosides,AGs)药物主要用于抑制革兰氏阴性细菌,使细菌不能生长[19-20],但是这类药物具有较强的毒性[21-22]。抗生素药物会进入人体的毛细胞,诱导其产生大量的活性氧(reactive oxygen species,ROS)[23],从而导致毛细胞发生氧化损伤,促进其凋亡[24],并且抗生素的不合理使用会导致耐药细菌的产生。
目前经壳聚糖化学改性形成的衍生物有很多,但壳聚糖接枝卡那霉素形成的接枝物目前尚未见报道。本研究旨在通过接枝卡那霉素对壳聚糖进行改性,形成大分子化合物,一方面可以增强壳聚糖的抑菌性能和溶解性,另一方面降低卡那霉素的副作用,并把制备好的接枝物(壳聚糖-卡那霉素接枝物,CS-KANA)作为保鲜剂应用到食品中,为进一步研究其抑菌性能提供理论基础。
1 材料与方法
1.1 材料
1.1.1 试剂 大肠杆菌(CMCC 10389,中国工业微生物菌种保藏管理中心);金黄色葡萄球菌(ATCC 10384,中国工业微生物菌种保藏管理中心);壳聚糖(分子量:544 kDa,脱乙酰度:90%)、硫酸卡那霉素、盐酸羟胺(分析纯,索莱宝生物科技有限公司);冰乙酸、甲醇(分析纯,江苏强盛功能化学股份有限公司);高碘酸钠、乙二醇(分析纯,江苏强盛功能化学股份有限公司);百里酚蓝(分析纯,天津市光复科技发展有限公司);氢氧化钠(分析纯,天津市风船化学试剂科技有限公司);1 μm尼龙滤膜(海宁市联众过滤设备有限公司);透析袋(8 000 Da,上海叶源生物有限公司)。
1.1.2 仪器与设备 YP-5001电子分析天平(上海光正医疗仪器有限公司);pHS-3C雷磁pH计(上海仪电科学仪器股份有限公司);HH-11-2恒温水浴锅(常州诺基仪器有限公司);HH-W3S旋转蒸发仪(上海亚荣生化仪器厂);FD-1A-50冷冻干燥机(北京四环科学仪器厂有限公司);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);SHZ-D(111)循环水式多用真空泵(上海亚荣生化仪器有限公司)。
1.2 方法
1.2.1 氧化壳聚糖(OCS)单因素实验设计
1.2.1.1 不同反应时间的影响 将3 g的壳聚糖粉末溶于200 mL 1%乙酸溶液中,在40℃的条件下搅拌3 h;加入质量为4.8 g、浓度为0.22 moL/L的高碘酸钠溶液100 mL,并把混合的溶液放在水浴锅中,在一定温度和避光条件下分别反应2、3、4、5、6、7 h;加入乙二醇溶液(20 mL,0.1 mol/L)终止反应1 h,透析2 d,将透析好的溶液在50℃下用蒸发浓缩仪进行浓缩和冷冻干燥。
1.2.1.2 不同反应温度的影响 称取壳聚糖的质量和溶解方式与1.2.1.1相同,加入质量为4.8 g、浓度为0.22 moL/L的高碘酸钠溶液100 mL,并把混合的溶液放在水浴锅中,避光条件下分别在20、30、40、60、70℃下反应一段时间;加入乙二醇溶液(20 mL,0.1 mol/L)终止反应1 h,透析2 d,将透析好的溶液在50℃下用蒸发浓缩仪进行浓缩和冷冻干燥。
1.2.1.3 不同用量高碘酸钠溶液的影响 称取壳聚糖的质量和溶解方式和1.2.1.1相同,分别加入壳聚糖与高碘酸钠质量比为5∶1、5∶2、5∶4、5∶6、5∶8、5∶10的高碘酸钠溶液100 mL,在一定温度和避光条件下反应一段时间;加入乙二醇溶液(20 mL,0.1 mol/L)终止反应1 h,透析2 d,将透析好的溶液在50℃下用蒸发浓缩仪进行浓缩和冷冻干燥。
1.2.2 氧化壳聚糖醛基含量和氧化度计算 参考潘志文等[1]并稍作修改。在锥形瓶中加入质量浓度为20 g/L的盐酸羟胺-甲醇溶液50 mL,向锥形瓶内滴加百里酚蓝指示剂,此时溶液呈现出紫色;用0.03 mol/L的氢氧化钠-甲醇溶液,滴加至溶液呈黄色,此时不计氢氧化钠-甲醇溶液的体积;向锥形瓶中加入0.1 g制备的CS-KANA,振荡锥形瓶使溶液充分混合,若样品中含有醛基,溶液会立即变成粉红色;使用0.03 mol/L的氢氧化钠-甲醇溶液继续滴定使溶液变成黄色,并且不变色30 s,如果变色应该继续滴定到不变色,然后记录氢氧化钠-甲醇溶液最终的滴定体积。醛基含量的计算公式如下:

式中:(CHO)为样品中醛基的含量,单位mmol/g;0.03表示氢氧化钠-甲醇溶液的浓度,单位mol/L;为滴定结束后使用的氢氧化钠-甲醇的体积,单位L;为加入样品的质量,单位为g。
利用得到的醛基含量值,可以计算得到样品的氧化度(OD),单位为%。计算公式如下:

式中:为样品的氧化度;(CHO)为样品中醛基的含量,单位mmol/g;1/2指一个氧化后的壳聚糖单体分子含有2 mol的醛基;为加入样品的质量,单位为g。
1.2.3 响应面实验方法 在单因素实验基础上,参考Box-Behnke实验设计原理,以醛基含量为响应值,利用设计专家软件,以反应时间、反应温度以及高碘酸钠用量为主要考察因子,如表1所示。

表1 Box-Behnken实验设计
1.2.4 壳聚糖-卡那霉素接枝物的制备 壳聚糖-卡那霉素接枝物的制备:用1%醋酸溶液溶解氧化壳聚糖,用1 μm的滤膜过滤,调节滤液pH为6.0;加入卡那霉素溶液(氧化壳聚糖与硫酸卡那霉素的质量比为1∶1),加热到60℃,搅拌6 h,使氧化壳聚糖上的醛基与卡那霉素上的氨基发生席夫碱反应生成碳氮双键;用蒸馏水透析3 d,然后收集溶液进行冷冻干燥,即得到接枝物。
1.2.5 傅里叶红外光谱分析 分别将壳聚糖、卡那霉素、氧化壳聚糖和壳聚糖-卡那霉素样品与溴化钾(KBr)干粉混合[(样品)∶(KBr)=1∶100];混合均匀后研磨,用压片器压成透明薄片状,然后测定样品的红外光谱(FT-IR)。
1.2.6 接枝率分析 采用Flash EA 1112型号元素分析仪分别对壳聚糖、氧化壳聚糖和壳聚糖-卡那霉素接枝物进行C、N元素的含量测定。测试方法为杜马斯燃烧法,使得测试样品的N转化成N2,所有形式的C都转化为CO2,最后CO2和N2通过色谱柱分离;分别用热导检测器检测,得出C、N含量,从而计算接枝率,标准品为天门冬氨酸和尿素。接枝率计算公式如下:

式中:为氧化壳聚糖中的N含量;为卡那霉素接枝率;为硫酸卡那霉素中N含量;为壳聚糖-卡那霉素中的N含量。
1.2.7 接枝物最低抑菌浓度(MIC)的测定 接枝物对金黄色葡萄球菌()、大肠杆菌()的抑菌率,是通过计算营养琼脂稀释法培养的细菌生长菌落数来测定[25]。首先,在细菌培养液(107CFU/mL)中加入配好的接枝物母液(称取一定质量的接枝物,然后用1%乙酸溶解,配成的母液浓度为10 mg/mL),使各试管的浓度分别为0.64、0.32、0.16、0.08、0.04、0.02、0 mg/mL(0为正常组,菌液浓度为107CFU/mL,不加任何试剂),在37℃下振荡培养24 h;取出100 μL细菌培养物并用无菌生理盐水连续稀释至预定浓度;将100 μL稀释的溶液滴加在营养琼脂平板上,轻轻地用无菌涂布棒在平板上均匀地涂布;随后置于37℃培养箱中培养24 h,获得活微生物菌落并计数(抑菌率达到90%为接枝物的MIC)。

1.2.8 抑菌率的测定 通过1.2.6的方法得到接枝物的MIC,重复1.2.7中的步骤计算壳聚糖和接枝物在同等浓度下的抑菌率。
1.2.9数据处理 每一个实验结果的测定都重复3次,结果取3次平均值,采用Excel 2013、SPSS 24、Graphpad Prism5对实验数据进行整理及统计分析,利用Design-Expert 8.0.6进行响应面分析。
2 结果与分析
2.1 单因素实验结果
2.1.1反应时间对氧化壳聚糖醛基含量和氧化度的影响 由图1可知,反应前期,当反应时间为2~4 h时,醛基含量与氧化度都呈现逐渐递增的趋势,且醛基含量都在4 mmol/g以上,氧化度在30%~40%;反应后期,当反应时间为5 ~7 h时,醛基含量、氧化度都呈现递减趋势,醛基含量在4 mmol/g以下,氧化度在30%以下。因为随着反应时间的增加,醛基会被氧化成羧基,导致醛基含量下降。综上所述,最佳的反应时间为4 h。

图1 反应时间对醛基含量和氧化度的影响(n=3)
2.1.2 反应温度对醛基含量和氧化度的影响 由图2可知,当反应温度为20~40℃时,醛基含量与氧化度呈现逐渐增加的趋势,并在40℃为最高值,醛基含量达到5.5 mmol/g,氧化度接近40%;当反应温度为50~70℃时,醛基含量与氧化度逐渐减少,在70℃为最低值;因为随着温度的升高,高碘酸钠会发生热分解,导致醛基含量下降。综上所述,最佳的反应温度为40℃。
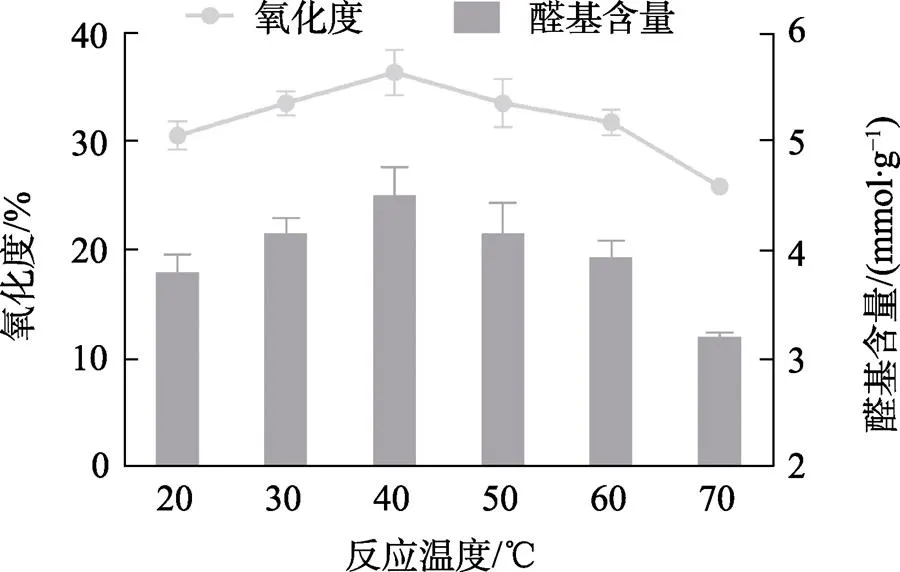
图2 反应温度对醛基含量和氧化度的影响(n=3)
2.1.3 高碘酸钠用量对醛基含量和氧化度的影响 由图3可知,增加高碘酸钠的用量,醛基含量和氧化度也会随之增加,并且随着高碘酸钠用量的增加,溶液的颜色从淡黄色变为紫红色;当高碘酸钠用量为4.8 g时,醛基含量和氧化度接近最高点,分别接近4 mmol/g、30%,随着高碘酸钠用量的增加,醛基含量和氧化度基本不变。综上所述,最佳高碘酸钠用量为4.8 g。

图3 高碘酸钠用量对醛基含量和氧化度的影响(n=3)
2.2 响应面实验设计结果
2.2.1 回归模型的建立及方差分析 根据单因素实验结果,进行响应面优化试验设计,实验结果见表2、3。
以反应时间、反应温度以及高碘酸钠用量为主要考察因子,同时以醛基含量为响应值,对表3的数据进行分析处理,通过二次方程式拟合(非线性),得到醛基含量(值)的目标函数的二次回归方程。

表2 Box-Behnken实验设计及结果

表3 响应面实验回归模型方差分析
注:**表示差异极显著(<0.01)*表示差异显著(<0.05)。
=4.66–0.035–8.750E–0.03–0.036–0.09–0.025–0.452–0.432–0.342
由表3可知,模型值为0.000 2,说明该模型极显著。失拟项值为0.936 2,大于0.05,不显著,说明该回归模型与实际试验有较好拟合性,自变量与醛基含量之间关系显著。相关系数2为0.925 6,2为0.967 5,说明响应面法设计所得的回归模型有效,预测效果较佳,可用该模型对壳聚糖的醛基含量及氧化度进行分析和预测。2、2及2的值均小于0.01,表明影响极显著。3个单因素影响壳聚糖的醛基含量、氧化度的顺序均为高碘酸钠用量>反应时间>反应温度,即高碘酸钠的用量对壳聚糖的醛基含量以及氧化度的影响最显著。
2.2.2 最佳条件的确定和回归模型的验证 经Box-Behnken实验设计,利用设计专家软件对试验数据进行分析处理后,得到氧化壳聚糖的最优条件为高碘酸钠用量4.8 g,温度40℃,时间4 h;在此条件下,获得氧化壳聚糖的醛基含量为4.89 mmol/g,理论值4.07 mmol/g与试验值的相对偏差为0.82%,验证了此模型的准确性和有效性。
2.3 傅里叶变换红外光谱分析
壳聚糖的红外光谱分析结果(图4)显示:3 380 cm–1处为-OH的伸缩振动重叠后的多重吸收峰,2 924和2 878 cm–1处为C-H的伸缩振动吸收峰[25-26],1 656 cm–1处为壳聚糖(C-O)的伸缩振动峰,1 596 cm–1处为壳聚糖的(N-H)的面内弯曲振动,1 380 cm–1处左右出现了吸收峰,这是由CH3的对称变形振动引起的[27]。壳聚糖被氧化后,1 656和1 596 cm–1处的峰会合并成一个峰,被氧化后会在1 721 cm–1处出现一个新的峰[28],且由于卡那霉素接枝壳聚糖后形成碳氮双键,在1 657 cm–1波长处出现峰[29]。结果表明,卡那霉素成功接枝到壳聚糖上。

图4 CS,OCS,KANA和CS-KANA的红外光谱图
2.4 接枝率分析
由表4可知,CS、OCS、CS-KANA的C含量依次减少,从39.38%逐渐减少为37.74%,N含量也呈减少趋势。氧化壳聚糖的C/N高于壳聚糖的C/N,原因是其在氧化过程中产生具有挥发性的NH3[30]。将卡那霉素接枝到氧化壳聚糖上提高了N含量,降低C/N,因为一分子卡那霉素有5个氨基。根据N的变化,计算出壳聚糖-卡那霉素接枝物中卡那霉素的接枝率约为52%。

表4 CS、OCS和CS-KANA的元素分析
2.5 接枝物对大肠杆菌和金黄色葡萄球菌最低抑菌浓度(MIC)测定
由图5-A、5-D可知,当接枝物浓度为0.16 mg/mL时,通过涂板计算得到金黄色葡萄球菌()的抑菌率大于90%。由图5-B、5-C可知,当接枝物浓度为0.32 mg/mL时,涂板计算得到大肠杆菌()的抑菌率大于90%。因此接枝物对大肠杆菌()和金黄色葡萄球菌()的MIC分别为0.32、0.16 mg/mL。

A. S.aureus; B. E.coli; C. E.coli; D. S.aureus。
2.6 抑菌率测定
由图6-A、6-B可知,在最低抑菌浓度下通过涂板分析CS和接枝物对大肠杆菌()和金黄色葡萄球菌()的抑菌率。由图6-C可知,在同等浓度(0.16 mg/mL)下,接枝物对金黄色葡萄球菌()的抑菌率大于CS,并且具有显著性差异。由图6-D可知,在同等浓度(0.32 mg/mL)下,接枝物对大肠杆菌()的抑菌率大于CS,并且具有显著性差异。因此,接枝物的抑菌性能优于CS。

A. S.aureus; B. E.coli; C. S.aureus; D. E.coli。
3 结论
本实验通过单因素和响应面优化得到最优的氧化壳聚糖参数为高碘酸钠用量4.8 g,温度40℃,时间4 h。在此条件下,醛基含量为4.89 mmol/g,通过席夫碱反应将卡那霉素接枝到氧化壳聚糖上。傅里叶变换红外光谱分析结果表明,卡那霉素成功接枝到壳聚糖上,元素分析结果表明,卡那霉素的接枝率为52%。在接枝物的最低抑菌浓度下涂板分析接枝物的抑菌率大于CS,说明接枝物的抑菌性能优于CS。
[1] 潘志文. 壳聚糖及其衍生物复合材料的制备与应用研究[D]. 苏州: 苏州大学, 2019.
[2] 付佳玉, 钟志梅. 新型壳聚糖衍生物的生物活性研究[J]. 化工管理, 2021(31): 70-74..
[3] Naveed M, Phil L, Sohail M, et al. Chitosan oligosaccharide (COS): An overview[J]. Int J Biol Macromol, 2019, 129: 827-843.
[4] Khan A, Alamry K A. Recent advances of emerging green chitosan-based biomaterials with potential biomedical applications: A review[J]. Carbohyd Res, 2021, 506: 108 368.
[5] Pelegrino M T, Pieretti J C, Nakazato G, et al. Chitosan chemically modified to deliver nitric oxide with high antibacterialactivity[J]. NitricOxide, 2021, 106: 24-34.
[6] An J, Ji Z X, Wang D S, et al. Preparation and characterization of uniform-sized chitosan/silver microspheres with antibacterial activities[J]. Mat Sci Eng C, 2014, 36: 33-41.
[7] 宋玉民, 常彩萍, 达文燕, 等. 壳聚糖的改性及抑菌性研究[J]. 西北师范大学学报(自然科学版), 2010, 46(3): 71-74.
[8] 姚剑松, 左华江, 徐然, 等. 壳聚糖的抗菌改性及应用[J]. 广东化工, 2019, 46(21): 70-71+77.
[9] 马宁, 汪琴, 孙胜玲, 等. 甲壳素和壳聚糖化学改性研究进展[J]. 化学进展, 2004(4): 643-653.
[10] 王爱勤, 俞贤达. O-丁烷基壳聚糖的合成与表征[J]. 合成化学, 1999(3): 308-310+314.
[11] 蒋挺大. 甲壳素和壳聚糖的制备及副产物的利用[J]. 水产科学, 1997(5): 31-33.
[12] 曲培培, 张清, 丁树民, 等低温等离子体在材料表面改性中的应用[J]. 广东化工, 2018, 45(14): 146-147.
[13] LI Y, WU CH, BAI Y, et alEffect of glow discharge plasma on surface modification of chitosan film[J]. Int J Biol Macromol, 2019, 138: 340-348.
[14] 黄春桃, 刘国光, 姚琨, 等. 壳聚糖-膨润土复合材料的研究进展[J]. 广东农业科学, 2012, 39(8): 161-164.
[15] 薛文曼, 王飞, 王慧芳, 等. 壳聚糖的改性及其抗菌性能研究进展[J]. 化工新型材料, 2020, 48(11): 49-53.
[16] Oyervides-Munoz E, Pollet E, Ulrich G, et al. Original method for synthesis of chitosan-based antimicrobial agent by quaternary ammonium grafting[J]. Carbohydrate Polymers, 2017, 157: 1 922-1 932.
[17] John Torsten, Thomas Trayder, Abel Bernd, et al. How kanamycin A interacts with bacterial and mammalian mimetic membranes[J]. Bba, 2017, 18(11): 59-60.
[18] 丁大连, Richard Salvi. 氨基糖苷类抗生素耳毒性研究[J]. 中华耳科学杂志, 2007(2): 125-131.
[19] Liu Y, Yu Y, Chu H, et al. 17-DMAG induces Hsp70 and protects the auditory hair cellsfrom kanamycin ototoxicity[J]. Neurossci Lett, 2015, 588: 72-77.
[20] SIJG. Advances in prevention and treatment of drug-induced deafness[J]. Chin J Pharmacov, 2013, 12: 730-733.
[21] BARROS L, MORALES P, CARVALHO A M, et al. Antioxidant potential of wild food plants[M]. New York: Springer, 2016: 209-232.
[22] BEECK K D, SCHACHT J, CAMP G V. Apoptosis in acquired and genetic hearing impairment: the programmed death of the hair cell[J]. Hear Res, 2011, 28: 18-27.
[23] CHUN K J, LEE C H, KIM K W, et al. Effects of Androgen Receptor Inhibition on Kanamycin-Induced Hearing Loss in Rats[J]. Int J Mol Sci, 2021, 22(10):
[24] 王玲, 郭志廷, 杨峰, 等. 中药常山散的体外抑菌作用研究[J]. 中国畜牧兽医, 2017, 44(2): 594-600.
[25] SONG P, XU Z, DARGUSCH MS,. Granular Nanostructure: A Facile Biomimetic Strategy for the Design of Supertough Polymeric Materials with High Ductility and Strength[J]. Adv Mater, 2017, 29(46): 1-7.
[26] QIAN M, SUN Y, XU X, et al. 2D-alumina platelets enhance mechanical and abrasion properties of PA612 via interfacial hydrogen-bond interactions[J]. Chem Eng J, 2017, 308: 760-771.
[27] JAA B, YUE ZC, MISA B, et al. In-situ crosslinked hydrogel based on amidated pectin/oxidized chitosan as potential wound dressing for skin repairing-ScienceDirect[J]. Carbohyd Polym, 2020.
[28] MORSY R, HOSNY M, REICHA F, et al. Developing a potential antibacterial long-term degradable electrospun gelatin-based composites mats for wound dressing applications[J]. React Funct Polym, 2017, 114: 8-12.
[29] KESHK S, RAMADAN AM, AL-SEHEMI AG, et al. Peculiar behavior of starch 2, 3-dialdehyde towards sulfanilamide and sulfathiazole[J]. Carbohyd Polym, 2016, 152: 624-631.
[30] KESHK S, RAMADAN AM, AL-SEHEMI AG, et al.An unexpected reactivity during periodate oxidation of chitosan and the affinity of its 2, 3-di-aldehyde toward sulfa drugs[J]. Carbohyd Polym, 2017, 175: 565-574.
Preparation Process and Antibacterial Performance of Chitosan-kanamycin Graft
HE Junpeng1,2,3OUYANG Qianqian4,5WANG YiJin1,2,3SHENG Jun2,3TIAN Yang1,2,3GAO Bin1
(1. College of Food Science and Technology, Yunnan Agricultural University, Kunming, Yunnan 650201, China; 2. Development and Utilization of Food and Drug Homologous Resources Engineering Research Center of the Ministry of Education, Kunming, Yunnan 650201, China; 3. Yunnan Key Laboratory for Biological Big Data, Kunming, Yunnan 650201, China; 4. Marine Biomedical Research Institute, Guangdong Medical University, Zhanjiang, Guangdong 524023, China; 5. Guangdong Zhanjiang Institute of Marine Medicine, Zhanjiang, Guangdong 524023, China)
Chitosan is widely used in foods, but its antibacterial properties is weak. In order to improve the antibacterial properties of chitosan, kanamycin was grafted to prepare chitosan-kanamycin grafts to make it possible as an ideal antibacterial material applied to food. In this study, chitosan and kanamycin were used as the main raw materials, and the effects of reaction temperature, reaction time and sodium periodate dosage on the content of chitosan oxidized aldehyde groups were studied by single factor experiments. The best conditions for sugar oxidation was determined by response surface methodology ,then, the oxidized chitosan powder solution was mixed with the kanamycin solution and reacted in an oil bath at 60℃ for 6 h. The solution was dialyzed for two days and then freeze-dried to obtain a graft. The comparison on antibacterial performance of Chitosan and craft was carried out.The optimal conditions for chitosan to be oxidized were the reaction time, sodium periodate dosage and reaction temperature of 4 h, 4.8 g, and 40℃. Under these conditions, the aldehyde group content was calculated to be 4.89 mmol·g–1, and the relative deviation between the theoretical value of 4.07 mmol·g–1and the experimental value was 0.82%. The oxidized chitosan and kanamycin were subjected to Schiff base reaction, and the results were analyzed. It showed that kanamycin was successfully grafted. Elemental analysis calculated that the grafting rate of kanamycin in the graft was 52%. According to the antibacterial rate, the antibacterial performance of the graft was better than that of chitosan.
Chitosan; kanamycin; response surface methodology; structure characterization; antibacterial performance
TS201.21
A
10.12008/j.issn.1009-2196.2022.10.010
2022-02-11;
2022-03-14
云南省科技厅重大专项-重要药食兼用资源生物制造技术开发及应用(No.2018ZI001,No.202002AA100005);云南省重大科技专项-绿色食品国际合作研究中心项目(No.2019ZG00905);云南省中青年学术和技术带头人后备人才(No.2018HB040);辣木岗位科学家项目(No.CARS-11-YNSJ)。
何俊鹏(1996—),男,硕士研究生,研究方向为食品科学,E-mail:2311069588@qq.com。
高斌(1972—),博士,副教授,研究方向为食品营养与安全,E-mail:doc_gao@sina.com。
(责任编辑 林海妹)
