茜素红S 对鲈鲤幼鱼肌肉抗氧化指标的影响
2022-12-06白天泉姚俊杰毛茜王礼节罗永泉
白天泉,姚俊杰,毛茜,王礼节,罗永泉
(1.贵州大学渔业资源与环境研究中心,贵州 贵阳 550025;2.贵州省生态渔业有限责任公司,贵州 贵阳 550081)
鱼类标记技术是评估江、河、湖等水域开展人工增殖放流效果的重要手段之一,通过标记—回捕法可研究鱼类的生活史、生长发育以及渔业资源评估等。荧光标记法具有操作简单、节约成本、标记效果好、适用于大规模放流等特点[1]。在鳙Aristichthys nobilis、斑马鱼Danio rerio、鲢Hypophthalmichthys molitrix、大马哈鱼Oncorhynchus keta、滇池金线鲃Sinocyclocheilus grahami 等鱼类标记的应用中效果显著,浸泡后80~90 d 在普通显微镜下检测到标记色,且在其他不可见光下标记区能长久保持[2-7]。因此在增殖放流和渔业的相关研究中得到越来越多的支持和应用[8]。
在荧光标记的研究中,相对于其他荧光物质标记,茜素红S(ARS)标记大多应用在鱼类的早期发育中,且不同鱼类对化学染料的耐受阈值不同,在50~500 mg/L 浓度下标记效果良好[2,5,7,9]。ARS 属于外源物质,在外源物质的胁迫下可能会造成机体氧化损伤甚至死亡,影响鱼类生长发育、存活及生理响应等。目前的研究大多集中在标记效果和持久度[10-12],而ARS 标记对幼鱼抗氧化系统影响的相关报道仅见于中华倒刺鲃Spinibarbus sinens 的研究[13,14],对鲈鲤幼鱼抗氧化指标的影响研究未见报道。
鲈鲤Percocypris pingi 隶属于鲤形目Cypriniformes、鲤科Cyprinidae,在雅砻江下游野生鲈鲤群体呈现低龄化和小型化发展[15],被列为濒危鱼类[16,17]。本文通过研究不同浓度ARS 浸泡对鲈鲤幼鱼抗氧化酶超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)酶性和丙二醛(MDA)含量的影响,以期掌握荧光染色标记的适宜浓度,并为科学地开展鲈鲤幼鱼标记放流提供参考。
1 材料与方法
1.1 材料
鲈鲤幼鱼采集自贵州省毕节市鑫有农业综合开发有限责任公司双坪基地,置于50 cm×60 cm×100 cm 养殖箱中。驯养期间正常投喂饲料;驯养7 d后挑选体质健壮、活动力强、规格均匀的个体用于实验。实验所用试剂ARS(C14H7NaO7S)为分析纯(国药集团化学试剂有限公司),分子量342.26;SOD、CAT、CSH-Px 和MDA 测定试剂盒购于南京建成生物工程研究所有限公司。
将ARS 配成1 000 mg/L 的母液,用于后续实验。预实验和正式实验在19 cm×13 cm×9 cm 塑料箱中进行。预实验分为6 个组、正式实验分为7 个组,每个组设置3 个重复,实验用水为曝气24 h 后的自来水。实验期间,充氧机充分曝气,正常投喂饲料,早上、下午各投喂一次,每隔1 d 换一次水,每次换水量不超过整个养殖水体的2/3。测得pH(8.3±0.2),水体温度(14±0.5)℃,溶氧量(8.3±0.1)mg/L,氨氮<0.2 mg/L。在正式实验之前,饥饿24 h,随机取20 尾鲈鲤幼鱼测其体长(5.89±0.62)cm、体质量(1.48±0.39)g。
1.2 实验方法
预实验以0 mg/L 作为对照组,根据等对数间距系列设置浓度梯度为180 mg/L、240 mg/L、320 mg/L、420 mg/L、560 mg/L、750 mg/L 和1 000 mg/L。每个浓度组投放鲈鲤幼鱼20 尾,观察24 h,确定导致鲈鲤幼鱼100%死亡的ARS 最小浓度和不引起死亡的ARS 最大浓度。结果显示,1 000 mg/L 质量浓度组的鲈鲤幼鱼死亡率为100%,0 mg/L、180 mg/L、240 mg/L 质量浓度组的死亡率为0%,320 mg/L、420 mg/L、560 mg/L、750 mg/L 浓度组的死亡率分别为5%、15%、40%、70%,通过直线内插法计算出24 h半致死浓度(LC50)为623.335 mg/L。
在预实验的基础上,正式实验在0 mg/L 对照组和最大耐受浓度组之间按等差数列设置了7 个浓度组,分别为0 mg/L、40 mg/L、80 mg/L、120 mg/L、160 mg/L、200 mg/L、240 mg/L,同时浸泡24 h。每个浓度组设置3 个重复,每组投放20 尾鲈鲤幼鱼,共投放420 尾,浸泡24 h(0 d 暂养)后取一次,随后将剩下的鲈鲤幼鱼转入盛有清水的收纳箱中暂养,分别在暂养5 d 和10 d 后再取一次样。取样时在各浓度组中分别随机取出3 尾鲈鲤幼鱼,使用浓度为200 mg/L 的MS-222 麻醉后,迅速取出鲈鲤幼鱼肌肉放入10 mL 离心管中,置于-20℃冰箱保存,用于测定不同浓度ARS 组鲈鲤幼鱼肌肉中SOD、CAT、GSH-Px 活性和MDA 含量。鲈鲤幼鱼都于取样后投喂人工饲料,整个实验用时11 d,其余条件与驯养条件一致。
组织匀浆液制备及酶活性测定使用预冷的生理盐水漂洗鲈鲤幼鱼肌肉组织,再用滤纸吸掉肌肉表面的水分,称取适量的样品,按照质量∶体积=1∶9 加入4℃预冷的生理盐水,在冰浴条件下进行匀浆。匀浆液用冷冻离心机在4℃条件下2 000 r/min 下离心10 min,取上清液4℃保存待用。
样品总蛋白含量、SOD、CAT、GSH-Px、MDA 含量的测定按照试剂盒说明书操作。
1.3 数据分析处理
所测数据采用平均值±标准差(Mean±SD),通过SPSS 26 软件进行单因素方差分析(one-way ANOVA)和Duncan 多重比较(0.01<P<0.05 表示差异显著,P<0.01 表示差异极显著),采用GraPhPad Prism8 软件作图。
2 结果与分析
2.1 鲈鲤幼鱼肌肉SOD 酶活性变化
不同浓度ARS 溶液浸泡鲈鲤幼鱼肌肉SOD 活性变化见图1。由图1 可知:ARS 浸泡鲈鲤幼鱼24 h(暂养0 d),40 mg/L 浓度组肌肉SOD 活性(38.21±1.62)U 开始被诱导,但是,与对照组(36.66±1.65)U 差异不显著(P>0.05),从80 mg/L 浓度组(40.55±1.15)U 开始,SOD 活性显著升高(P<0.05),120~200 mg/L浓度组极显著升高至(43.44±1.12)U、(42.25±1.43)U、(46.22±1.91)U(P<0.01),200 mg/L浓度组的SOD 活性达到最大,而当ARS 浓度到达240 mg/L(32.87±0.94)U 时受到抑制,SOD 活性急速下降,显著低于对照组水平(P<0.05);在ARS 浸泡后第5 d,40 mg/L、160 mg/L 与对照组(35.57±1.24)U 差异不显著(P>0.05),除了在80 mg/L 浓度组被显著诱导上升(38.98±1.61)U(P<0.05)外,160~240 mg/L 浓度组被显著抑制(P<0.05)。浸泡标记后第10 d,除了160 mg/L(37.97±1.11)U 和200 mg/L(33.16±0.68)U 浓度组,分别被显著诱导和抑制外(P<0.05),其他浓度组已恢复至对照组(35.82±1.02)水平(P>0.05)。

图1 不同浓度ARS 溶液浸泡鲈鲤幼鱼肌肉SOD 活性变化Fig.1 Changes in SOD activity in the muscles of Percocypris pingi juveniles soaked in ARS solution at different concentrations
2.2 鲈鲤幼鱼肌肉CAT 酶活性变化
不同浓度ARS 溶液浸泡鲈鲤幼鱼肌肉中CAT活性变化见图2。由图2 可知:ARS 浸泡鲈鲤幼鱼24 h 后(0 d)肌肉CAT 活性与SOD 活性变化一致,随浓度梯度升高呈先上升后下降,在160~200 mg/L ARS 处理后CAT 活性相比对照组(14.52±0.62)U呈极显著上升(P<0.01),其他浓度组与对照组无显著差异(P>0.05);ARS 浸泡后第5 d,40 mg/L 浓度组CAT 活性显著低于对照组(14.37±1.75)U(P<0.05),随之逐渐上升,到120 mg/L 浓度组(21.81±0.81)U 时达到最大值(P<0.01),160~240 mg/L 浓度组时急剧下降,显著低于对照组(P<0.05);暂养10 d后,低浓度组基本恢复到正常水平,与对照组(15.33±1.90)U 差异不显著(P>0.05),而高浓度组中CAT 活性在160 mg/L(20.03±1.18)U 显著升高(P<0.05),随着ARS 浓度的不断加大,到200 mg/L(9.35±0.96)U(P<0.01)和240 mg/L(10.42±1.04)U(P<0.05)浓度组CAT 酶活性被抑制,显著低于对照水平。
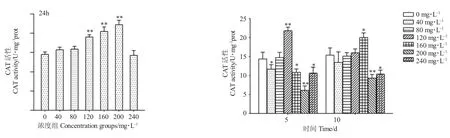
图2 不同浓度ARS 溶液浸泡鲈鲤幼鱼肌肉CAT 活性变化Fig.2 Changes in CAT activity in the muscles of Percocypris pingi juveniles soaked in ARS solution at different concentrations
2.3 鲈鲤幼鱼肌肉GSH-Px 酶活性变化
不同浓度ARS 溶液浸泡鲈鲤幼鱼肌肉中GSH-Px 活性变化见图3。由图3 可知:各浓度组ARS 浸泡鲈鲤幼鱼24 h(暂养0 d)后,肌肉中GSH-Px 活性呈波浪式变化,整体呈现诱导作用,GSH-Px 活性高于对照组(42.23±1.47)U,40 mg/L、120 mg/L、200 mg/L 浓度组(P<0.01)极显著上升,80 mg/L、160 mg/L、240 mg/L浓度组显著升高(P<0.05);暂养5 d 后,80 mg/L 浓度组显著升高于对照组(39.21±1.28)U(P<0.05),160~240 mg/L 浓度组极显著低于对照水平;经过10 d 的暂养后,40~120 mg/L 浓度组恢复到对照组水平(35.28±0.89)U(P>0.05),160~240 mg/L 浓度组GSH-Px 活性持续被消耗,极显著低于对照水平(P<0.01),表现抑制作用。

图3 不同浓度ARS 溶液浸泡鲈鲤幼鱼肌肉GSH-Px 活性变化Fig.3 Changes in GSH-Px activity in the muscles of Percocypris pingi juveniles soaked in ARS solution at different concentrations
2.4 鲈鲤幼鱼肌肉MDA 含量变化
不同浓度ARS 溶液浸泡鲈鲤幼鱼MDA 含量变化见图4。由图4 可知:浸泡24 h(0 d)后,鲈鲤幼鱼肌肉MDA 含量呈先降低后上升的趋势,40~120 mg/L 浓度组显著低于对照组(1.36±0.13)nmol/mg(P<0.05),之后持续升高,从160~240 mg/L 浓度组显著高于对照组(P<0.05)。值得注意的是,当ARS浓度加到200 mg/L 后MDA 活性达最大值[(2.02±0.12)nmol/mg](P<0.01);ARS 浸泡后第5 d,120~240 mg/L 浓度组MDA 含量急剧下降,显著低于对照组[(0.79±0.11)nmol/mg](P<0.05),而40 mg/L 和80 mg/L 浓度组已恢复到正常水平(P>0.05);ARS 浸泡后的第10 d,除了160 mg/L 浓度组和200 mg/L 浓度组显著高于对照组之外(0.64±0.10)nmol/mg(P<0.05),其余浓度组MDA 含量虽然有波动,但是均与对照组无显著差异(P>0.05)。

图4 不同浓度ARS 溶液浸泡鲈鲤幼鱼肌肉MDA 含量变化Fig.4 Changes in MDA content in the muscles of Percocypris pingi juveniles soaked in ARS solution at different concentrations
3 讨论
3.1 茜素红S 对鲈鲤幼鱼肌肉抗氧化酶活性的影响
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)是鱼体内重要的抗氧化指标[18,19],三者共同协作,联合清除鱼体内的氧自由基(ROS)[20],降低氧化应激损伤。一般认为,SOD是抵御氧自由基的第一道防线,最先与氧自由基作用。它的主要功能是清除鱼体内的超氧阴离子(O2-·),分解成分子氧和过氧化氢(H2O2),H2O2在CAT 和GSH-Px 的作用下分解成H2O 和O2,因此这些酶能够清除氧自由基,保护细胞不受氧自由基损伤[21,22]。
ARS 浸泡鲈鲤幼鱼24 h(ARS 浸泡后0 d),引起机体应激反应,产生过量ROS,鲈鲤的代谢随浓度的增加逐步加强,本研究中SOD 和CAT 酶活性变化具有相关性,都表现出抛物线型剂量效应,即低浓度促进高浓度抑制。在低浓度组时,SOD 升高,分解过多的O2-·产生大量的H2O2,刺激CAT 活性也相应的升高,加速分解H2O2,此时SOD、CAT 活性被诱导升高,但是在200 mg/L 浓度组时,超过它们的调节阈值,体内大量的氧自由基积累,发生氧化损伤,随后SOD 和CAT 活性开始下降,CAT 活性显著低于对照组,表明此时鲈鲤肌肉受到了毒性影响,大量的自由基抑制了SOD 和CAT 的合成或被消耗。这与尖紫蛤Sanguinolaria acuta、斑马鱼、中华倒刺鲃的研究一致[14,23,24],且都出现了“剂量效应”,ARS 浸泡后第5 d,低浓度组SOD、CAT 和GSH-Px活性开始恢复,第10 d 时低浓度组恢复到正常水平,但是160~240 mg/L 浓度组酶活性依旧低于对照水平,说明SOD 与CAT 持续被消耗,体内仍旧存在ROS,经过10 d 暂养也没能恢复到正常水平。
GSH-Px 和CAT 是分解H2O2的重要酶。GSH-Px 可被H2O2氧化生成H2O,将还原性谷胱甘肽(GSH)变成氧化型谷胱甘肽(GSSG)。值得注意的是,在遇到外源物质刺激胁迫时鲈鲤幼鱼GSH-Px首先响应,这与郭鹤等[3]的研究不同,不同鱼类的不同器官中抗氧化酶活性调节阈值不同,其原因可能是鲈鲤肌肉中GSH-Px 与CAT 和SOD 的响应模式不同,整个过程处于动态平衡的状态。这也可能是与CAT 存在竞争,肌肉中不同抗氧化酶作用的阶段不同,此过程需要进一步研究。
3.2 茜素红S 对鲈鲤幼鱼肌肉MDA 的影响
MDA 是活性氧自由基攻击生物膜发生脂质过氧化的产物[25],也可以与蛋白质的游离氨基酸作用,引起蛋白质分子内和分子间交联,导致细胞损伤[26]。MDA 的含量可以用来衡量氧化损伤的程度[27]。
霍来江[13]使用ARS 浸泡中华倒刺鲃24 h 后,脑中MDA 含量随浓度梯度先减少后上升。潘建雄使用茜素络合物浸泡鳙48 h 后第15 d,肌肉中MDA 含量随浓度梯度先降低后升高,且都低于对照组[6],在段必成[4]的研究中也有类似“低抑高促”的现象,这与本研究结果一致。ARS 浸泡24 h 后,鲈鲤肌肉中MDA 含量呈先下降低于对照水平后逐渐上升。在小于200 mg/L 浓度组中虽然MDA 含量在不断升高,损伤程度也在不断加深,但是,SOD、CAT、GSH-Px 的活力总体也同时呈上升趋势,说明抗氧化酶活性足够弥补ARS 胁迫下产生的氧化损伤。这与镉对尖紫蛤抗氧化酶活性及脂质过氧化的研究结果一致[23]。与低盐度胁迫对鲻Mugil cephalus 幼鱼肌肉MDA 含量的研究也一致[28]。在200 mg/L 浓度组达到最大值,说明鲈鲤肌肉抗氧化调节系统达到阈值,已造成毒害作用。
小于120 mg/L 组ARS 浸泡后5~10 d,MDA 基本恢复,但是,在第5 d 160~240 mg/L 浓度组MDA含量仍显著低于对照水平,同时SOD、CAT 和GSH-Px 活性也被抑制低于对照组,说明高浓度组中产生的抗氧化酶持续被消耗,在不断地修复机体所受到的氧化损伤。到第10d 时,160mg/L和240mg/L浓度组MDA 含量高于对照组,同时,SOD、CAT、GSH-Px 活性受到不同程度的抑制并且低于对照水平,是因为高浓度ARS 胁迫下,鲈鲤幼鱼肌肉产生的氧自由基超过了抗氧化系统的调节的范围,显著抑制了CAT 和GSH-Px 等抗氧化酶活性,说明暂养10 d 后高浓度组ARS 对鲈鲤肌肉造成不可逆的损伤。
3.3 茜素红S 浸泡鲈鲤幼鱼的合理浓度
本实验结果表明,浸泡后第10 d,40~120 mg/L浓度组SOD、CAT、GSH-Px 酶活力基本能恢复到正常水平,160 mg/L 浓度组时CAT、GSH-Px 活力和MDA 含量出现转折,前者开始下降,后者上升。根据抗氧化酶耐受最低阈值原则以及丙二醛含量变化情况,40~160 mg/L 间的ARS 对鲈鲤幼鱼抗氧化指标的影响较小。结合赵亚鹏等[7]的研究,使用ARS对滇池金线鲃浸泡24 h 时150 mg/L 的ARS 溶液荧光标记效果良好。因此,4.27~6.51 cm 规格的鲈鲤幼鱼推荐使用100~150 mg/L浓度的ARS进行标记。
