生物炭及其碳骨架对微生物去除水中低浓度硝酸盐的影响
2022-12-06常智淋王朝旭李红艳崔建国
常智淋,王朝旭,2①,张 峰,2,李红艳,2,崔建国,2
(1.太原理工大学环境科学与工程学院,山西 晋中 030600;2.山西省市政工程研究生教育创新中心,山西 晋中 030600)
随着城市化进程的加快以及人民生活水平的提高,污水量不断增加,水体污染日益严重。日益突出的水环境问题,使得污水处理的排放标准越来越高。然而,目前普遍推行的GB 18918—2002《城镇污水处理厂污染物排放标准》中的一级A标准规定,出水总氮(TN)质量浓度不高于15 mg·L-1,但其仍远高于GB 3838—2002《地表水环境质量标准》中V类水质标准(TN质量浓度不高于2.0 mg·L-1)。因此,对于受纳水体来说,城镇污水处理厂尾水仍可能是潜在污染源[1]。NO3--N是城镇污水处理厂尾水中氮素的主要形式,其质量浓度约为10 mg·L-1。同时,NO3--N的富集也是造成水体富营养化的主要原因之一,且NO3--N是反硝化作用的底物,易引起氧化亚氮(N2O)排放,而N2O的全球增温潜势是CO2的298倍[2],对全球变暖有重要影响。因此,采取措施进一步降低污水处理厂尾水中NO3--N浓度,具有重大现实意义。
生物炭是一种含碳量丰富、孔隙多、比表面积大、结构稳定且难以被微生物降解的物质[3],近年来引起广泛关注。生物炭具有电化学活性[4],其电化学活性主要来源于两个部分:一是生物炭表面存在的氧化还原活性官能团(如醌、酚等结构)[5];二是由π电子离域和类石墨片状结构引起的电导[6]。生物炭包含可溶和不可溶组分[7]。在自然界中,生物炭可溶组分会溶出,剩下的不可溶组分表面含氧官能团也会发生变化。研究表明,生物炭氧化还原活性官能团以溶解性有机碳(可溶组分)形式存在[8],而电导结构存在于碳骨架(不可溶组分)中[9]。与生物炭氧化还原活性不同,生物炭电导结构能够直接将电子从电子供体传递到电子受体,而不需要暂时储存电子[5],此电子传递过程并不发生化学反应,因此,其电子传递速度较快[10]。
反硝化过程表现为在缺氧条件下,作为电子受体的NO3-在硝酸盐还原酶(NAR)作用下被还原为NO2-,然后,依次在亚硝酸盐还原酶(NIR)、一氧化氮还原酶以及氧化亚氮还原酶作用下,最终还原为N2O和N2。因此,生物炭作为一种电化学活性物质,其在反硝化过程中必定起着重要作用,施用生物炭可能是减少N2O排放的一种潜在方法[11]。CHEN等[8]研究发现,低温(300 ℃)条件下制得的生物炭上酚类结构可以作为电子供体,促进反硝化过程中N2O还原;高温(800 ℃)条件下制得的生物炭上醌类结构可以作为电子受体,抑制反硝化速率和N2O排放;同时,高温条件下制得的生物炭上电导结构也可以促进反硝化过程中N2O还原。生物炭可以促进微生物之间的胞外电子传递,称之为直接种间电子传递[12]。LIU等[13]研究发现,在以乙醇为电子供体、以富马酸盐为电子受体的培养基中,生物炭可以加速电子从金属还原地杆菌属(Geobactermetallireducens)向硫还原地杆菌属(Geobactersulfurreducens)转移,从而促进细菌生长,此过程中生物炭的电导结构促进了微生物种间电子传递。类似地,CAYUELA等[14]研究发现,生物炭的电导结构增加了反硝化微生物与生物炭表面离域π-电子体系之间相互作用的可能性,从而促进电子传递。
虽然生物炭对反硝化作用的电子传递过程有显著影响,但是生物炭中可溶组分(浸提液)与不可溶组分(碳骨架)对反硝化作用和N2O排放的相对贡献如何,尚不清楚。因此,笔者以稻壳生物炭为例,首先通过水洗法制备碳骨架(不可溶组分)和浸提液(可溶组分),并富集筛选厌氧反硝化细菌,然后开展在生物炭、碳骨架或浸提液存在条件下,反硝化细菌去除模拟废水中低浓度(约10 mg·L-1)硝酸盐的室内培养试验,探究稻壳生物炭、碳骨架和浸提液对反硝化过程及N2O排放的影响,并揭示碳骨架(电导结构)在反硝化过程中的作用。
1 材料与方法
1.1 稻壳生物炭可溶和不可溶组分的分离与表征
供试生物炭为稻壳生物炭(BC),使用前过1 mm孔径筛。将生物炭和超纯水按质量(g)体积(mL)比1∶50比例混合,振荡24 h(170 r·min-1、25 ℃)后过0.45 μm孔径滤膜,收集滤液,冷冻条件(-18 ℃)下保存,此为生物炭可溶组分,称为浸提液(BCE)。收集滤膜上的生物炭,将其悬浮于超纯水中,振荡6 h(170 r·min-1、25 ℃),过滤,重复这一过程,直至滤液电导率(EC)小于50 μS·cm-1,然后收集生物炭,烘至恒重(60 ℃),此为生物炭不可溶组分,称为碳骨架(WBC)。BC、WBC和BCE理化性质测定方法同文献[15],含氧官能团类型采用傅里叶变换红外光谱仪(SpectrumTwo,美国)测定。
1.2 反硝化细菌的培养和鉴定
1.2.1反硝化细菌的富集分离
以山西省太原市某污水处理厂A2/O工艺回流池的活性污泥为菌种来源。将2 mL活性污泥上清液接种至200 mL反硝化液体培养基〔组成及质量浓度(g·L-1):柠檬酸钠5.0,KNO32.0,K2HPO41.0,KH2PO41.0,MgSO40.2;微量元素溶液[16]2 mL;pH 7.0~7.5〕进行富集培养(170 r·min-1、30 ℃)。3 d后以体积分数φ=1%的接种量将培养基上清液接种至新鲜的反硝化液体培养基中,重复富集3次。富集后采用平板涂布法分离并初筛厌氧反硝化细菌[17]。所有培养基在配制过程中,首先通入高纯氮气(φ=99.999%)驱氧30 min,同时向培养基中加入还原剂L-半胱氨酸(0.5 g·L-1),利用其还原性去除氧,使培养基处于无氧状态,然后灭菌20 min备用(121 ℃)[18]。
1.2.2细菌反硝化能力鉴定
从溴百里酚蓝初筛培养基表面挑取呈蓝色的单菌落[17],接种至150 mL模拟废水〔组成及质量浓度(g·L-1):柠檬酸钠0.18,KNO30.07(NO3--N质量浓度为10 mg·L-1),其余同反硝化液体培养基〕,连续培养72 h(170 r·min-1、30 ℃),分别于培养0、4、8、12、24、36、48、60和72 h时采样,测定其NO3--N、NO2--N、NH4+-N和TN浓度。选取NO3--N和TN浓度明显降低的菌落作为后续试验所用厌氧反硝化细菌(DB)。将该菌落接种至反硝化液体培养基培养72 h(170 r·min-1、30 ℃)后,4 ℃条件下保存备用。
1.2.3细菌分子生物学鉴定
将含有DB的反硝化液体培养基离心(转速为10 000 r·min-1,离心半径为9.83 cm,5 min)收集菌体后,用干冰包装送至生工生物工程(上海)股份有限公司,进行微生物16S扩增子高通量测序。利用引物341F:CCTACGGGNGGCWGCAG和805R:GACTACHVGGGTATCTAATCC对细菌16S的V3~V4区进行扩增,PCR扩增中高保真反应体系选用Yeasen的2×Hieff® Robust PCR Master Mix。PCR产物采用Illumina MiSeqTM/HiseqTM测序系统上机分析,在97%置信度下将样品所有16S rRNA基因序列进行分类,获得门水平下的分类。另外,采用PICRUSt软件将所筛选菌落的16S rRNA基因序列与代谢功能已知的微生物参考基因组KEGG功能谱数据库进行对比,预测菌落的代谢功能。
1.3 室内培养试验
通过利用反硝化细菌去除模拟废水中低浓度硝酸盐的室内培养试验,探究稻壳生物炭、碳骨架和浸提液对反硝化过程及N2O排放的影响,揭示碳骨架(电导结构)在反硝化过程中的作用。试验采用随机区组设计,共设5个处理:(1)模拟废水+生物炭(BC);(2)模拟废水+种子液(DB);(3)模拟废水+种子液+生物炭(DB+BC);(4)模拟废水+种子液+碳骨架(DB+WBC);(5)模拟废水+种子液+浸提液(DB+BCE)。
移取5 mL预先保存的含所筛选菌落DB的反硝化液体培养基接种于1 L LB液体培养基[19]中,培养至吸光度D600=1.0(170 r·min-1、30 ℃),离心(转速为10 000 r·min-1,离心半径为9.83 cm,5 min)收集菌体后,用无菌水洗涤两次,最后重悬浮于100 mL无菌水中,此为种子液。首先将5 mL种子液添加至装有100 mL模拟废水的培养瓶(300 mL)中(对于BC处理,用等体积的无菌水代替种子液;对于DB+BCE处理,培养瓶中模拟废水体积为50 mL),混匀后将1 g BC或WBC加入培养瓶;对于DB+BCE处理,将50 mL BCE加入培养瓶。除DB+BCE处理培养体系NO3--N质量浓度为4.76 mg·L-1外,其他处理均为9.52 mg·L-1。充分混匀后,用连接有两个三通阀的瓶盖密封培养瓶口。为了在培养过程中保持无氧状态,培养瓶顶部空间用高纯氮气(φ=99.999%)充分置换。所有培养瓶置于摇床(170 r·min-1、30 ℃)中避光连续培养60 h。
每个处理设置9个培养瓶,将9个培养瓶平均分成3组。第1组培养瓶用于测定N2O排放速率;向第2组培养瓶顶部空间加入乙炔(φ=20%),且压力保持在1.013×105Pa,用于抑制反硝化过程中N2O 向N2的转化,通过测定N2O排放量,识别N2O+N2排放量。第3组培养瓶用于测定培养体系的理化性质(pH值、EC、NO3--N、NO2--N、NH4+-N和TN)及酶活性(NAR和NIR)。
分别于培养4、8、12、24、36、48和60 h时测定第1组培养瓶中N2O排放速率。在每个采样时间点,首先用注射器通过三通阀向瓶中注入20 mL高纯氮气,推拉5次使瓶内气体充分混匀,然后采集20 mL气体样品,立即注入装有电子捕获检测器的气相色谱仪,测定N2O浓度。气体样品采集后,用高纯氮气吹扫培养瓶顶部空间,以彻底清除前一培养周期产生的N2O,然后开始进入下一培养周期。第2组培养瓶在进入下一培养周期之前加入乙炔。
气相色谱仪载气为高纯氮气(输出压力为0.4 MPa),补充气为φ=10%的CO2(输出压力为0.1 MPa)。色谱柱、进样器和检测器温度分别为50、50和300 ℃。N2O排放速率和累积排放量均以100 mL培养液为计量单位进行计算,其计算公式为
(1)
Q=∑Ri×t。
(2)
式(1)~(2)中,Ri为ih时N2O排放速率(以N计),ng·h-1;Ci为ih时采集的气体样品N2O浓度,ng·L-1;V为培养瓶顶部空间体积,mL;20为从培养瓶顶部空间采集的气体样品体积,mL;28/44为N2O中N的质量分数;t为采样时间点的间隔,h;Q为60 h的N2O累积排放量(以N计),ng。
第3组培养瓶的培养方式与第1、2组相同。分别于培养0、1、2、4、8、12、24、36、48和60 h时,在培养体系混匀状态下采样10 mL,过0.45 μm孔径滤膜,测定pH值、EC以及NO3--N、NO2--N、NH4+-N和TN浓度。另外,分别于培养24和48 h时采集培养混合液测定NAR和NIR活性。NAR和NIR活性测定采用ZHENG等[20]的方法,分别用反应体系中NO2--N增加和减少的量计算NAR和NIR活性(μmol·mL-1·h-1)。
1.4 数据分析
采用Microsoft Excel 2016处理数据,数据形式为平均值±标准偏差(n=3)。采用Origin 2017软件绘图。采用SPSS Statistics 25软件进行统计分析,采用单因素方差分析差异显著性,显著性水平设为α=0.05。
2 结果与分析
2.1 菌落对NO3-的降解动力学及群落组成
图1a显示,所筛选菌落(DB)能较好地降解NO3--N,0~24 h内NO3--N浓度降低缓慢,平均降解速率为0.04 mgL-1h-1;24~48 h内NO3--N浓度大幅降低,由9.18降至2.00 mgL-1,平均降解速率为0.30 mgL-1h-1;虽然48~72 h内NO3--N浓度不再降低,但NO2--N浓度急剧下降(由峰值7.86降至0.07 mg·L-1),同时TN浓度也随之迅速降低(由11.36降至4.93 mg·L-1),表明模拟废水中氮元素在该时段内经反硝化作用转化为气态氮逸出培养体系。
PICRUSt功能预测分析表明,菌落DB能将NO3-还原为NO2-、NO、N2O和N2。该菌落的分类系统组成树状图见图1b,在门水平上,菌落DB包含92.74%的变形菌门(Proteobacteria)和7.26%的厚壁菌门(Firmicutes)。
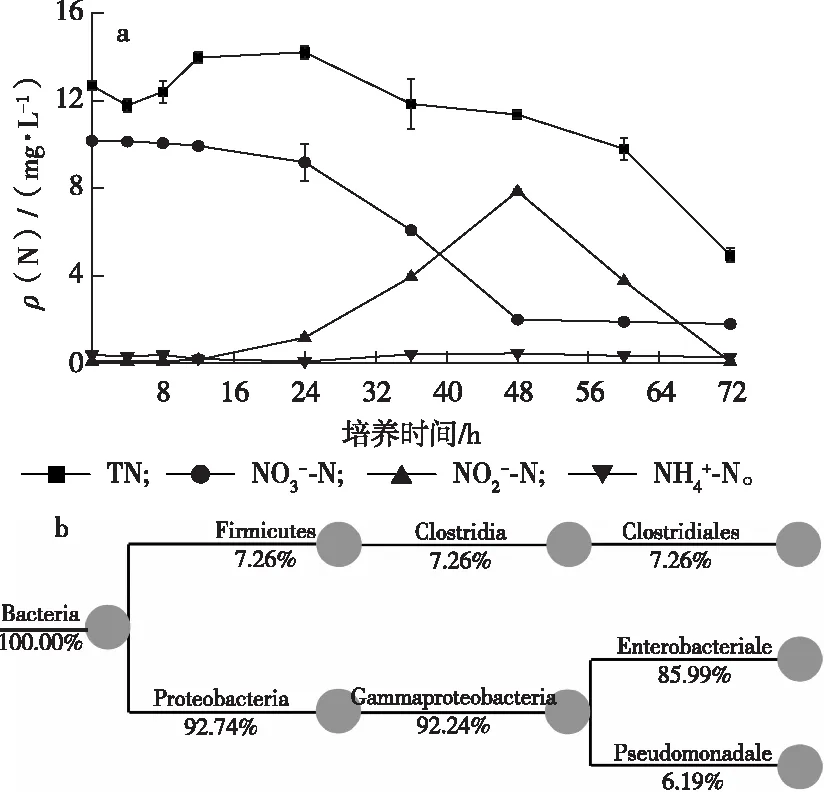
b分图中从左至右依次为分类层级,支点附近为该分类名称及其对应的丰度值。
2.2 生物炭(BC)、碳骨架(WBC)和浸提液(BCE)的理化性质
与BC相比,WBC和BCE的pH值显著降低;WBC的EC也显著降低,但BCE的EC未显著降低(P<0.05)。与BC相比,WBC的溶解性有机碳(DOC)和NO3--N含量分别显著降低81.23%和43.98%(P<0.05),而NO2--N和NH4+-N含量则分别增加16.00%和78.41%(表1)。
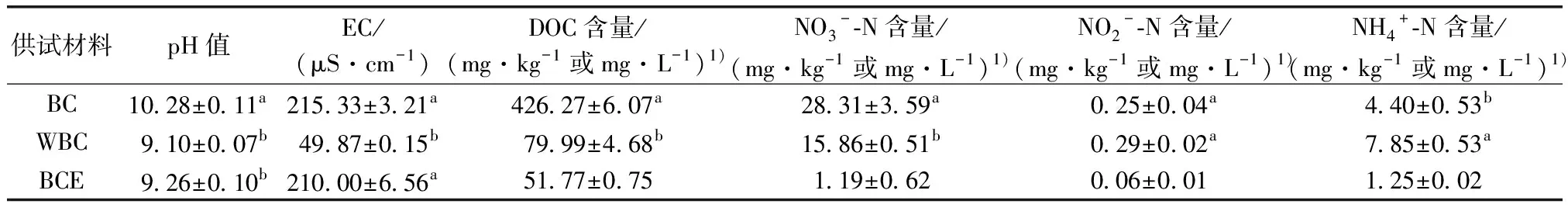
表1 生物炭、碳骨架和浸提液的理化性质

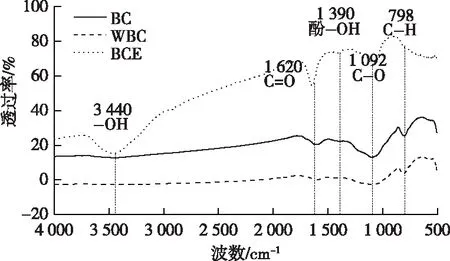
BC、WBC和BCE分别为生物炭、碳骨架和浸提液。
2.3 反硝化过程中N2O和N2的排放特征
BC处理N2O和N2O+N2累积排放量均为零(图3未展示),表明模拟废水的N2O排放完全通过微生物途径产生。各处理N2O和N2O+N2排放速率达峰值的时间不同,但达峰值后均逐渐降低。DB处理N2O和N2O+N2排放速率在48 h时达峰值,DB+BC和DB+BCE处理在36 h时达峰值,而DB+WBC处理在24 h时达峰值。DB、DB+BC、DB+WBC和DB+BCE处理N2O排放速率峰值(以N计)分别为3 320.21、356.23、533.01和516.18 ng·h-1,N2O+N2排放速率峰值分别为38 097.45、44 087.79、46 826.27 和26 323.76 ng·h-1(图3)。DB、DB+BC、DB+WBC和DB+BCE处理60 h的N2O累积排放量(以N计)分别为41 859.33±5 224.13、7 098.70±286.14、10 667.38±912.18和8 518.02±1 675.34 ng,N2O+N2累积排放量(以N计)分别为759 247.19±108 480.93、988 337.23±8 159.49、780 946.49±28 128.30和470 809.83±7 129.47 ng。
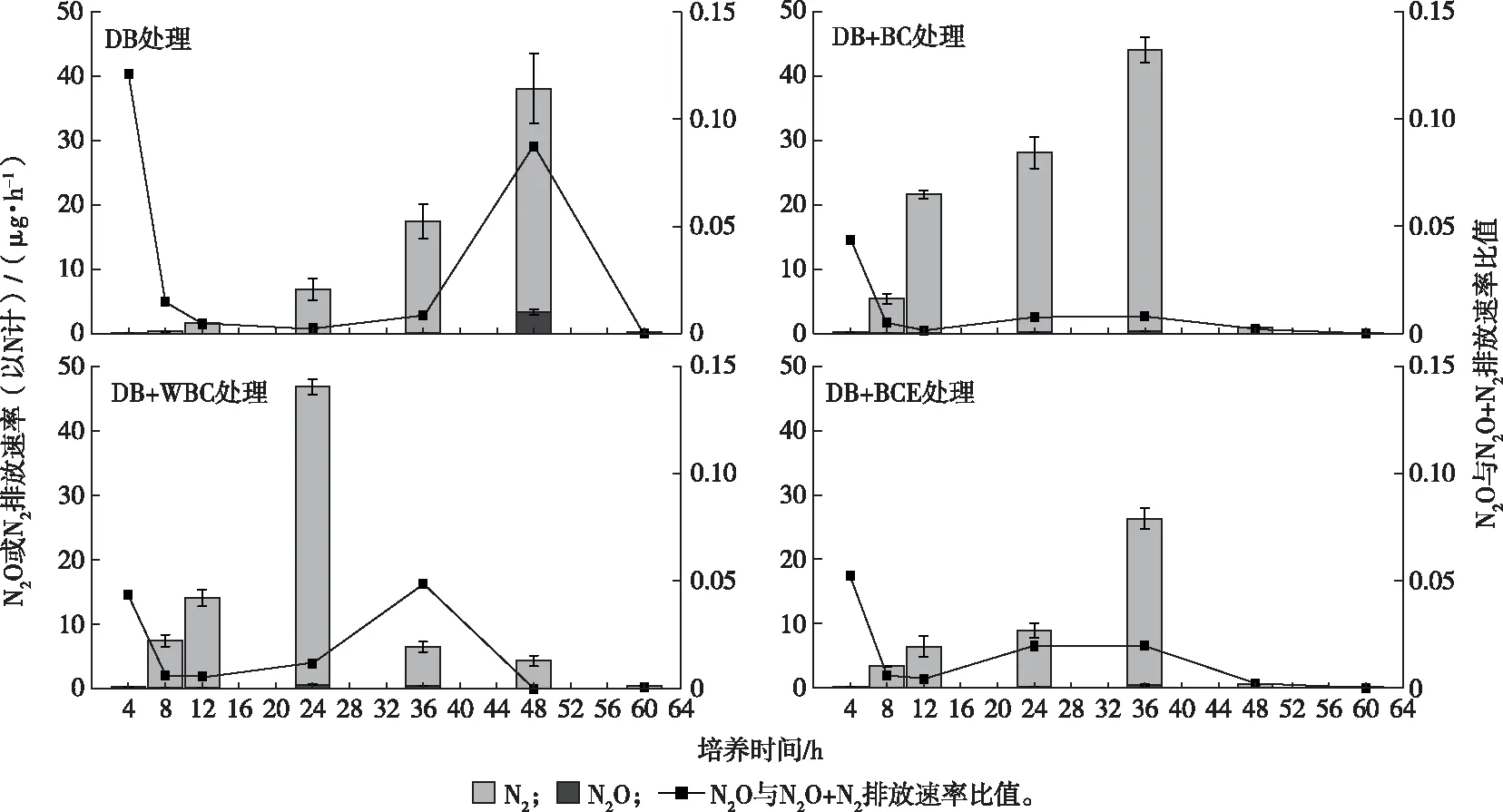
DB处理为模拟废水+种子液;DB+BC处理为模拟废水+种子液+生物炭;DB+WBC处理为模拟废水+种子液+碳骨架;DB+BCE处理为模拟废水+种子液+浸提液。
相对累积排放量结果(图4)表明,与DB处理相比,DB+BC和DB+WBC处理N2O+N2累积排放量分别增加30.17%和2.86%,N2O累积排放量分别减少83.04%和74.52%。另外,由累积排放量计算得出,DB、DB+BC、DB+WBC和DB+BCE处理N2O/(N2O+N2)比值分别为0.055、0.007、0.014和0.018,表明添加生物炭、碳骨架和浸提液均促进N2O 向N2还原,减少了N2O排放,其中,以DB+BC处理为最显著。与DB+BC处理相比,DB+WBC处理N2O+N2累积排放量减少20.98%,而N2O累积排放量显著增加50.27%,表明碳骨架的反硝化促进作用不及生物炭,但碳骨架的电导结构在反硝化过程中仍起主要作用。
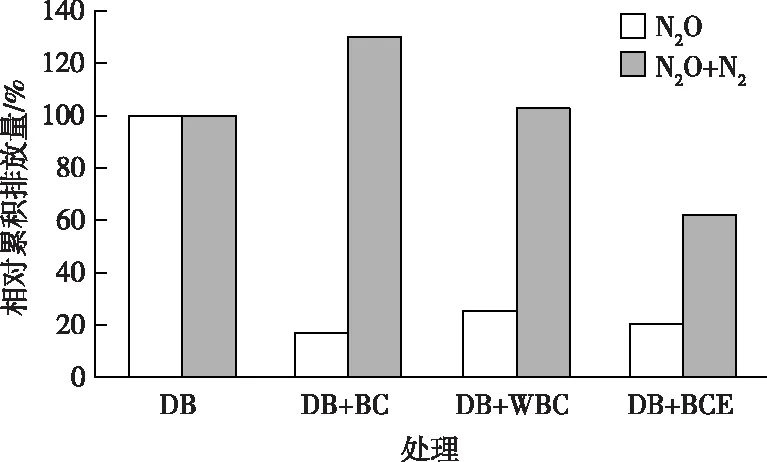
DB、DB+BC、DB+WBC和DB+BCE处理含义见图3。
2.4 培养体系理化指标和酶活性动态变化
2.4.1pH值和EC
BC处理在培养前期(0~12 h)pH值上升,后期(12~60 h)pH值趋于稳定。而DB、DB+BC、DB+WBC和DB+BCE处理pH值在培养后期均不同程度增加,表明发生了不同程度的反硝化作用。培养结束时,DB、DB+BC、DB+WBC和DB+BCE处理pH值分别升高0.24、0.29、0.25和0.20。与DB处理相比,DB+BC、DB+WBC和DB+BCE处理均提高了培养体系的pH值,培养结束时,pH值分别增加0.12、0.02和0.12,不同处理培养过程中pH值总体表现为DB+BC>DB+BCE>DB+WBC>DB(图5)。
经过60 h培养,BC、DB、DB+BC、DB+WBC和DB+BCE处理EC分别增加0.33、0.41、0.53、0.33和0.34 mS·cm-1。培养结束时,与DB处理相比,DB+BC处理EC提高6.74%,而DB+WBC和DB+BCE处理EC则分别降低6.17%和43.00%(图5)。
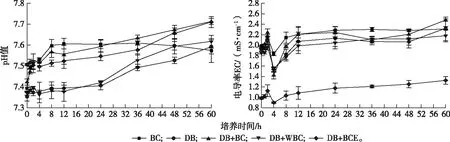
BC处理为模拟废水+生物炭;DB处理为模拟废水+种子液;DB+BC处理为模拟废水+种子液+生物炭;DB+WBC处理为模拟废水+种子液+碳骨架;DB+BCE处理为模拟废水+种子液+浸提液。
2.4.2无机氮
在整个培养过程中,除BC处理外,各处理NO3--N含量均随培养时间的推移而逐渐降低,说明发生了不同程度的反硝化作用,而BC处理NO3--N含量始终保持稳定,表明各处理NO3-还原主要通过生物学过程。培养结束时,DB、DB+BC、DB+WBC和DB+BCE处理NO3--N含量分别比初始值降低98.89%、94.46%、92.58%和97.08%。NO3-还原主要发生在培养前24 h内,该时段DB、DB+BC、DB+WBC和DB+BCE处理NO3--N含量分别降低88.17%、79.73%、84.33%和82.15%(图6)。
在整个培养过程中,除BC处理外,各处理NO2--N含量总体呈先上升后下降趋势,且均在反硝化速率(N2O+N2排放速率)达到峰值时,接近于零。与NO3--N、NO2--N和TN含量相比,各处理NH4+-N含量始终处于较低水平,且0~60 h内无大幅波动,主要是因为培养体系处于厌氧状态,无硝化作用发生。因此,培养体系产生的N2O均由反硝化作用过程产生。培养结束时,DB、DB+BC、DB+WBC和 DB+BCE处理TN含量分别比初始值降低78.57%、74.79%、76.77%和89.66%。TN含量降低主要发生在培养12~48 h内(图6)。
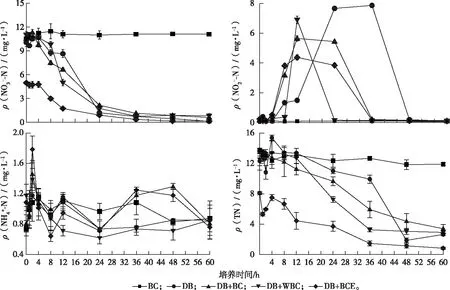
BC、DB、DB+BC、DB+WBC和DB+BCE处理含义见图5。
2.4.3NAR和NIR活性
与培养24 h时相比,培养48 h时DB、DB+BC、DB+WBC和DB+BCE处理NAR活性分别增加31.25%、8.67%、4.63%和47.98%。在培养24和48 h时,DB、DB+BC和DB+WBC处理NAR活性之间均无显著差异,但DB+BCE处理NAR活性显著高于DB处理(P<0.05)。与24 h时相比,48 h时DB、DB+BC、DB+WBC和DB+BCE处理NIR活性分别提高32.99%、122.05%、33.03%和30.45%。培养24和48 h时,各处理NIR活性之间均无显著差异(P>0.05)(图7)。
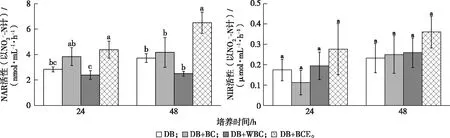
DB、DB+BC、DB+WBC和DB+BCE处理含义见图5。直方柱上方英文小写字母不同表示24或48 h时4个处理间NAR或NIR活性差异显著(P<0.05)。
3 讨论
3.1 生物炭及其碳骨架对反硝化速率和N2O还原的作用
除生物学过程外,非生物学过程对N2O排放也有一定贡献[21]。研究表明,在土壤中存在化学反硝化作用(一种无机氮被还原为气态氮的非生物学过程)[22]。BC处理(未添加菌落DB)N2O累积排放量为零,且NO3-含量在培养过程中并未降低;然而,DB处理能产生N2O,表明笔者研究中不存在化学反硝化作用。
DB处理反硝化速率(N2O+N2排放速率)峰值(以N计)在48 h时出现,而DB+BC处理反硝化速率峰值在36 h时出现,DB+WBC处理反硝化速率峰值甚至在24 h时出现,且DB+BC和DB+WBC处理峰值(分别为44 087.79和46 826.27 ng·h-1)均高于DB处理(38 097.45 ng·h-1),表明生物炭及其碳骨架均使培养体系的反硝化速率加快。另一方面,与DB处理相比,添加生物炭和碳骨架分别使培养体系N2O/(N2O+N2)比值降低87.27%和74.55%,表明生物炭及其碳骨架均促进N2O向N2还原。主要原因有:(1)生物炭提高了培养体系电子传递速率,增强了反硝化作用,并促进N2O向N2还原[4,23]。SU等[24]研究也发现,施用生物炭后,土壤反硝化速率提高13%~26%,N2O累积排放量降低442%~809%,其原因为生物炭使土壤微生物电子传递速率提高39.6%~56.2%。(2)生物炭使培养体系pH值升高,进而提高N2O还原酶活性,促进N2O还原,导致较低的N2O/(N2O+N2)比值[25]。培养结束时,与DB相比,DB+BC和DB+WBC处理pH值分别增加0.12和0.02;在整个培养过程中,不同处理pH值总体呈DB+BC>DB+WBC>DB的趋势。笔者研究结果与AAMER等[26]研究结果一致,其发现与对照处理相比,2%生物炭添加量使土壤N2O累积排放量降低70.16%,主要原因为生物炭使土壤pH值升高0.63,较高的pH值有利于提高土壤nosZ和nirK基因丰度,进而促进N2O还原为N2[27]。王鸿浩等[28]研究也发现,玉米秸秆生物炭的添加使培养结束时土壤pH值平均升高0.5,显著提高nosZ基因丰度,降低(nirK+nirS)/nosZ比值,促进反硝化过程中N2O还原,从而降低N2O排放。
3.2 生物炭及其碳骨架的反硝化促进作用对比
与DB+BC处理相比,虽然DB+WBC处理反硝化速率峰值提前12 h出现,但是,在整个培养过程(60 h)中,与DB+BC处理相比,DB+WBC处理N2O+N2累积排放量减少20.98%,且N2O累积排放量增加50.27%;这是因为反硝化过程伴随C源消耗[6]。笔者研究中,WBC处理DOC含量较低,因此与DB+BC处理相比,DB+WBC处理微生物可利用的C源较少,在一定程度上抑制了反硝化酶活性,导致NO3-和N2O的还原程度均较低。笔者研究发现,培养24 h时,DB+WBC处理NAR活性显著低于DB+BC处理(P<0.05)(图7)。相反,充足的DOC可使nosZ基因丰度和N2排放量增高,有利于完全反硝化[29]。
生物炭经水浸提后,虽然许多含氧官能团随浸提液被剥离,但同时也使生物炭上原本被覆盖的活性位点得以暴露[30],生物炭电导结构得以加强[12]。笔者研究发现,稻壳生物炭主要通过其碳骨架(电导结构)进行电子传递,促进N2O还原。类似地,张月[30]以含矿物质丰富的猪粪、污泥生物炭为研究对象,分离生物炭的可溶与不可溶组分,发现不可溶组分主导生物炭得失电子的能力。有机物H和C原子数比(H∶Corg)是表征生物炭芳香缩合程度的指标,该比值越低,芳香缩合程度就越高。高温生物炭具有较低的H∶Corg,而碳骨架(电导结构)也具备该特征。CAYUELA等[14]通过元分析发现,H∶Corg小于0.3的生物炭能促使反硝化过程彻底进行,减少(73±7)%的N2O排放,而该比值大于0.5的生物炭仅能减少(40±16)%的N2O排放。WELDON等[31]和WAQAS等[32]研究均表明,碳化程度较高(H∶Corg较低或芳香缩合程度较高)的生物炭更有利于完全反硝化,促进N2O还原。因此,与浸提液相比,芳香缩合程度较高的碳骨架可能具有较强的N2O还原促进作用。
4 结论
笔者研究中模拟废水的N2O排放完全通过微生物途径产生。生物炭及其碳骨架均提高反硝化速率,并促进N2O还原。碳骨架的反硝化促进作用不及生物炭。生物炭的含氧官能团主要存在于浸提液中,但是碳骨架的电导结构在反硝化过程中起主要作用。
