活性维生素D3对糖尿病肾病大鼠血脂代谢、肾脏形态、TGF-β1蛋白及mRNA表达的影响
2022-12-06苏亚李小凤李辉张哲
苏亚 李小凤 李辉 张哲
(陕西省人民医院,陕西 西安 710068)
糖尿病肾病(DN)是一种慢性微血管并发症,其在2型糖尿病(DM)中最为常见,DN是导致终末期肾病的主要因素〔1〕。DN发生时会发生一些列病理改变,如肾小管间质发生纤维化、肾小球系膜区无细胞性增宽、肾小球基底弥漫性增厚等〔2〕。研究发现,随着人们饮食摄入的糖量过高而导致DN的发病率逐年上涨,并且对患者的生活质量造成严重威胁。目前有研究提示,维生素D的缺乏是DN发生发展的危险因素,补充维生素D及其类似物能通过多种途径发挥肾脏保护作用〔3〕。活性维生素D3有相对广泛的生物学作用,如对钙磷代谢及细胞的生物学活性均能进行可有效地进行调节,因此在临床上活性维生素D3对肾脏的保护作用也受到了广泛的关注〔4〕。有研究发现,血清中1,25-二羟维生素D3的水平介导着炎症相关疾病的发生发展,还可对肾脏进行有效的保护,可见增加1,25-二羟维生素D3水平可有效抑制炎症疾病中炎症因子表达,进而改善DN的发生发展〔5〕,但活性维生素D3具体的作用机制尚不明确。转化生长因子(TGF)-β1在机体中以3种异构体构成,即TGF-β1、TGF-β2、TGF-β3,在机体的肾小球和肾小管上皮细胞中分布较为广泛。有学者在DN动物体和患者的血浆、肾组织和尿液中均检测到了TGF-β1的存在,且发生了异常的高表达〔6,7〕。研究显示,TGF-β1可通过对细胞的生物活性进行调节,同时刺激细胞的合成整合素,让细胞之间及细胞与细胞外基质之间的相互作用得到促进,进而影响DN的发生发展〔8〕。但目前活性维生素D3对TGF-β1的调控还没有明确的报道,本文探讨活性维生素D3对DN大鼠血脂代谢、肾脏组织及TGF-β1蛋白及mRNA表达的影响。
1 材料与方法
1.1实验动物 选用健康雄性SD大鼠,均由昆明医科大学实验动物中心提供,共65只。大鼠体重为225~275 g,大鼠禁食,自由饮水,适应1 w新的环境。
1.2试剂和仪器 试剂和仪器分别为上海罗氏制药公司生产的活性维生素D3,美国Sigma公司生产的链脲佐菌素(STZ);Santa Cruz公司生产的兔抗大鼠TGF-β1多克隆抗体;北京博奥森公司生产的全自动生化仪;北京全式金生物有限公司生产的Trizol和实时定量(RT)-聚合酶链反应(PCR)试剂盒;北京中杉金桥生物工程有限公司生产的免疫荧光试剂盒;淮北正华生物仪器有限公司生产的大鼠代谢笼;大连竞迈生物公司生产的凝胶成像分析仪。
1.3实验分组与模型建立 实验前所有大鼠禁食12 h,随机取出45只大鼠一次性腹部注射STZ溶液,每千克大鼠注射60 mg,其中STZ溶液是由pH值为4.5的柠檬酸盐缓冲液配制而成,其中柠檬酸盐含量为0.1 mol/L。72 h后采取大鼠的尾静脉血液,测量空腹血糖。DN模型制备成功标准:大鼠血糖值≥16.7 mmol/L,本实验共41只大鼠制备DN模型成功。将41只大鼠随机分为DN组(20只),活性维生素D3(VDR)组(21只)。将剩下的20只大鼠设为正常对照(NC)组。造模成功后,将活性维生素D3溶于0.5 ml的花生油,VDR组每天每只大鼠0.03 μg灌胃干预;用等量的花生油灌胃NC组和DN组大鼠。所有大鼠自由饮食摄水,实施光照12 h一循环,共干预8 w。
1.4收集标本 收集各组大鼠处死前1 d的24 h尿液,用代谢笼收集并记录24 h总尿量。实验干预8 w后处死各组大鼠,处死大鼠前称重并记录体重。麻醉所有大鼠后,剖胸将心脏暴露在外,收集2 ml左心室血液用于生化测定。取出肾组织,部分用于免疫组化和苏木素-伊红(HE)染色;部分用于RT-PCR实验。
1.5体重、血糖、肾指数检测 分别测量3组给药干预后4、8 w的体重和血糖值。取大鼠双侧肾脏,称量肾重量,计算大鼠肾脏指数。
1.6生化指标检测 采用全自动的生化分析仪检测24 h尿蛋白定量、尿素氮(BUN)、血肌酐(SCr)和肌酐清除率(CCr)。
1.7血脂指标检测 分别抽取3组大鼠空腹12 h静脉血,检测三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)。
1.8肾脏组织形态学观察 分别将实验大鼠处死,具体操作如下:取出大鼠的肾皮质,用甲醛将肾皮质固定1 d,切片,厚度为3 μm,将组织进行HE染色后进行观察。
1.9Western印迹检测肾组织中TGF-β1 蛋白的表达 分别取3组大鼠50 mg肾组织,用Western印迹裂解液裂解,用玻璃均浆器在冰上对组织进行研磨,30 min后以每分钟12 000 r的速度离心5 min,取上清液,蛋白浓度用二喹啉甲酸(BCA)法进行检测,在每孔中加入50 μg的蛋白样品,根据蛋白浓度计算样本体积。把浓缩的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)缓冲液加入到上清液中,加热上清液,5 min后在预制的胶孔中吧蛋白样本加入,在封闭的环境中孵育。1 h后加入一抗,TBST溶液将蛋白样品清洗3次,凝胶成像系统曝光成像,进一步分析。
1.10实时定量PCR检测肾组织中TGF-β1 mRNA表达 分别取3组大鼠50 mg肾组织,用Trizol裂解液将组织裂解,而后提取组织中总的RNA。引物序列为:TGF-β1 mRNA正向引物:5′-AGAAGTCACCCGCGTGCTAT-3′,反向:5′-CACTGCTTCCCGAATGTCTGA-3′;β-actin mRNA正向引物:5′-AGTACCCCATTGAACACGGC-3′,反向:5′-CACTGCTTCCCGAATGTCTGA-3′。扩增条件:95℃预变性2 min;95℃预变性15 s;60℃退火1 min,共计40个循环。AT1R、Smad3 mRNA相对表达量用2-△△Ct法进行计算。
1.11统计学分析 采用SPSS19.0软件进行单因素方差分析、t检验。
2 结 果
2.13组体重、血糖、肾指数比较 与NC组体重相比,DN组在给药后4 w和8 w均显著降低(P<0.05);干预后VDR组体重较DN组明显回升(P<0.05)。与NC组肾指数和血糖相比,DN组给药4 w和8 w均明显升高(P<0.05);与DN组相比,VDR组肾指数和血糖均显著降低(P<0.05),见表1。
表1 3组体重、肾指数和血糖水平比较
2.23组生化指标检测 与NC组比较,DN组BUN、SCr、CCr和24 h尿蛋白水平均显著升高(P<0.05);经过治疗的VDR组生化指标均显著低于DN组(均P<0.05),见表2。
2.33组血脂指标比较 与NC组相比,DN组血脂指标TC、TG和LDL-C均显著升高,HDL-C指标显著降低(P<0.05);干预后VDR组血脂指标相比DN组明显改善(P<0.05),见表2。
表2 3组给药8 w后BUN、SCr、CCr、24 h尿蛋白及血脂指标TC、TG、LDL-C和HDL-C比较
2.43组肾脏组织形态比较 和NC组相比较,DN组肾小球体积明显增大,肾系膜区细胞的数量较NC组也显著增多,间质间大量炎细胞浸润,且肾小管严重肿胀,肾小管的排列也没有规则;干预治疗后VDR组肾组织形态较DN组明显改善,见图1。
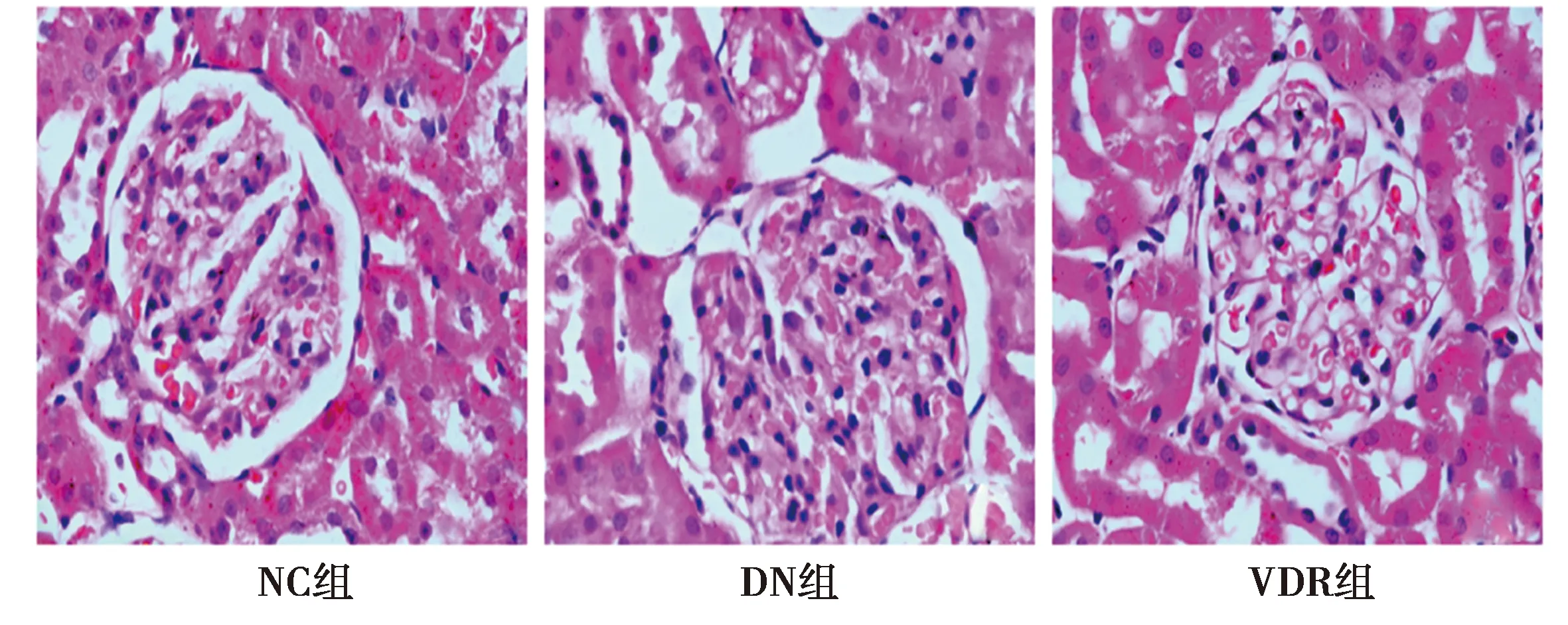
图1 3组肾组织形态(HE染色,×400)
2.53组肾组织中TGF-β1蛋白表达比较 和NC组(1.05±0.07)相比,DN组肾组织中TGF-β1蛋白表达(1.58±0.13)明显升高(P<0.05);干预后VDR组肾组织中TGF-β1蛋白表达(1.24±0.11)明显低于DN组(均P<0.05),见图2。

图2 3组TGF-β1蛋白表达
2.63组肾组织中TGF-β1 mRNA表达比较 与NC组(0.21±0.01)相比,DN组肾组织中TGF-β1 mRNA表达(0.63±0.07)显著升高(P<0.05);与DN组相比,VDR组肾组织中TGF-β1 mRNA表达(0.37±0.04)明显降低(P<0.05)。
3 讨 论
目前,我国糖尿病患者已成为世界上最多的国家。医疗技术水平随着社会的发展而不断地提升,人均寿命也明显得到了延长,2型DM患者的患病率也随之增长。当机体内糖代谢发生异常而导致DM的发生,累及到肾脏时会导致DN的发生;DN患者肾功能一旦发生异常,其病情较肾功能正常患者明显严重,且患者的预后情况也明显变差〔1,2〕。目前临床上治疗DN的手段非常有限,因此有效的治疗方法就显得尤为重要。临床研究表明,活性维生素D3对钙磷代谢有一定的调节作用,还可调节细胞的生物学活性,介导免疫疾病,有效的保护肾脏〔9〕,但具体的作用机制尚不明确。目前有研究证实了TGF-β1可通过抑制细胞的恶性生物学活性,诱导细胞外基质表达等途径,进而改变DN的发生发展〔10〕。但活性维生素D3对TGF-β1的调控作用还有待探究。
有研究表明,血脂异常是导致DN患者病情加重的重要原因之一,还有一些学者提出,脂代谢异常是DN代谢紊乱的根源〔11〕。因此对于DN患者除了注意控制血压和血糖外,也应该严格控制血脂的含量。本研究结果提示,活性维生素D3能对肝细胞表面的LDL的受体数目进行调节,增加受体使得LDL的运转增加,降低血中LDL水平。维生素D是一种脂溶性的类固醇衍生物,来源于动物性食物中所含的胆骨化醇(维生素D3)、植物性食物中所含有的麦角骨化醇(维生素D2)及皮肤中的7-脱氢胆固醇经太阳紫外线β射线照射迅速转化而得到的维生素D3〔12〕。维生素D3本身没有生物活性,必须经肝脏25-羟化酶系的催化下生成25(OH)D3,再在肾脏1α-羟化酶系的催化下进一步羟化成1,25(OH)D3,这是维生素D3起生理作用的基本形式〔13〕。有研究发现维生素D的缺乏可增加DN的患病风险,而补充维生素D制剂可降低DN患病风险〔14〕。本研究结果说明,活性维生素D3能改善DN大鼠肾组织的病理改变,高晶〔15〕研究发现,VDR基因敲除的DN大鼠比超重的DN大鼠有更为严重的蛋白尿,同时在电子显微镜下观察到肾小球基底膜增厚和足细胞丢失,多伴有肾小球硬化。
维生素D3对系膜增生性肾炎模型大鼠肾组织中TGF-β1的表达及Ⅰ型、Ⅳ型胶原和α平滑激动蛋白的表达进行有效的抑制,进而机制系膜细胞的增殖和肾小球的硬化〔16,17〕。本研究结果表明,活性维生素D3可通过下调TGF-β1表达在DN发生发展中发挥保护作用。杨瑞凤等〔18〕研究发现,维生素D3可抑制维生素D受体敲除DM模型大鼠RAS系统及系膜细胞、近球细胞中TGF-β1的表达,进而减少尿蛋白,抑制肾小球肥大及肾小球硬化。
综上,活性维生素D3可改善DN大鼠血脂代谢和肾组织形态,对肾组织中TGF-β1 mRNA的表达进行抑制,从而发挥对DN肾组织的保护作用。
