红外频谱照射和超低频电磁场处理水对高脂饮食诱致大鼠非酒精性脂肪肝的保护作用
2022-12-06熊爱华齐春丽王欣吕俊华
熊爱华 齐春丽 王欣 吕俊华
(暨南大学 1药学院药理教研室,广东 广州 510632;2实验动物管理中心; 3广东骏丰频谱股份有限公司)
非酒精性脂肪肝(NAFLD)是以肝细胞内脂肪过度沉积为主要特征的临床病理综合征〔1〕。胰岛素抵抗和遗传易感性与其发生密切相关,属于获得性代谢应激性肝损伤疾病。NAFLD的发展过程可由单纯性脂肪变性、肝炎、肝纤维化发展为肝硬化(ALC)及肝癌(HCC)〔2,3〕。NAFLD全球发病率约为25%,其中约有1/3发展为肝炎,约20%进展为肝纤维化、肝硬化等终末期肝病。因此,单纯改善肝脂肪病变是达不到理想的防治作用,寻找既能改善肝细胞炎症、脂肪变,又能延缓炎症进展及纤维化的干预手段,才能达到理想的临床预后效果〔4,5〕。红外线又称红外辐射,属于波长在0.75~1 000.00 μm范围的一段电磁波,具有改善血液循环、消炎和镇痛作用〔6〕。超低频电磁场处理水(简称频谱水)是将普通饮用水经超低频电磁场处理后,使其物理化学特性发生改变的一种特殊处理水〔7〕。频谱水具有抗氧化、调节免疫功能、抗炎及改善胰岛素抵抗作用〔8~11〕。本研究探讨远红外线照射和频谱水对NAFLD动物模型的防治保健作用及其可能的机制。
1 材料与方法
1.1仪器与试剂 JF-802频谱治疗仪(广东骏丰频谱股份有限公司,红外频谱的波长范围为3~25 μm);JF-118频谱水治疗仪(广东骏丰频谱股份有限公司);GH3000隔水培养箱(天津市泰斯特仪器有限公司);MF41制冰机(意大利Scotsman公司);Synergy HT多功能酶标仪(美国BioTek公司);QL-901匀浆机(海门市其林贝尔仪器制造有限公司);荧光显微镜(日本奥林巴斯公司),石蜡包埋机(中国湖北欧美莱医疗科技有限责任公司),手动旋转式石蜡切片机(德国Slfe公司);5424R小型高速冷冻离心机(德国Eppendorf公司);MULTIFUGE X1R大型冷冻离心机(美国Thermo Fisher Scientific公司);BECMAN全自动生化分析仪(美国BECMAN公司);电子天平(沈阳龙腾电子称量仪器有限公司);电热恒温水浴锅(上海医疗器械五厂);Motic Images Plus2.0。
戊巴比妥钠(广州市医药公司化学试剂玻璃仪器批发部,批号:200010223);三酰甘油(TG,批号:3GJTJVF8NS)、总胆固醇(TC,批号:BK15CQH411)、肿瘤坏死因子(TNF-α,批号:WUPHCZZM6H)、白细胞介素(IL-10,批号:EMRSSBWWGZ)、IL-18(批号:5IAFZHU14R);超氧化物歧化酶(SOD,批号:VAB5ATD9TW)、丙二醛(MDA,批号:RPL3UN-9368)、晚期糖基化终末产物(AGEs,批号:IPLNZNM5SM)、瘦素(LEP,批号:5Y7U5T2IIQ),以上试剂盒均由武汉伊莱瑞特生物科技股份有限公司提供;低密度脂蛋白胆固醇(LDL-C,批号:I23036907)、高密度脂蛋白胆固醇(HDL-C,批号:G05036979)、丙氨酸氨基转移酶(ALT,批号:H30036981)、天门冬氨酸氨基转移酶(AST,批号:I10036980)等试剂盒由武汉华美生物工程有限公司提供;游离脂肪酸(FFA,批号:20190621)、谷胱甘肽过氧化物酶(GSH-Px,批号:20190619)、考马斯亮蓝G-250蛋白含量测定(批号:20190621)等试剂盒由南京建成生物科技有限公司提供。
1.2实验动物与饲料 SPF级SD大鼠48 只,雌雄各半,体重为(200±20)g,购自广东省医学实验动物中心,动物合格证号:SCXK(粤)2017-0174。实验动物饲养于暨南大学实验动物管理中心,实验室恒温22℃、相对湿度为50%~70%,明暗周期均为12 h。本实验经伦理委员会审查并批准,批准编号:IACUC-20190104-06。
普通饲料由暨南大学实验动物管理中心提供,高脂高胆固醇饲料由广东省医学实验动物中心提供。高脂高胆固醇饲料:蔗糖20%、猪油15%、胆固醇1.2%、胆酸钠0.2%、酪氨酸10%、磷酸氢钙0.6%、石粉0.4%、预混料0.4%、基础饲料52%。质量比:蛋白质19%,脂肪18%,碳水化合物50%。热量比:蛋白质17%,脂肪37%,碳水化合物46%。总能量4.4 kCal/g。
1.3频谱水的制备 将普通饮用水放入JF-118B频谱水治疗仪中进行处理,每次3 min,重复6 次而制成频谱水,现用现制。
1.4动物分组及给药方法 大鼠适应性喂养7 d,随机分为4组,即:正常组、模型组、红外频谱组、频谱水组,每组12 只。正常组食用普通饲料,其余各组参考文献〔12〕自由食用高脂饲料。正常组和模型组大鼠自由饮用普通水;频谱水组每天自由饮用频谱水,不饮普通水;红外频谱组每天上午、下午给予红外频谱照射(3档)45 min,自由饮用普通水。动物连续处理12 w后,随机取2 只模型组大鼠和2 只正常组大鼠,腹腔注射3%戊巴比妥钠30 mg/kg麻醉,剖开腹腔,分离出肝脏,肉眼观察并进行肝组织病理学检查,肝细胞出现脂肪病变,则提示造模成功。
1.5血清、肝脏标本的采集 大鼠处置前12 h禁食,不禁水,次晨再次给予相应的受试物40 min后,称取大鼠体重,腹腔注射3%戊巴比妥钠30 mg/kg麻醉,将其仰卧固定于手术台,腹主动脉取血,4~8℃冷藏静置2~3 h后,以离心力3 000 r/min离心15 min后分离血清,分装,-20℃保存待测。而后切取全部肝脏和脾脏,用冰冻生理盐水洗去血污,滤纸吸干,称重并记录。肉眼观察肝脏,若有异常,切取异常部位,若无,切取2 块基本相同部位的肝组织待做病理及生化测定。肝脏系数〔13〕(%)=肝重/大鼠体重×100%;脾脏系数(%)=脾重/大鼠体重×100%。
1.6血清生化测定 酶联免疫吸附试验(ELISA)测定TG、TC、LDL-C、HDL-C、ALT、AST、LEP、TNF-α、IL-10、IL-18的水平;比色法测定FFA的含量。
1.7肝组织生化测定 取出肝组织,用冰冻生理盐水洗去血污,滤纸吸干后,准确称取0.5 g肝组织,用冰生理盐水制成10%匀浆,以7 000 r/min冷冻离心,分离上清液,-20℃保存上清液待测,WST-1法测定SOD、TBA法测定MDA、酶促反应法测定GSH-Px、ELISA测定AGEs。
1.8肝组织病理 切取有病变的肝组织,若没有病变,切取基本相同部位的肝组织,用10%甲醛固定72 h后脱水、包埋、切片、制片,进行苏木素-伊红染色后,光学显微镜下观察肝组织病理学改变。每张肝组织切片光镜下观察5 个视野,进行肝脏脂肪变程度和肝脏病理变化程度〔12,13〕评分,肝脏病理变化程度评分标准,肝细胞结构:整齐0分、稍紊乱1分、紊乱2分;水肿无0分、轻度1分、严重2分;细胞核大而圆0分、大小不一1分、核偏移2分、核消失3分。肝素排列放射状0分、稍紊乱1分、紊乱2分;无肝内脂肪细胞0分、少见1分、弥漫性2分、融合3分;炎性细胞无0分、散在1分、较多2分、大量3分。肝细胞脂肪变程度评分:0分(<5%),1分(5%~33%),2分(34%~66%),3分(>66%)。
1.9统计学处理 采用SPSS17.0软件进行方差齐性检验、单因素方差分析、SNK-q检验、Games-Howell检验、χ2检验。
2 结 果
2.1各组体重比较 模型组第4、8、12周,体重明显高于正常组(P<0.05);红外频谱组和频谱水组与模型组比较体重无统计学差异(P>0.05)。见表1。
2.2各组肝脏系数和脾脏系数比较 模型组肝脏系数明显高于正常组(P<0.01),而脾脏系数与正常组比较无明显差异(P>0.05);红外频谱组和频谱水组肝脏系数与模型组比较无明显统计学差异(P>0.05)。见表1。

表1 各组体重、肝脏系数、脾脏系数比较
2.3各组血脂和瘦素比较 模型组血清TG、TC、LDL-C和FFA水平明显高于正常组(P<0.05),LEP水平高于正常组但未见统计学差异(P>0.05),HDL-C水平显著低于正常组(P<0.05);红外频谱组与模型组比较,TG、TC、FFA、LEP水平明显降低(P<0.05,P<0.01),LDL-C水平略有降低,HDL-C水平略有升高,但未见明显统计学差异(P>0.05);频谱水组与模型组比较,TG、TC、LDL-C、FFA水平明显降低(P<0.05,P<0.01),HDL-C水平明显升高(P<0.05),LEP水平无明显变化(P>0.05)。见表2。

表2 各组血脂、FFA、LEP水平比较
2.4各组肝功能比较 模型组AST和ALT水平明显高于正常组(P<0.05);红外频谱组、频谱水组AST和 ALT水平均明显低于模型组(P<0.05,P<0.01)。 见表3。

表3 各组肝功能比较
2.5各组血清炎性因子比较 模型组血清炎性因子中促炎因子TNF-α、IL-18明显高于正常组(P<0.01,P<0.05),抗炎因子IL-10水平明显低于正常组(P<0.05);红外频谱组和频谱水组与模型组比较,TNF-α水平无统计学意义(P>0.05),IL-18水平明显降低(P<0.01),IL-10水平明显升高(P<0.05,P<0.01)。见表4。
2.6各组肝组织抗氧化作用比较 模型组SOD和GSH-Px活力明显低于正常组(P<0.05,P<0.01),而MDA 和AGEs含量明显高于正常组(P<0.05);红外频谱组和频谱水组SOD和GSH-Px活力明显高于模型组(P<0.01,P<0.05),MDA和AGEs含量均明显低于模型组(P<0.01)。见表4。

表4 各组肝组织抗氧化作用及血清炎性因子水平比较
2.7红外频谱照射和频谱水对模型大鼠肝组织形态结构的影响
2.7.1光镜下肝组织形态结构的变化 正常组肝细胞结构整齐,细胞核大而圆。肝索呈放射状排列,肝细胞内未见脂肪细胞和炎性细胞。模型组肝细胞结构紊乱,细胞核大小不一,位置偏移或消失,肝索排列紊乱,肝细胞内见大量脂肪细胞,常见脂肪细胞融合或呈气球状,伴有大量的炎性细胞。红外频谱组和频谱水组肝细胞结构比较整齐,偶见紊乱,大部分细胞核大而圆,偶有细胞核大小不一,位置偏移或消失。肝索呈放射状排列,偶见紊乱。肝细胞内可见少量脂肪细胞,偶有脂肪细胞融合及少量散在的炎性细胞,其病理变化程度较模型组有所减轻。见图1。

图1 各组肝组织形态结构(HE染色)
2.7.2肝细胞病理变化评分 模型组肝脏病理变化和肝细胞脂肪变化评分均明显大于正常组(P<0.01);红外频谱组和频谱水组肝脏病理评分和肝细胞脂肪变化程度评分均明显低于模型组(P<0.01,P<0.05)。见表5。
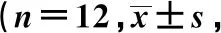
表5 各组肝细胞形态结构比较分)
3 讨 论
NAFLD病变的主体是肝小叶,病理上表现为大泡性脂肪变性,伴有小叶性炎症及肝纤维化形成,多伴有体重增加,血脂异常,血清转氨酶及TNF-α等促炎因子水平的升高〔14~16〕。本实验高脂饲料饲养12 w后,已经形成了大鼠脂肪肝病变及肝脏炎性病理变化。
频谱水是经超低频电磁场处理后的水,其主要特点是介电常数提高,水中水分子极化率高,水合后将使蛋白质和其他生物大分子的自由能降低,对蛋白质的稳定性、蛋白质的折叠和构象变化及酶的催化活性均起着重要作用〔7〕;频谱水穿透细胞膜的能力明显增加〔17〕,并具有抗氧化、调节免疫功能、抗炎及改善胰岛素抵抗作用〔8~11〕。红外频谱对人体皮肤及皮下组织有一定的穿透能力,红外频谱能量被组织吸收后主要引起分子动能增加,产生热效应,使血管扩张,血流加速,可以改善血液循环,消除炎性介质,促进渗出物吸收,达到消肿止痛的辅助治疗效果〔6〕。本实验结果可见,大鼠给予红外频谱照射或饮用频谱水处理12 w后,可明显改善大鼠血脂水平,并改善异常的肝脏功能。同时,肝脏病理学检查可见,红外频谱照射和频谱水处理可改善模型大鼠肝脏脂肪浸润和炎性病理损伤的程度,明显降低肝脏病理和肝细胞脂肪变化的程度。
NAFLD的病因较多,发病机制尚未完全明确,“多重打击”学说可以解释部分NAFLD的发病机制:第一次打击主要是肥胖、2型糖尿病、高脂血症等伴随的胰岛素抵抗,引起肝细胞内脂质过量沉积;第二次打击是脂质过量沉积的肝细胞发生氧化应激和脂质过氧化,导致线粒体功能障碍、炎症因子产生,肝星状细胞的激活,从而产生肝细胞的炎症、坏死〔18〕。氧化应激与脂质过氧化损伤在NAFLD的发生与发展中起着关键作用,糖基化终产物及其受体可激活氧化应激及炎症反应,产生级联反应〔19〕;IL-18与胰岛素抵抗的产生关系密切,同时又是介导肝脏损伤的重要诱导因子;IL-10是一种具有免疫调节作用的抗炎因子,在肝脏脂肪变性、胰岛素抵抗、炎症反应和肝纤维化等病理过程中发挥保护作用〔20,21〕。本次实验结果显示,红外频谱照射和饮用频谱水处理对NAFLD大鼠具有保肝作用,可能与其提高大鼠机体抗氧化能力,减少促炎因子生成和增加抗炎因子的生成有关。
综上所述,红外频谱照射和饮用频谱水处理,均可预防性降低NAFLD大鼠血脂水平,改善其肝脏功能,提高肝脏组织抗氧化能力,调节肝脏炎性因子水平,改善肝脏脂肪病变及炎性病变程度,对高脂饮食诱致的大鼠脂肪肝具有较好的保护作用。
