野蔷薇根总黄酮含药血清对ox-LDL诱导HUVEC凋亡的影响
2022-12-06杨丹王军李开言
杨丹 王军 李开言
(河南省中医药研究院,河南 郑州 450004)
血管内皮细胞(VEC)为裱衬于整个心血管系统内表面的单层扁平鳞状细胞,是形成心血管封闭系统的形态基础和血管通透性的主要屏障〔1〕。研究发现凋亡能够造成内皮细胞结构及功能受损,是血管内皮损伤的主要途径。细胞凋亡主要有胞外和胞内两种途径〔2〕,胞外途径即死亡受体介导途径;胞内途径包括内质网途径和线粒体途径细胞凋亡〔3〕。目前研究提示细胞内Ca2+超载、氧化自由基升高等均可通过刺激仅含BH3区域蛋白(BH3-only)蛋白或其他途径的蛋白将信号传导至线粒体激活胞内途径细胞凋亡。研究表明B淋巴细胞瘤(Bcl)-2调控基因家族可影响细胞凋亡过程的进行,相关活性物质的刺激造成的线粒体破坏,进一步激活程序化死亡蛋白,最终通过活化含半胱氨酸的天冬氨酸蛋白水解酶(Caspases)或以不依赖Caspases的方式导致细胞程序化死亡〔4,5〕。野蔷薇根系蔷薇科Rosaceae蔷薇属Rosa植物多花蔷薇的干燥根皮,苦、涩、寒、无毒。野蔷薇中富含黄酮类成分,其中根皮中含量最高(137.2 mg/g)〔6〕。前期临床研究表明野蔷薇根制剂能降低高脂血症患者血液中胆固醇、三酰甘油及β-脂蛋白含量,具有明显的降脂作用;动物实验发现野蔷薇根能降低实验性高脂血症大鼠胆固醇含量,减轻大鼠心肌缺血程度,预防和治疗大鼠实验性动脉粥样硬化〔7,8〕;细胞实验发现野蔷薇根总黄酮(TF-RM)对过氧化氢(H2O2)诱导损伤的HUVEC有保护作用〔9〕。本实验在前期研究基础上采用氧化低密度脂蛋白(ox-LDL)诱导损伤人脐静脉内皮细胞,通过检测细胞存活率、凋亡率及凋亡蛋白表达,研究TF-RM对血管内皮细胞保护作用机制,为进一步研究TF-RM治疗动脉粥样硬化(AS)提供理论基础。
1 材料与方法
1.1动物及细胞株 SPF级SD雄性大鼠,体质量(200±20)g,济南朋悦实验动物繁育有限公司,许可证编号:SCXK(鲁)20180007,动物编号:37009200005670。HUVEC细胞株,江苏恩莫阿赛生物技术有限公司。
1.2药物 野蔷薇根,安徽亳州药材市场,经河南省中医药研究院中药所马开副研究员鉴定为蔷薇科植物野蔷薇的干燥根。按照本课题组前期研究方法〔10〕提取纯化野蔷薇根总黄酮,所得TF-RM含量为54.209%。辛伐他汀片,浙江京新药业股份有限公司(国药准字H20000009,批号A1807203)。
1.3仪器及试剂 ELX800全功能酶标仪(美国Bio-Tek公司);HF160W CO2培养箱(上海力申科学仪器有限公司);CKX53倒置显微镜(日本OLYMPUS公司);2K15冷冻离心机(德国Sigma公司);IMS-40制冰机(常熟市雪科电器有限公司);磷酸盐缓冲液(PBS)、胰蛋白酶消化液、BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司,批号:13D17B21、T5016、20171228);澳洲新生胎牛血清(FBS,江苏恩莫阿赛生物技术有限公司,批号:S171204F);氧化低密度脂蛋白(广州奕源生物技术有限公司,批号:20190418);双色蛋白上样缓冲液4X(武汉博士德生物工程有限公司,批号:13C27C98);Bcl-2相关X蛋白(Bax)、Bcl-2、Caspase-3、Caspase-9、β-actin兔单克隆抗体、辣根过氧化物酶(HRP)标记山羊抗兔(武汉三鹰生物技术有限公司,批号:50599-2-1g、12789-1-AP、19677-1-AP、10380-1-AP、60008-1-1g、SA00001-2)。
1.4分组、给药及含药血清制备 SPF级SD雄性大鼠30只,随机分为3组,每组10只:空白组(去离子水)、辛伐他汀组(1.8 mg/kg)〔11〕、TF-RM组(2.5 g/kg),灌胃给药,给药体积为10 ml/kg,每天1次,连续7 d。第7天给药后1 h,麻醉大鼠,腹主动脉取血,静置2 h,3 000 r/min离心10 min分离血清,56℃水浴灭活30 min,0.22 μm微孔滤膜过滤除菌、分装后,-80℃冰箱中保存备用。
1.5HUVEC培养和分组 HUVEC细胞株,用含有10%胎牛血清和1%青链霉素的DMEM/F12培养基,在37℃、5% CO2及饱和湿度条件下培养,待细胞生长至融合度80%左右时进行实验。实验分组:空白组(体积分数为15%的空白血清),模型组(15%的空白血清+ox-LDL 160 μmol/L),辛伐他汀组(15%辛伐他汀血清+ox-LDL 160 μmol/L),TF-RM低剂量组(5%TF-RM血清+10%空白血清+ ox-LDL 160 μmol/L)、中剂量组(10%TF-RM血清+5%空白血清+ox-LDL 160 μmol/L)、高剂量组(15%TF-RM血清+ox-LDL 160 μmol/L)。
1.6不同浓度ox-LDL对HUVEC活力的影响 HUVEC细胞株,用含有10%胎牛血清和1%青链霉素的DMEM/F12培养基,在37℃、5% CO2及饱和湿度条件下培养,待细胞生长至融合度80%左右时,吸弃培养液,PBS冲洗一遍,分别加入ox-LDL浓度为0、120、140、160、180、200 μmol/L+15%胎牛血清的DMEM/F12培养基×5孔,每孔150 μl,培养箱中培养24 h。每孔加入0.5% MTT溶液20 μl,培养4 h后吸弃旧的培养液,加入二甲基亚砜(DMSO)150 μl,室温避光振荡10 min。570 nm波长下检测各孔OD值,计算细胞存活率。
1.7HUVEC存活率检测 HUVEC细胞株,用含有10%胎牛血清和1%青链霉素的DMEM/F12培养基,在37℃、5% CO2及饱和湿度条件下培养24 h,吸弃上清液,实验分组同1.5,每组5个复孔,每孔150 μl,置培养箱中培养24 h。加入0.5%MTT溶液20 μl,置培养箱中放置4 h,吸弃旧的培养液,加入DMSO 150 μl,室温避光振荡10 min,570 nm波长下检测各孔OD值。
1.8HUVEC凋亡率检测 HUVEC以1×105个/ml接种于6孔板,每孔2 ml,37℃、5% CO2培养24 h。吸弃上清液,实验分组同1.5,每孔2 ml,继续培养14 h。用不含乙二胺四乙酸(EDTA)的胰酶消化贴壁细胞,轻柔吹打成悬浮细胞,培养基中和并收集细胞,500~1 000 r/min离心5 min,弃去旧的培养基。3 ml预冷PBS洗涤细胞1次,500~1 000 r/min离心4 min,结合缓冲液(1×)2 ml洗细胞1次,离心收集细胞重悬于95 μl结合缓冲液(1×)中,加入5 μl 膜联蛋白(Annexin)V使细胞混悬液终体积为100 μl,避光、室温孵育10~15 min。结合缓冲液(1×)2 ml洗细胞,离心后重悬细胞于200 μl结合缓冲液(1×)。上机前5 min加入5 μl碘化丙啶(PI)染料,再加400 μl结合缓冲液(1×),过300目筛,1 h内用流式细胞仪检测细胞凋亡率。
1.9HUVEC中Bax、Bcl-2、Caspase-3、Caspase-9蛋白表达检测 组装玻璃板,加入分离胶5 ml,分离胶凝固后加入浓缩胶并插入梳子,待浓缩胶聚合完成后装进电泳槽,倒好电泳液拔梳子。按预定的顺序加入样品,电压设80 V,当染料前沿进入分离胶后,电压设120 V,直至溴酚蓝到达分离胶的底部。将胶、滤纸和聚偏氟乙烯(PVDF)膜平衡10 min后制作三明治并接通电源,4℃,150 mA转膜90 min。转膜结束后将膜放入封闭液中,4℃条件下孵育过夜。一抗37℃孵育2 h,三羟甲基氨基甲烷盐酸盐(TBST)洗膜5 min×6次,二抗37℃孵育30~60 min,洗膜5 min×6次,曝光并分析条带。
1.10统计学处理 采用SPSS21.0软件进行单因素方差分析、SNK-q检验、Games-Howell检验。
2 结 果
2.1不同浓度ox-LDL对HUVEC活力的影响 随着ox-LDL浓度升高,HUVEC活性逐渐降低。与0 μmol/L组比较,ox-LDL浓度在160 μmol/L时,HUVEC存活率为50%左右,因此选用160 μmol/L作为最佳损伤模型的ox-LDL浓度。见表1。

表1 不同浓度ox-LDL对HUVEC活力的影响
2.2TF-RM对ox-LDL损伤HUVEC存活率的影响 与空白组比较,模型组HUVEC存活率显著降低(P<0.01);与模型组比较,TF-RM低、中、高剂量组能显著提高HUVEC存活率(P<0.05,P<0.01)。见表2。
2.3TF-RM对ox-LDL损伤HUVEC凋亡率的影响 与空白组比较,模型组正常细胞比率显著减少(P<0.01),早期凋亡率显著增加(P<0.01),晚期细胞凋亡率及坏死率有增高趋势,但无统计学差异(P>0.05);与模型组比较,TF-RM高剂量组正常细胞比率显著增加(P<0.05),早期细胞凋亡率显著降低(P<0.05),晚期细胞凋亡率及坏死率有降低趋势,但无统计学差异(P>0.05)。TF-RM低、中剂量组正常细胞比率增加,早晚期细胞凋亡率、坏死率下降,但无统计学差异(P>0.05)。见表2、图1。
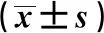
表2 TF-RM含药血清对ox-LDL损伤HUVEC存活率和凋亡率的影响
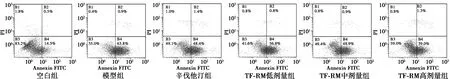
B1.坏死细胞;B2.晚期凋亡细胞;B3.正常细胞;B4.早期凋亡细胞
2.4TF-RM对ox-LDL损伤HUVEC中Bax、Bcl-2、Caspase-3、Caspase-9蛋白表达影响 与空白组比较,模型组HUVEC中Caspase-3、Caspase-9蛋白表达显著增加(P<0.01,P<0.05),Bcl-2蛋白表达显著降低(P<0.05),Bax表达有增加趋势,但无统计学差异(P>0.05);与模型组比较,TF-RM低、中、高剂量组Caspase-3蛋白表达显著降低(P<0.01),TF-RM中、高剂量组Bcl-2含量显著增加(P<0.05),TM-RM低、中、高剂量组Bax、Caspase-9蛋白表达有降低趋势,但无统计学差异(P>0.05)。见表3、图2。
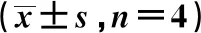
表3 TF-RM含药血清对ox-LDL损伤HUVEC中Bax、Bcl-2、Caspase-3、Caspase-9表达的影响

图2 TF-RM含药血清对ox-LDL损伤HUVEC中Bax、Bcl-2、Caspase-3、Caspase-9蛋白表达的影响
3 讨 论
随着对VEC生物功能的不断认识探究,发现内皮功能损伤是AS的始动环节。ox-LDL损伤内皮细胞,增加内皮细胞黏附,诱导炎症级联反应和细胞因子表达,进而促进泡沫细胞的形成。ox-LDL还能诱导内皮细胞发生凋亡,促进 AS形成及发展〔12〕。检测细胞凋亡率比较经典的是流式细胞术,Annexin V和PI染色法可检测出细胞不同时期的凋亡率,Annexin V可与早期凋亡的细胞膜相结合,通过异硫氰酸荧光素(FITC)标记。PI可透过凋亡中、晚期细胞和死亡细胞的细胞膜将细胞核染红,但不能通过完整的细胞膜,PI与Annexin V合用,可区分不同时期的细胞凋亡〔13〕。细胞凋亡是多种凋亡因素共同起作用的复杂过程。其中Bcl-2调控基因家族的Bcl-2和Bax及Caspase调控基因家族的Caspase-3和Caspase-9对细胞凋亡影响显著。研究发现,Bcl-2可通过阻止促凋亡基因信号传递或抑制诱导基因产物如细胞色素C的释放等发挥作用,同时其具有抗氧化剂作用通过抑制自由基而发挥抗凋亡作用。Bax则具有促进和诱导细胞凋亡的作用。Bcl-2族基因产物能激活Caspases,引发下游酶联反应,Caspases成员是细胞凋亡通路中关键环节和最主要执行者。Caspase-8、Caspase-9为起始凋亡蛋白酶,在细胞凋亡因素刺激下活化并激活下游底物;Caspase-3为效应凋亡蛋白,受到凋亡蛋白酶激活后,导致DNA损伤与细胞结构破坏,最终引起细胞死亡〔14〕。
近年来ox-LDL通过作用于内皮细胞影响AS的发生发展等方面的研究越来越受到重视,为寻求更多的治疗方法,中药在预防治疗心血管疾病中的作用越来越明显。野蔷薇在我国广泛种植,喜生于路旁、田边或丘陵地的灌木丛中,来源广泛。1974年初,河南省中医药研究院对野蔷薇根进行了原产地调查、生药学、化学成分分析、药理活性筛选及新药开发等系统研究。1976年初步发现野蔷薇根制剂具有明显的降脂作用。1978 ~1982年,与河南医学院、460医院、光山县人民医院、安阳市人民医院协作,进行野蔷薇根制剂降脂作用的临床观察,1980年改名为降脂灵,369例高脂血症患者临床试验结果表明:降脂灵为广谱降脂药,降胆固醇的有效率为85.90%,降三酰甘油有效率为78.88%,降β-脂蛋白的有效率为69.90%〔7〕。2016年通过高脂饮食联合注射维生素D3并加免疫损伤复制AS大鼠模型,灌胃给予野蔷薇根醇提物90 d,发现野蔷薇根醇提物对大鼠实验性AS具有预防和治疗作用〔8〕。本实验研究结果表明TF-RM含药血清能明显增加ox-LDL诱导损伤HUVEC的存活率,明显减少HUVEC早、晚期凋亡细胞数量,降低细胞坏死率,其机制与提高抑细胞凋亡蛋白Bcl-2表达、降低促细胞凋亡蛋白Bax、Caspase-3、Caspase-9表达有关。开展对野蔷薇的深入研究,尤其是野蔷薇根黄酮类成分在心脑血管方面的应用,有望将野蔷薇开发成为治疗心脑血管疾病的药物,为临床提供更多的治疗手段,同时也对扩大心血管疾病药源有可观的价值。
