MicroRNA-137增加肾细胞癌对顺铂的敏感性
2022-12-06艾民桑林王自立张洪侠刘宝新
艾民 桑林 王自立 张洪侠 刘宝新
(1长春大学特殊教育学院中医系,吉林 长春 130022;吉林大学 2中日联谊医院体检中心;3校医院康复科)
肾细胞癌(RCC)占肾癌病例的90%以上,是全世界最致命的泌尿系统恶性肿瘤之一〔1〕。尽管近年来肾细胞癌的治疗取得了进展,但由于肾癌转移和耐药性,肾细胞癌患者的总体生存率仍然不令人满意〔2〕。顺铂(CDDP)是一种铂类抗癌药物,已广泛用于各种癌症类型,包括RCC〔3〕;然而,其严重的副作用和产生的耐药性往往限制了其在RCC中的临床应用。据报道,微小RNA(miRNAs)细胞的凋亡、增殖、分化、代谢等多种过程中发挥着关键作用〔4,5〕。众所周知,miRNAs可以通过不完全结合靶基因mRNA的3′-非翻译区(UTR)来调节基因表达,从而导致翻译抑制和(或)靶基因降解〔6〕。越来越多的证据表明,miRNAs参与RCC在内的多种肿瘤的发生和发展,并作为肿瘤抑制因子或癌基因发挥作用〔7,8〕。通过miRNAs介导的影响肿瘤化疗的耐药性已成为大量研究的热点〔9,10〕。
miR-137是一种典型的23-nt miRNA,最初在2002年被鉴定为卵巢癌、乳腺癌、肝细胞癌、非小细胞肺癌、结直肠癌和胃癌中的肿瘤抑制性miRNA〔11~16〕。miR-137在RCC组织中表达下调,并在RCC进展中发挥肿瘤抑制作用〔17〕。此外,一些研究表明,miR-137可能参与调节多种癌症对多种抗癌药物的耐药性〔18~21〕。然而尚不清楚miR-137在RCC细胞化疗敏感性中的作用,本研究详细研究了miR-137对人RCC细胞CDDP敏感性的影响情况。
1 材料和方法
1.1材料 两种人类RCC细胞系(A498,一种肾癌上皮样细胞;和786-O,人肾透明细胞腺癌)购自美国ATCC细胞培养库;胎牛血清、RPMI1640培养基购自美国Gibco公司,胰蛋白酶、LPS 购自 Sigma-Aldrich 公司;TRIzol、Lipofectamine2000试剂盒购自美国 Invitrogen 公司;miScript RT试剂盒、miScript SYBR Green PCR购自德国 Qiagen公司;双染色流式法细胞凋亡检测试剂盒购于美国BD 公司;miR-137模拟物和相应的阴性对照miRNA(miR-NC)购自上海基因制药有限公司;CDDP 购买于Sigma-Aldrich,溶解在0.9%的无菌盐水中,用于后续实验;细胞计数试剂盒(CCK)-8购自Dojindo Molecular Technologies,Inc.公司。半胱天冬酶3活性测定试剂盒购自Beyotime Institute of Biotechnology公司,流式细胞仪购自美国 BD 公司,实时荧光PCR仪购自美国 ABI公司;酶标仪和分光光度计购自Sigma-Aldrich公司。
1.2耐药细胞系的建立 为了建立抗CDDP的RCC细胞(RCC/CDDP),采用逐渐增加剂量的CDDP处理786-O和A498细胞,直到存活的细胞显示出正常的生长模式。786-O和A498细胞首先用0.5 μg/ml的CDDP处理4 h,然后释放到无CDDP的 RPMI1640培养基中,直到恢复。对诱导细胞进行相同的处理,CDDP浓度逐渐增加,最后增加到5 μg/ml。当诱导细胞仍在5 μg/ml的CDDP中存活时,证实细胞对CDDP具有耐药性,并将这两种耐CDDP的RCC细胞分别命名为786-O/CDDP和A498/CDDP。
1.3细胞转染 根据使用说明,使用脂质体2000将miR-137模拟物和对照miR-NC模拟物瞬时转染到RCC细胞或者RCC/CDDP细胞中(786-O/CDDP和A498/CDDP)。
1.4RNA分离和RT-qPCR 参照TRIzol使用说明,利用TRIzol试剂从培养的RCC细胞和RCC/CDDP细胞中提取总RNA。 miScript RT 试剂盒 用于从1 μg总RNA合成cDNA。使用miScript SYBR Green PCR试剂盒在ABI PRISM 7900荧光定量PCR仪上对miR-137的表达水平进行检测。反应条件如下:95℃,2 min,95℃,35 s 40个循环,56℃,40 s。引物序列如下:miR-137正向引物为5′-GCGCTTTTGCTTAGATAC-3′,反向5′-CAGTGCAGGGTCAGGT-3′;U6正向引物为5′-GCTTCGGCAGCATATATAT ATATAAAT-3′,反向5′-CGCTTCACGAATTGCGTCAT-3′;miR-137的相对表达量分析使用2-ΔΔCt方法计算〔22〕,以U6 snRNA作为内部对照。
1.5细胞增殖试验 使用CCK-8测定细胞增殖。将转染的细胞在96孔板(2×103细胞/孔)中放置24、48、72、96或120 h。随后,将CCK-8溶液添加到这些孔中在培养2 h。使用分光光度计测量溶液450 nm处的吸光度。
1.6凋亡检测 转染后48 h后,使用0.25%胰蛋白酶分离细胞,在细胞内加入异硫氰酸荧光素(FITC)和碘化丙啶(PI)试剂盒。避光15 min后,上流式细胞仪检测细胞凋亡。使用CellQuest软件(版本0.9.3.1)分析凋亡数据。
1.7半胱氨酸天冬氨酸酶(Caspase)-3活性测定 转染48 h后收获RCC细胞。使用Caspase-3活性测定试剂盒(Beyotime Institute of Biotechnology)测定Caspase-3活性。
1.8统计分析 采用SPSS27.0软件进行t检验,Tukey事后检验。
2 结 果
2.1RCC抗CDDP细胞株(A498/CDDP和786-O/CDDP)细胞增殖增加 与RCC细胞(A498和786-O)相比,RCC/CDDP细胞(A498/CDDP和786-O/CDDP)48、72、96、120 h的细胞增殖显著增加(P<0.05,P<0.01),见表1。
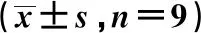
表1 CCK8法检测不同时间点不同细胞株RCC细胞和RCC/CDDP细胞的增殖情况
2.2miR-137在RCC细胞中及RCC抗CDDP细胞中的表达 与正常RCC细胞(786-O:1.0±0.12、A498:1.0±0.14)相比,RCC/CDDP细胞株中miR-137的表达水平显著降低(0.42±0.06、0.38±0.05,P<0.05,P<0.01)。
2.3转染 miR-137模拟物增加了miR-137在A498/CDDP和786-O/CDDP细胞中的表达 转染miR-137模拟物显著增加miR-137在A498/CDDP和786-O/CDDP细胞中表达(P<0.01)。见表2。
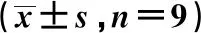
表2 转染miR-137模拟物或miR-NC的786-O/CDDP和A498/CDDP细胞中miR-137的表达
2.4过表达miR-137降低 A498/CDDP和786-O/CDDP细胞增殖 转染miR-137模拟物48、72、96、120 h后可显著降低A498/CDDP和786-O/CDDP细胞的增殖(P<0.05,P<0.01),见表3。
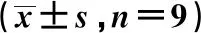
表3 转染miR-137对786-O/CDDP和A498/CDDP细胞增殖的影响
2.5过表达miR-137增加 A498/CDDP和786-O/CDDP细胞凋亡 过表达miR-137显著诱导A498/CDDP和786-O/CDDP细胞凋亡(P<0.05,P<0.01),见表4。
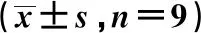
表4 转染 miR-137对786-O/CDDP和A498/CDDP细胞凋亡的影响
2.6过表达miR-137增加 A498/CDDP和786-O/CDDP细胞Caspase-3活性 与转染miR-NC的细胞相比,miR-137过表达显著增加了A498/CDDP和786-O/CDDP细胞中的Caspase-3活性(P<0.01),见表5。
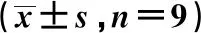
表5 转染 miR-137对786-O/CDDP和A498/CDDP细胞中caspase-3表达的影响
3 讨 论
先前的研究表明miRNAs通过调节癌基因或抑癌基因来调节RCC化疗耐药性〔9,10〕。如miR-31-5p过表达通过靶向RCC中的mutL同源物1促进索拉非尼耐药性〔23〕。Sekino等发现,miR-130b通过调节染色体10上删除的磷酸和张力同源性,增加了RCC细胞对舒尼替尼的耐药性〔24〕。Li等〔25〕表明,miR-210-3p通过靶向ATP结合盒转运体亚型C1降低RCC的化疗耐药性。
miR-137已经被报道参与调节几种癌症的药物敏感性〔24〕。例如,miR-137增强了非小细胞肺癌对紫杉醇和CDPP的化疗敏感性〔21〕,降低了前列腺癌细胞对比卡鲁胺的耐药性〔18〕,对化疗药物奥沙利铂的化疗敏感性结肠癌细胞〔20〕,并调节了神经母细胞瘤细胞对阿霉素的敏感性〔26〕。然而,miR-137在RCC化疗敏感性中的作用尚不清楚。本研究结果表明miR-137可以增强RCC细胞对CDDP的敏感性。
Caspase-3是Caspase家族中最重要的凋亡执行者之一,参与多种因素诱导的细胞凋亡〔27〕。是细胞凋亡发生的最为重要的生化特征,它负责大量底物的蛋白水解,抑制Caspase-3的活性可使细胞凋亡受到抑制,因而Caspase-3活性的改变是反映细胞凋亡的一个重要参数。本研究结果表明对于耐药的肾癌细胞,CDDP不能通过有效提高Caspase-3的活性而诱导细胞凋亡,而过表达miR-137之后,Caspase-3活性明显提高,证实miR-137可通过提高Caspase-3的活性而促进凋亡,从而提高CDDP诱导细胞凋亡的能力。
