海口地区老年Hp相关性胃病患者病原菌基因型检测及其与疾病病理类型的关系
2022-12-06董霄吴多智曹芹芳孔灿灿高照
董霄 吴多智 曹芹芳 孔灿灿 高照
(海南省人民医院(海南医学院附属海南医院) 1老年医学中心,海南 海口 570311;2消化内科;3内镜中心)
世界上超过半数的人口均发现幽门螺杆菌(Hp)在胃上皮定植,亚洲、中美洲和南美洲是流行率最高的地区〔1〕。Hp一旦传播到胃,通过脲酶中和胃酸、鞭毛鞘保护鞭毛抵御胃酸侵袭,顺利移动至胃上皮细胞,在胃黏膜形成永久性感染,诱发免疫反应,若不及时治疗,会导致慢性胃炎、肠上皮化生、异型增生的逐渐发展,最终导致胃癌,而早期预防Hp定植可以降低胃癌发病率〔2〕。Hp致病性和其诱发疾病的潜在进展与其携带的毒力基因相关,如cagA与胃黏膜炎症及更严重的Hp感染临床后果相关〔3〕,vacA编码的细胞毒素通过形成空泡对上皮细胞造成损伤,从而启动促炎反应,特异性抑制T细胞激活和增殖〔4〕。以上两种是严重Hp感染相关的毒力基因,但不足以解释Hp感染相关胃病的临床病理多样性。因此,需要明确是否存在其他Hp毒力基因与临床病理倾向相关。目前尚无Hp感染胃腺癌病原体基因表达的相关研究,本研究拟对比分析老年慢性非萎缩性胃炎、慢性萎缩性胃炎、胃腺癌患者胃镜活检样本Hp毒力基因的差异表达。
1 资料与方法
1.1一般资料 选取海南省人民医院2019年1月至2020年1月收治的老年慢性非萎缩性胃炎、慢性萎缩性胃炎、胃腺癌患者胃活检样本各40份。纳入标准:(1)年龄≥60周岁;(2)慢性非萎缩性胃炎、慢性萎缩性胃炎经胃镜检查确诊〔5〕,胃癌患者经胃镜、病理学检查等确定为腺癌〔6〕;(3)经13C呼气试验证实存在Hp感染;(4)未经Hp根除治疗;(5)患者及家属对本研究知情并签署同意书。排除标准:(1)既往有胃部手术史或放、化疗史;(2)严重心、肺疾病者;(3)胃镜前1 w内曾服用抗凝药物;(4)患有精神疾病、依从性差;(5)临床资料不完整。本研究经医院伦理委员会批准,符合赫尔辛人体试验准则。3组性别、年龄、基础疾病差异均无统计学意义(P>0.05),见表1。
表1 3组一般情况比较
1.2Hp分离与培养 胃镜前1 d嘱咐患者保持空腹6~8 h,在患者接受检查前完善血压、心电图检查,确定无异常方可进行。参考《消化内镜金标准与操作手册》〔7〕进行胃镜检查,取部分胃窦或胃体的胃黏膜组织,一部分送至检验科进行病理学检测,一部分置于无菌生理盐水中保存用于基因检测。快速尿素酶试验鉴定Hp菌株后,常规培养7 d并进行革兰染色。
1.3PCR检测毒力基因 试剂盒提取Hp菌株DNA,按照试剂盒配制PCR体系,采用PCR仪进行扩增,条件:95℃,5 min预变性;95℃,30 s,50℃,30 s,72℃,30 s,循环30次;72℃,7 min延伸。将扩增产物进行凝胶电泳,条带送至上海生工生物工程公司进行测序,毒力基因引物序列见表2。

表2 Hp毒力基因引物序列
1.4统计学分析 采用SPSS24.0软件进行χ2检验、Kruskal-Wallis秩和检验、单因素方差分析及LSD-t检验、Logistic回归分析。
2 结 果
2.13组Hp毒力基因分布 Hp cagA、vacA s1、vacA m1、vacA m2、dupA、iceA1、oipA基因在3组胃黏膜样本中均有检出,3组vacA s1检出率均为100.00%,cagA、vacA m2、iceA1和oipA检出率均高于50.00%,vacA s2均未检出,vacA m1与vacA m2为互补关系(P<0.05);3组Hp cagA、iceA1、iceA2、iceA1+iceA2、oipA基因表达差异有统计学意义(P<0.05),其中cagA、iceA1在胃腺癌组显著高表达(P<0.05),iceA2、iceA1+iceA2、oipA在慢性非萎缩性胃炎组和慢性萎缩性胃炎组中显著高表达(P<0.05),见表3。
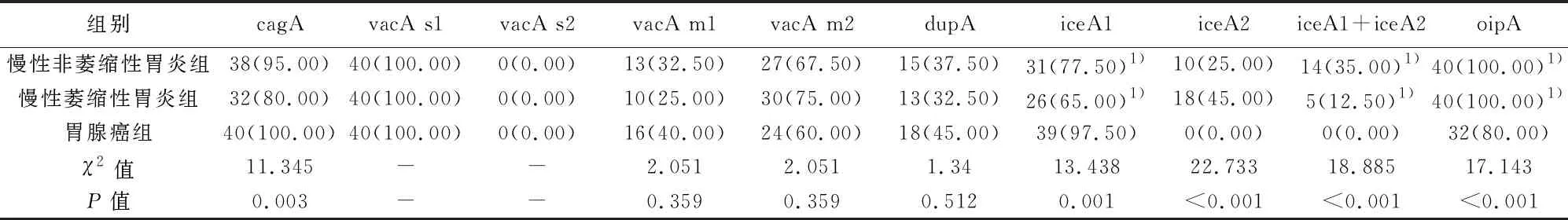
表3 3组Hp毒力基因分布〔n(%),n=40〕
2.2Hp毒力基因与疾病相关性 Logistic回归分析显示,比较慢性萎缩性胃炎、胃腺癌发生时,cagA、iceA1与胃腺癌相关(P<0.05),iceA2、iceA1+iceA2、oipA与慢性萎缩性胃炎相关(P<0.05);比较慢性非萎缩性胃炎、胃腺癌发生时,iceA1与胃腺癌相关(P<0.05),iceA2、iceA1+iceA2、oipA与慢性非萎缩性胃炎相关(P<0.05);比较慢性萎缩性胃炎、慢性非萎缩性胃炎发生时,iceA1+iceA2与慢性非萎缩性胃炎相关(P<0.05),见表4。
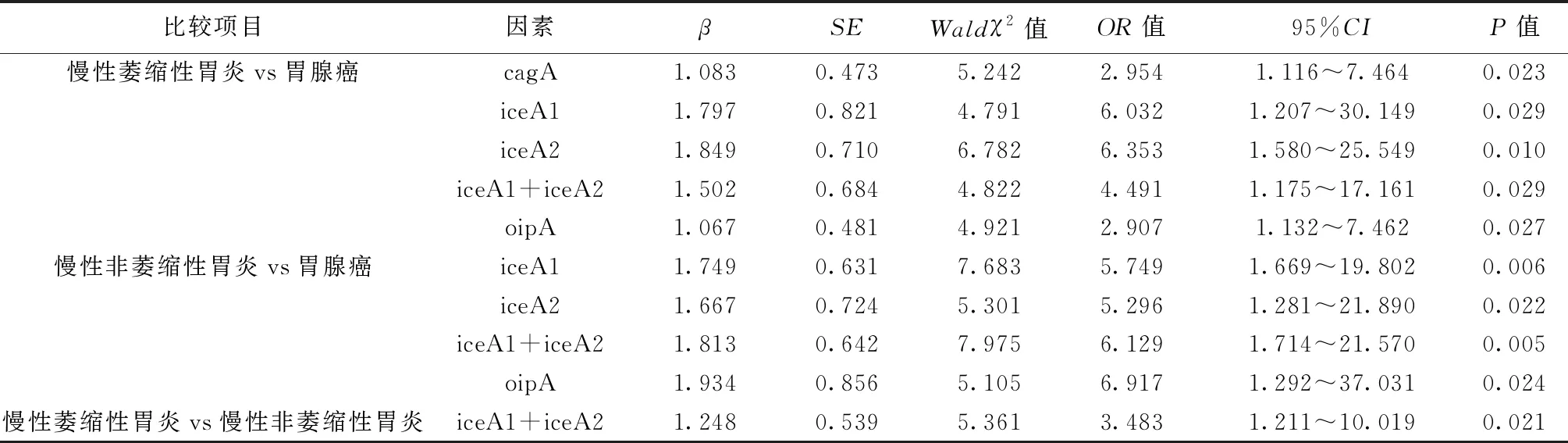
表4 Hp毒力基因与Hp相关性胃病的相关性
3 讨 论
Hp是一种革兰阴性菌,在全球范围内呈现高感染率,但大部分感染者没有明显症状,仅在胃镜下才能检出胃炎,Hp感染的结果主要取决于其与胃、外部环境之间的相互作用〔8〕。Hp会产生许多因素和策略来适应胃酸环境,并建立持续感染,可中和胃酸环境的脲酶、鞭毛、螺旋形状等因素相结合,形成有效的趋化系统以帮助Hp到达胃黏膜的保护性黏液层〔9〕。目前治疗Hp最常用的疗法是基于克拉霉素的三联疗法或用新型抗生素替代克拉霉素的四联疗法〔10〕,抗生素的过度使用也使Hp对克拉霉素产生耐药性,研究发现23S rRNA基因的A2143G突变与Hp对克拉霉素耐药相关〔11〕,表明Hp基因突变与产生耐药性相关。除此之外,Hp临床分离株检测到的毒力基因也参与了疾病症状的发展,并宿主基因多态性、环境因素共同确定诱导疾病类型〔12〕。
本研究中120株Hp菌株中,除vacA s2外,其余8种毒力基因均有检出,且vacA s1的检出率为100.00%,不同疾病来源Hp中vacA m1、vacA m2均互补关系,与过去的研究结果一致〔13〕,本研究结果表明海口地区老年Hp相关性胃病病原菌流行的毒力基因以vacA m1、cagA、vacA m2、iceA1和oipA为主,还发现cagA、iceA1、iceA2、iceA1+iceA2、oipA是主要的差异毒力基因。CagA和vacA均参与肿瘤免疫逃逸和诱导疾病,cagA是一个125~145 kD的效应蛋白,该蛋白的Hp菌株被认为具有高毒力,cagA合成后通过Ⅳ型分泌系统转运到胃上皮细胞,其EPIYA基序的酪氨酸残基会被多种细胞激酶磷酸化,导致多种细胞信号通路失调,其中包括Wnt、ERK信号通路,后者已被发现在胃癌等多种恶性肿瘤的侵袭和发展中起重要作用〔14,15〕。vacA是一种外毒素,能在真核细胞中引起空泡化,还有研究表明vacA介导促使cagA蛋白降解的自噬途径破坏,增强Hp毒性〔16〕,所有Hp菌株中有vacA表达,但只有约50%的菌株具有空泡形成活性,这是由于其信号区s、中间区m的基因多态性〔17〕,s1型表现出疏水特性,介导毒素的二聚化,促进阴离子选择性通道形成,s2型具有12个氨基酸的亲水序列延伸,提供与s1不同的裂解位点,从而抑制细胞空泡化,m1和m2的差异导致Hp毒力不同及胃炎、胃癌的离散发病率〔18〕。iceA在Hp与胃上皮接触后诱导,分为iceA1和iceA2两个等位基因变体,iceA1是东亚地区主要流行的亚型,与消化性溃疡和胃黏膜白细胞介素(IL)-8水平升高有关,而iceA2主要在美洲流行〔19〕。dupA具有多功能生物活性,被认为是十二指肠溃疡的重要生物标志物〔20〕。oipA是Hp的一种黏附素,可诱导炎症并产生IL-8,也有研究表明其与cagA在发病机制上具有协同作用,Teymournejad等〔21〕发现oipA通过调节Bax/Bcl-2水平诱导胃上皮细胞凋亡。
本研究慢性萎缩性胃炎、慢性非萎缩性胃炎的Hp毒力基因差异表达结果与刘丽娜等〔22〕研究相一致。本研究首次分析了不同Hp相关性胃病的Hp毒力基因表达差异,不足之处在于样本量较小,且未深入探究出现此差异的机制,应扩大样本量以增加结果的准确性,并开展进一步机制研究。
综上,海口地区老年Hp相关性胃病病原菌流行的毒力基因以vacA m1、cagA、vacA m2、iceA1和oipA为主,慢性非萎缩性胃炎、慢性萎缩性胃炎、胃腺癌患者临床分离Hp菌株的毒力基因表达具有差异,cagA、iceA1与胃腺癌相关,iceA2、iceA1+iceA2、oipA与慢性非萎缩性胃炎、慢性萎缩性胃炎相关,而iceA1+iceA2又与慢性非萎缩性胃炎相关。
