刺云实胶对草鱼肌原纤维蛋白的冷冻保护作用
2022-12-06张灵芝张钰琦丁玉琴
张 霞,张灵芝,张钰琦,郭 娟,丁玉琴
(中南林业科技大学食品科学与工程学院,湖南 长沙 410004)
鱼糜制品因具有营养丰富、低脂、高蛋白等特点而深受消费者的欢迎,是我国重要的水产品加工品种。鱼糜通常在冷冻条件下进行贮藏和流通,但是冻藏会引起鱼糜蛋白质的主要组分——肌原纤维蛋白冷冻变性,如巯基含量和Ca2+-ATPase 活性下降、表面疏水性增加和蛋白质发生交联聚集等,从而使鱼糜凝胶形成能力和持水性降低[1-2]。抗冻剂添加后会使得冻藏过程中鱼糜中的冰晶生长被抑制,增强蛋白质的结构稳定性,从而达到减缓鱼糜冷冻变性的效果[3]。4%蔗糖和4%山梨醇混合物是有效的鱼糜商业抗冻剂,但其有高甜度、高热量的缺陷,不符合健康绿色生活的需求趋势[4-5],因此,寻找“低糖、低热量”的高效冷冻保护剂是冷冻鱼糜领域备受关注的研究方向之一。
目前国内外已开展了抗冻蛋白、磷酸盐、海藻糖、酚类、壳聚糖等多种新型鱼糜抗冻剂的研究[6-7]。海藻糖虽具有甜度值和热量值低的特点,但有研究表明流行病艰难梭菌的爆发频率和严重性的增加与海藻糖的广泛使用相关联,因而其使用存在潜在危险[8];抗冻蛋白虽然抗冻效果好,但是其获取方式主要来自于自然生物或者基因工程,其安全性有待进一步研究[9-10];很多天然酚类物质带有颜色,使用后会对食品感官品质造成不良影响[11]。因此,有必要开发新型的绿色抗冻剂。
刺云实胶(Tara gum,简称TG),又称为刺云豆胶、塔拉胶,由直链(1→4)-β-D-吡喃型甘露糖单元与α-D-吡喃型半乳糖单元通过(1→6)键聚合而成,具有良好的热稳定性和化学稳定性[12]。我国于2006 年4 月批准了刺云实胶作为食品添加剂,其在肉制品中的最大使用量为10.0 g/kg[13]。在冰淇淋中加入刺云实胶后,刺云实胶中半乳糖单元内含有的羟基可与大量游离水结合形成氢键,减少游离水含量,进而减小冰淇淋中冰晶的颗粒,使冰淇淋能够保持良好的质地[12]。然而,刺云实胶在肌原纤维蛋白中的抗冻性及其机制的研究鲜有报道。
因此,本研究以草鱼肌原纤维蛋白作为研究对象,以传统商业抗冻剂(4%蔗糖+4%山梨醇)为对照,研究刺云实胶对肌原纤维蛋白的冷冻保护作用,旨在为刺云实胶在鱼类抗冻保鲜中的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
鲜活草鱼 购于步步高超市,尾重约为1.50±0.5 kg;刺云实胶 食品级,购于绍兴欣柏贸易有限公司;5-腺苷三磷酸二钠盐(5’-ATP,Na2)、1-苯胺基-8-奈基磺酸盐(1,8-ANS) 均为分析纯,购于上海源叶生物有限公司;山梨醇 分析纯,购于北京索莱宝科技有限公司;蔗糖 分析纯,购于国药集团化学试剂有限公司;5-5’-二硫代双-硝基苯甲酸(DTNB) 分析纯,购于上海瑞永生物科技有限公司。
MS105DU 分析天平 梅特勒仪器(上海)生产有限公司;BD-159WVUT 低温冰箱 海信集团有限公司;TGL-20M 离心机 湘仪离心机厂;NMI20 核磁共振成像分析仪 上海纽迈电子有限公司;F95S荧光分光光度计 上海棱光技术有限公司;UV-2660紫外-可见光分光光度计 日本岛津公司;EL20 pH 计 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 肌原纤维蛋白及其溶液的制备 参考Benjakul等[14]的方法并略作改进。将草鱼宰杀、去头、去皮、去内脏,采肉。将新鲜的草鱼鱼肉搅碎,加入10 倍(W/V)冷的Tris-maleate 缓冲液(50 mmol/L KCl-20 mmol/L Tris-maleate,pH7.0),充分混匀,于4 ℃下10000×g离心13 min,随后除去上清液,重复上述操作两次。随后加入3 倍(W/V)Tris-maleate 缓冲液(0.6 mol/L KCl-20 mmol/L Tris-maleate,pH7.0),放入4 ℃冰箱提取60 min。4 ℃,10000×g 冷冻离心15 min,离心后所得上清液即为肌原纤维蛋白溶液,加入10 倍体积冷去离子水,将蛋白沉淀,4 ℃,10000×g 离心15 min,沉淀是肌原纤维蛋白。用上述高浓度缓冲液溶解所得肌原纤维蛋白,并用0.6 mol/L 的NaCl 调整其浓度为40 mg/mL。
1.2.2 肌原纤维蛋白溶液的冻藏 分别向肌原纤维蛋白溶液中添加0%(空白对照组)、0.5%、1.0%刺云实胶和4%蔗糖+4%山梨醇(商业抗冻剂组)后于-20±1 ℃冰箱中冻藏,每隔7 d 取出并于4 ℃冰箱中解冻,用于检测各种指标。
1.2.3 肌原纤维蛋白溶液冻结曲线的测定 将温度记录仪探头插入每组新鲜肌纤维蛋白溶液样品的几何中心,置于-20±1 ℃的冰箱冷冻。等待中心温度下降到-18 ℃,完成冻结。设置温度记录温度频率:1 min/次,根据温度变化绘制处冻结曲线[15]。
1.2.4 Ca2+-ATPase 活性的测定 参考任丽娜[16]的方法。取1.0 mL 肌原纤维蛋白稀释液加入0.5 mol/L Tris-maleate(pH7.0)溶液0.5 mL,0.1 mol/L CaCl2溶液0.5 mL,2.0 mol/L NaCl 溶液2.2 mL,去离子水5.3 mL,混匀后,进行25 ℃恒温,随后加入20 mmol/L ATP 溶液,反应10 min 后加入15% TCA 作反应终止剂,过滤反应液,用去离子水定容至25 mL。测定上清液含有的无机磷的量,采用钼蓝比色法[17]。Ca2+-ATPase 活性用每毫克肌原纤维蛋白在反应10 min内释放出的无机磷的量表示,即μmolPi/mg protein/10 min[7]。
1.2.5 总巯基和活性巯基的测定 总巯基含量测定参考Noman 等[7]的方法,并略作修改。将肌原纤维蛋白溶液用0.6 mol/L KCl 溶液稀释,使蛋白溶液浓度为4 mg/mL 左右,取1 mL 稀释后的样液,加入4 mL的Ellman 试剂(10 mmol/L 乙二胺四乙酸、2%SDS、8 mol/L 尿素、0.2 mol/L 的Tris 盐酸)。混匀,随后加入0.5 mL 的Tris-HCl 缓冲液(pH8.0)振荡混匀,40 ℃水浴25 min。以0.6 mol/L KCl 溶液作为空白,412 nm 处测定吸光值。
活性巯基取稀释后的样液2.25 mL 加入15 μL Ellman 试剂混匀,于4±1 ℃放置1 h,412 nm 处测定吸光值。
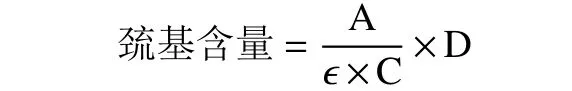
注:A-测得的吸光值;C-蛋白浓度 (mg/mL);ε-DTNB 的摩尔消光系数,13600 mol-1·cm-1;D-稀释倍数;测得的巯基含量以mol/105g 蛋白质计[7]。
1.2.6 表面疏水性的测定 参考Riebroya[18]等的方法并适当修改。以蛋白质浓度为横坐标,荧光强度为纵坐标绘制曲线,肌原纤维蛋白的表面疏水指数S0ANS 用该曲线初始阶段的斜率表示。
1.2.7 内源性荧光光谱的测定 稀释肌原纤维蛋白溶液浓度至0.05 mg/mL,参数设置:激发波长295 nm,激发和发射狭缝宽度均为5 nm,波长扫描范围为300~400 nm,扫描速度为12000 nm/min,每个样品做3 次平行[19]。通过内源荧光光谱观察冻藏过程中肌原纤维蛋白三级结构变化。
1.2.8 肌原纤维蛋白溶液水分流动性的测定 将肌原纤维蛋白溶液装入核磁管中,选用Q-FID 序列进行校正,Q-CMPG 序列进行数据采集。每组测量3 个平行。参数设置:采样频率SW(kHz)=100;弛豫时间TW=2500 ms;采样次数NS=8;回波个数NECH=4000。反演方法:SIRT。
1.3 数据处理
每个实验重复三次,结果表示为平均值±标准差,数据结果采用Excel 2010 绘图进行统计学分析。采用SPSS22.0 软件进行方差分析和显著性检验。
2 结果与分析
2.1 刺云实胶对肌原纤维蛋白溶液冻结曲线的影响
图1 为添加不同抗冻剂的肌原纤维蛋白溶液的冻结曲线。在冻结过程中,空白对照组,添加0.5%刺云实胶组,1%刺云实胶组,商业抗冻剂组通过最大冰晶带( -1~5 ℃)所用时间分别为29、34、31、25 min。添加商业抗冻剂组和空白对照组通过最大冰晶带的速率略快于添加刺云实胶的组。由图1可看出空白对照组、添加0.5%刺云实胶组、1%刺云实胶组和商业抗冻剂组冻结点分别为 -5.5、 -6.3、-8.3、 -7.3 ℃,到达冻结点的时间分别为10、11、17、14 min,冻结速率分别为12.01、14.00、10.29、11.94 ℃/min。添加刺云实胶对肌原纤维蛋白样品中心温度的变化均慢于商业抗冻剂组,但1.0%刺云实胶添加组冻结速率与空白对照组相接近。在冻结过程中,冷冻食品品质与冻结速率密切相关,快速通过最大冰晶带可以减少肌原纤维蛋白的冷冻损伤[20-21]。由此可得, -18 ℃冻结环境下,添加刺云实胶对肌原纤维蛋白通过最大冰晶带的速度稍有负面影响,但其对整体冻结过程影响较小。
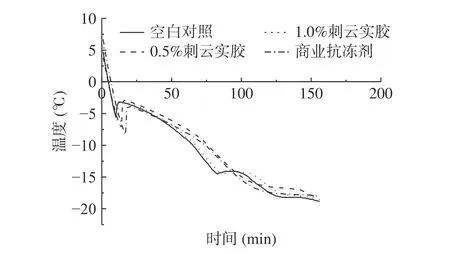
图1 肌原纤维蛋白溶液冻结过程中心温度的变化Fig.1 Changes of central temperature during freezing of myofibrillar protein solution
2.2 刺云实胶对肌原纤维蛋白冻藏过程中Ca2+-ATPase活性的影响
Ca2+-ATPase 的活性是判断肌球蛋白变性程度的敏感指标之一[22],在冻藏过程中,由于冰晶的形成和生长,导致结合水与蛋白质的结合状态以及肌球蛋白头部聚集或发生构象变化[23],进而导致肌原纤维蛋白的Ca2+-ATPase 活性随冻藏时间增加而降低[7]。如图2 所示,冻藏28 d 后,空白对照组,添加0.5%、1.0%刺云实胶和添加商业抗冻剂的肌原纤维蛋白的Ca2+-ATPase 活性分别比新鲜肌原纤维蛋白下降了60.12%、53.53%、45.69%、45.17%,添加1%刺云实胶的肌原纤维蛋白的Ca2+-ATPase 活性与商业抗冻剂组没有显著性差异(P>0.05)。由此可知,1.0%刺云实胶添加后,减缓了蛋白Ca2+-ATPase 活性的下降。
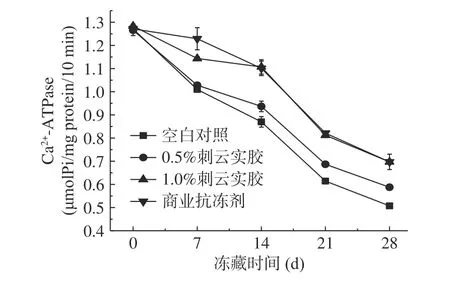
图2 肌原纤维蛋白冻藏过程中Ca2+-ATPase 活性的变化Fig.2 Changes of Ca2+-ATPase activity of myofibrillar protein during freezing
2.3 刺云实胶对肌原纤维蛋白冻藏过程中蛋白结构的影响
2.3.1 刺云实胶对肌原纤维蛋白冻藏过程中总巯基和活性巯基含量的影响 在冷冻贮藏过程中,肌纤维蛋白结构的变化使蛋白质内部的巯基暴露在表面,巯基易于氧化并产生二硫键,导致总巯基含量减少[14],因此通过蛋白质巯基的含量变化能够估测蛋白质变性程度[24]。如图3 所示,在冻藏过程中,肌原纤维蛋白总巯基含量和活性巯基随冻藏时间延长而下降,添加1%刺云实胶的肌原纤维蛋白的巯基含量和活性巯基含量显著高于其他组(P<0.05)。添加0.5%的刺云实胶与商业抗冻剂组的巯基保护作用无显著性差异(P>0.05)。从总巯基含量和活性巯基含量的角度来看,1%刺云实胶添加的抗冻效果优于商业抗冻剂,能很大程度上抑制巯基氧化,起到保护肌原纤维蛋白的作用。Huang 等[25]研究证明半乳甘露聚糖具有良好的抗菌活性和抗氧化活性,推测刺云实胶具有抗冻性可能是由于刺云实胶具有抗氧化活性而抑制了巯基的氧化,或是由于刺云实胶中半乳甘露糖的半乳糖支链含有羟基,羟基与游离水结合形成氢键,使得冻藏过程中鱼糜中形成较小的冰晶颗粒,减小了冻藏对肌原纤维蛋白的损伤[26]。
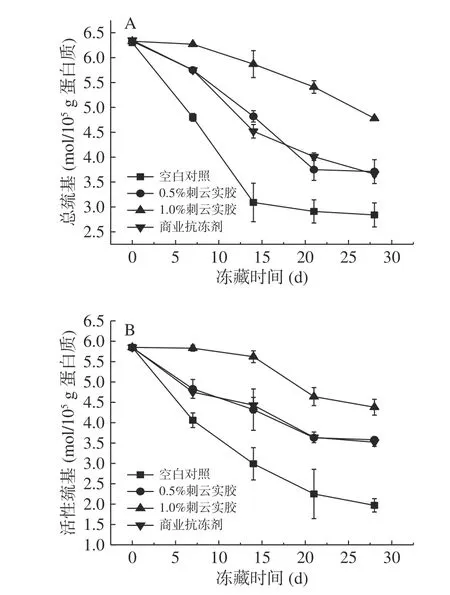
图3 肌原纤维蛋白冻藏过程中总巯基含量(A)和活性巯基含量(B)的变化Fig.3 Changes of total sulfhydryl group content (A) and active sulfhydryl group content (B) of myofibrillar protein during freezing
2.3.2 刺云实胶对肌原纤维蛋白冻藏过程中表面疏水性的影响 如图4,随冻藏时间的延长,肌原纤维蛋白的表面疏水性增加,这是因为,鱼肉新鲜时,其肌原纤维蛋白的疏水性基团被包围在分子内部,表面疏水性低,冷冻贮藏后,蛋白质多肽链上最初的疏水基团暴露在表面并被氧化,导致蛋白质分子表面疏水性增强[17]。与新鲜肌原纤维蛋白相比(冻藏0 d),在冻藏28 d 后,空白对照组、添加0.5%刺云实胶、添加1%刺云实胶和添加商业抗冻剂的肌原纤维蛋白表面疏水性分别增加了436.04%、191.65%、176.00%、122.23%,刺云实胶组和商业抗冻剂组样品的表面疏水性上升程度显著低于空白对照组(P<0.05),主要因为肌原纤维蛋白受到保护,变性程度减小,分子结构没有发生大程度破坏,减少了疏水基团暴露[27]。说明添加商业抗冻剂和刺云实胶有助于抑制冻藏过程中表面疏水性的增加。
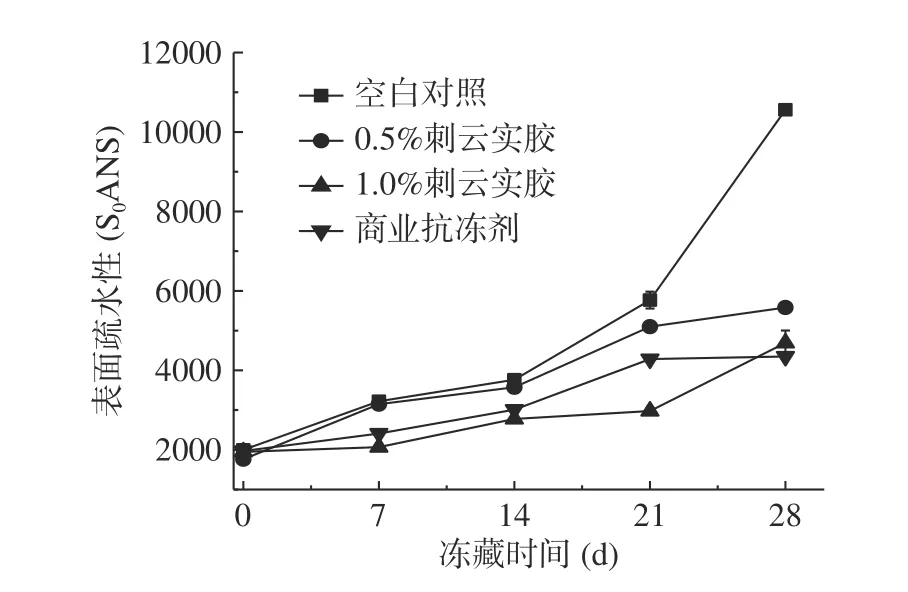
图4 肌原纤维蛋白冻藏期间表面疏水性的变化Fig.4 Changes of surface hydrophobicity of myofibrillar protein during freezing
2.3.3 刺云实胶对肌原纤维蛋白冻藏过程中内源性荧光的影响 蛋白质具有内源荧光性,但冷冻贮藏会导致蛋白质构象的变化,一些氨基酸的内源荧光显色基团的微环境和位置也会发生相应的变化,因此,内源荧光光谱可以用来反映蛋白质在冷冻贮藏过程中的构象变化[28]。
由图5 可以看出,随着冻藏时间延长,荧光强度均逐步降低,这是因为在冻藏过程中,蛋白变性伸展,原先位于蛋白内部的色氨酸残基暴露于表面,致使色氨酸荧光猝灭,造成内源荧光强度下降[18]。此外添加抗冻剂后相比空白对照组荧光光谱红移(向长波方向移动)。添加刺云实胶和商业抗冻剂的肌原纤维蛋白溶液的内源性荧光强度的下降程度显著慢于空白对照组(P<0.05)。在冻藏第7~21 d 时,添加1%刺云实胶的肌原纤维蛋白内源荧光强度较为稳定;在21 d后,添加1%刺云实胶的肌原纤维蛋白内源荧光强度出现显著下降。添加商业抗冻剂组的肌原纤维蛋白在第7~28 d 的内源荧光强度下降缓慢,较为稳定。说明刺云实胶和商业抗冻剂的添加可有效抑制肌原纤维蛋白荧光强度的下降,抑制冻藏过程中肌原纤维蛋白的冷冻变性。1%刺云实胶可达到与商业抗冻剂相当的抗冻效果。
2.4 刺云实胶对冻藏过程中肌原纤维蛋白水合能力的影响
将肌原纤维蛋白溶液冻藏0、14、21 和28 d 后在4 ℃下解冻12 h 后,采用低场核磁共振技术测其水分流动性,分析肌原纤维蛋白的水合能力,结果如图6 所示。

图6 肌原纤维蛋白溶液解冻后水分流动性的变化Fig.6 Changes of moisture fluidity of myofibrillar protein solution after thawing
肌原纤维蛋白溶液中的水分主要存在3 种不同状态:与大分子紧密结合的结合水、存在于肌原纤维网络内部的不易流动水和肌原纤维网络外部的自由水,表现为3 个峰[29],图6 中T23峰(>1000 ms)代表自由水含量。弛豫时间越长,则鱼糜中水分流动性越强[30]。由图6 中不同组别肌原纤维蛋白溶液的水分流动性可看出,随着冻藏时间的增加,自由水的峰值时间后延,由此说明肌原纤维蛋白结合水的能力有所下降。空白对照组和添加0.5%刺云实胶组的肌原纤维蛋白溶液,在28 d 冻藏结束时,T23峰峰值时间显著增加(P<0.05);而添加1%刺云实胶和商业抗冻剂的肌原纤维蛋白溶液T23峰峰值时间增加显著慢于空白对照组(P<0.05)。图6 中T22(100~1000 ms)峰代表不易流动水含量 ,可以看出,四组冻藏样品随着冻藏时间增加,T22峰面积比例减小,不易流动水相对含量减少,表明肌原纤维蛋白结合水的能力下降。空白对照组在28 d 冻藏结束时,T22峰面积比例显著下降;而添加1%刺云实胶和商业抗冻剂的肌原纤维蛋白溶液T22峰峰面积减小显著慢于空白对照组。1%刺云实胶抗冻剂的加入可在很大程度上稳定蛋白的结构,减少肌纤维网络中水分的流失。
3 结论
刺云实胶和商业抗冻剂可以降低草鱼肌原纤维蛋白溶液的冻结点。随着冻藏时间的延长,未添加抗冻剂、0.5%刺云实胶、1.0%刺云实胶、商业抗冻剂的草鱼肌原纤维蛋白均发生了不同程度的冷冻变性。与未添加抗冻剂的空白肌原纤维蛋白相比,添加1.0%刺云实胶和商业抗冻剂可以有效延缓草鱼肌原纤维蛋白冻藏过程中Ca2+-ATPase 活性、巯基含量和内源性荧光强度的下降,表面疏水性和解冻后水分流动性的增加。1.0%刺云实胶在抑制冻藏过程中肌原纤维蛋白总巯基和活性巯基含量下降方面表现出比商业抗冻剂更好的效果。另外,1.0%刺云实胶可以减弱解冻后肌原纤维蛋白溶液的水分流动性。因此,1.0%刺云实胶可以增强草鱼肌原纤维蛋白的冷冻稳定性,是一种潜在的新型鱼糜抗冻剂。
