益生菌改善牛乳蛋白过敏性的研究进展
2022-12-06赵丽娜陈庆学岳莹雪吕秀莉平丽筠李柏良霍贵成
曹 婷,赵丽娜,陈庆学,岳莹雪,吕秀莉,平丽筠,李柏良,霍贵成
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
牛乳蛋白过敏是一种常见的过敏性疾病,通常伴随着不良免疫反应。牛奶是婴儿首先接受的外来抗原,是3 岁以下儿童的主要过敏食物,这也解释了婴幼儿牛乳蛋白过敏高发病率的原因。据研究,高达7.5%的儿童对牛奶过敏。越来越多的证据表明益生菌对改善牛乳蛋白过敏具有良好的效果。因此,益生菌对过敏症状的潜在预防和治疗效果引起了人们的广泛关注。大量研究表明益生菌可以通过调节肠道菌群的平衡在宿主免疫系统的发育和调节中发挥作用,从而改变过敏性疾病的发病风险[1]。本文从过敏原和诱导机理的角度介绍牛乳过敏,阐述益生菌对改善过敏的最新研究,最后总结当下低致敏性产品的研究现状。
1 牛乳蛋白过敏概述
牛奶蛋白过敏(Cow milk protein allergy,CMPA)是牛乳蛋白诱导机体免疫系统发生不同程度的过敏反应。牛乳蛋白是婴儿生长发育所需重要的营养物质,它被联合国粮食与农业组织(Food and Agriculture Organization of the United Nations,FAO)、世界卫生组织(World Health Organization,WHO)认为是八大过敏原之一,其中,主要的过敏原是酪蛋白和乳清蛋白。过敏现象的出现与人体产生的免疫球蛋白E(IgE)过多有关,当IgE 无法正常调控时产生以下的过敏反应,如特应性皮炎[2]、过敏性湿疹、过敏性哮喘和过敏性鼻炎等,这也是婴幼儿时期的常见问题[3-4]。
1.1 过敏原
牛乳中含有引起过敏的蛋白质约30 种[5],其基本理化特性如表1 所示。以牛乳为主的乳源中含有的酪蛋白和乳清蛋白在成分、含量以及结构上都与母乳有很大的差异(在牛乳中的酪蛋白:乳清蛋白=8:2;在母乳中的酪蛋白:乳清蛋白=4:6[8]),并且存在一些可以被人体免疫系统识别的构象表位和线性表位(图1)。因此,当乳蛋白进入人体后免疫系统可以识别其抗原表位,从而引发过敏反应。基于这个原因,已经对IgE 及IgG 结合区域进行了大量研究,甚至通过丙氨酸扫描分析法确定了致敏蛋白关键的氨基酸残基[9]。为牛乳蛋白脱敏技术的研究提供了一定的理论依据。

表1 牛乳过敏原基本信息[6-7]Table 1 Basic information of milk allergen[6-7]

图1 过敏表位结构[10]Fig.1 Allergic epitope structure[10]
1.2 牛乳蛋白过敏诱导机理
目前,CMPA 主要分为IgE 介导和非IgE 介导两种,诱导机理如表2 所示。

表2 牛乳蛋白诱导机制的区别Table 2 Differences in milk protein induction mechanism
IgE 介导的Ⅰ型急性超敏反应是常见的免疫反应,一般在摄入蛋白1 h 内发生过敏反应。这种超敏反应发展的第一步是牛奶蛋白过敏原通过肠道粘膜呈现给免疫细胞诱导致敏然后进行记忆诱导,随后接触牛奶蛋白过敏原发生即时反应[11],其致敏机制已经有深入的研究[12-14](图2)。

图2 IgE 介导的牛乳蛋白过敏机制[12-14]Fig.2 IgE-mediated mechanism of bovine milk protein allergy[12-14]
IgE 介导的CMPA 通常始于抗原呈递细胞对蛋白抗原的内化和加工。随后Th 细胞被活化,以Th2途径为主,分泌IL-4 和IL-13 细胞因子诱导浆细胞产生IgE,会与血液中肥大细胞或嗜碱性粒细胞表面高亲和力的Fc 受体特异性结合,从而产生组胺等物质作用于细胞组织使机体处于致敏的状态[14]。当相同过敏蛋白再次进入处于致敏状态的机体时,就促发了激发效应阶段,多个过敏原与吸附于肥大细胞和嗜碱性粒细胞表面的两个或两个以上相邻的IgE 结合发生交联反应,使肥大细胞等效应器细胞被激活,并在细胞内进行一系列酶促反应,从而激活致敏的肥大细胞和嗜碱性粒细胞使其脱颗粒,进而释放组胺、白三烯等生物活性介质,作用于血管,使血管扩张、通透性增加;作用于腺体,使腺体分泌增多;作用于平滑肌,使平滑肌收缩,从而导致皮肤及呼吸道的不适[15]。
非IgE 介导的CMPA 多表现在摄入乳蛋白后的几个小时到几天后,故常被称为“迟发型超敏反应”。Savino 等[16]研究表明轻度至中度非IgE 介导的CMPA 患者的IL-4 和IL-13 平均值增加,IL-5和IL-10 平均值降低。白细胞介素5(IL-5)主要被认为是一种Th2 细胞因子,它通过激活嗜酸性粒细胞引起过敏反应。研究显示IL-5 的值较低,这可能与非IgE 介导的食物过敏有关。目前的研究表明,Th2 分泌的IL-5 可能由于嗜酸性粒细胞的积累和激活而导致非IgE 细胞介导的过敏[10]。
2 益生菌改善牛乳过敏
由于益生菌所独有的生物学特点和肠道黏膜免疫反应的特异性,使肠道益生菌疗法作为一种改善牛乳过敏的新疗法日益受到重视。益生菌调节肠道菌群丰度及结构、增强肠粘膜屏障功能、保持Th1/Th2和Treg/Th17 平衡,增强机体免疫能力,表现出抗牛乳过敏的作用如表3 所示。
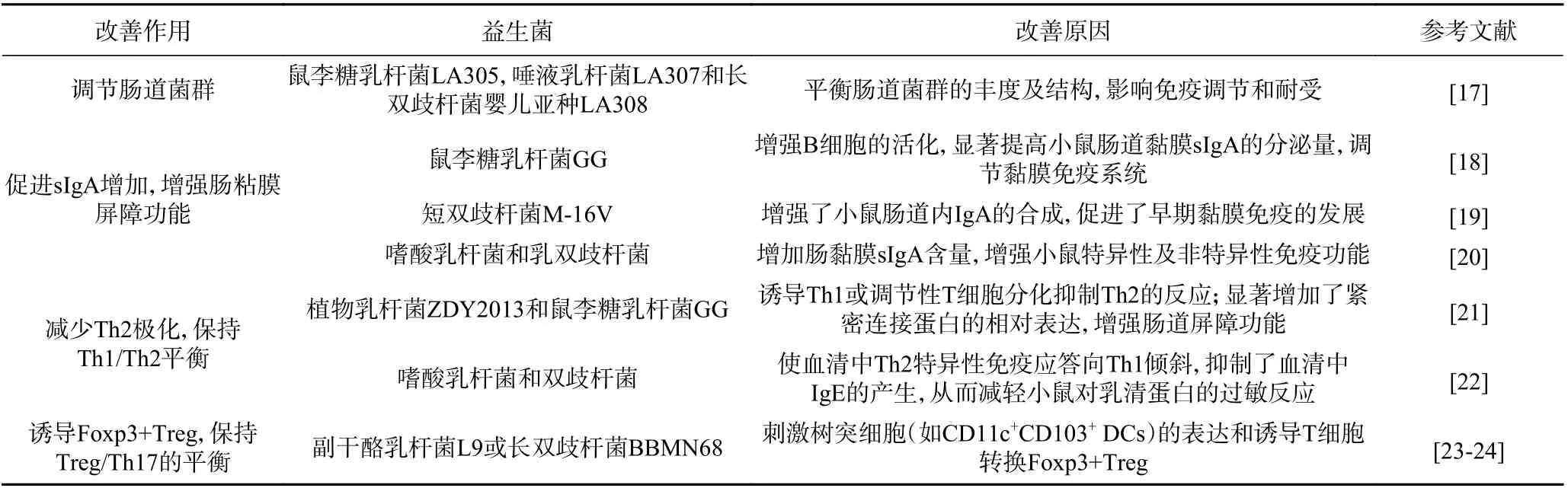
表3 益生菌对牛乳过敏的改善作用Table 3 Improvement effect of probiotics on milk allergy
2.1 调节肠道菌群
肠道是人体最大的免疫器官,人体和肠道菌群间进行着活跃的代谢过程,并共同决定人的健康状态。肠道微生物群被广泛认为是健康和疾病之间的重要调解者,特别是对早期宿主免疫系统的发育和成熟起着重要作用[25]。益生菌能够改变肠道菌群丰度,调节菌群结构,潜在地降低CMPA 的风险。
牛乳过敏者与正常人的肠道菌群有部分差异。Esber 等[17]研究鼠李糖乳杆菌LA305、唾液乳杆菌LA307 和长双歧杆菌婴儿亚种LA308 三种益生菌对过敏性小鼠肠道菌群的影响如表4 所示。Bunyavanich 等[26]研究表明肠道菌群组成的不同可以改变食物过敏的易感性和抗性,进一步揭示生命早期的肠道菌群可能是影响CMPA 机制和过程的关键因素。在一项对226 名牛奶过敏儿童的研究中,研究人员发现3~6 个月婴儿的肠道微生物特征与8 岁时牛奶过敏的消除有关,特别是3~6 个月的婴儿期是形成CMPA 过程的一个特殊的发育时间窗口[27]。儿童肠道微生物群中梭状芽胞杆菌和厚壁菌门的富集有助于在8 岁时减轻CMPA,而肠杆菌和拟杆菌门的增加导致严重的过敏反应[28]。

表4 不同益生菌对肠道菌群丰度的影响[17]Table 4 Different probiotics on the intestinal flora abundance[17]
因此,肠道菌群的平衡对CMPA 产生至关重要的影响。肠道菌群可能通过调节Ⅱ型免疫、影响免疫调节和耐受、调节嗜碱性粒细胞数量、促进肠道屏障功能等途径影响食物过敏易感性[29]。并且,肠道菌群在促进肠道免疫系统的成熟和触发宿主免疫和防御反应的介质的传递、调节Th 细胞平衡和口服耐受性的获得、维持肠道上皮细胞的完整性等方面发挥着重要作用。
2.2 提高肠道免疫
2.2.1 促进sIgA 增加,增强肠粘膜屏障功能 研究发现肠内益生菌不仅可以改善防御屏障,而且对增强婴幼儿肠道免疫力有刺激作用[30]。婴幼儿的免疫系统发育相对未成熟,因此肠道抵御过敏蛋白的能力也相对较差。在肠道上层的细胞表面有一层菌膜屏障,具有免疫保护作用,维持肠道微生态;当婴幼儿肠道菌群失调时,有害菌会造成肠黏膜通透性改变,导致致敏性蛋白进入体内,引起过敏反应,而益生菌定植后,能够在肠黏膜上形成一层保护膜,不仅修复并增强肠黏膜的屏障功能,还调节了菌群平衡,促进了免疫屏障的稳固[31]。
益生菌通过促进分泌性免疫球蛋白(slgA)的分泌,减少过敏原从肠道进入血液。在肠道黏液层,slgA 可通过与细菌胞壁抗原决定簇结合包裹异物来减缓过敏的发生[32]。陈毅秋[18]发现给小鼠灌胃鼠李糖乳杆菌GG(LGG)后,LGG 在肠道定植的同时增强了B 细胞的活化,调节B 细胞分泌免疫球蛋白,显著提高了小鼠肠道黏膜sIgA 的分泌量,从而调节了小鼠黏膜免疫系统,以此提高了机体免疫水平。双歧杆菌能够刺激机体产生sIgA 的细胞增殖,从而使得sIgA 水平上升。Rigo-adrover 等[19]为探究哺乳期补充益生菌短双歧杆菌(Bifidobacterium brevis)M-16V 对肠道和免疫系统成熟的影响,自新生小鼠出生后的第6~18 d 对其补充益生菌并进行每日评估。结果发现短双歧杆菌M-16V 增强了小鼠肠道内IgA 的合成,促进了早期黏膜免疫的发展。通过饲喂小鼠益生菌(嗜酸乳杆菌和乳双歧杆菌),然后对小鼠免疫器官的重量、脾淋巴细胞的转化、脾细胞抗体的生成、肠黏膜sIgA 含量研究发现,摄入一定剂量的益生菌,可增强小鼠特异性及非特异性免疫功能[20]。
2.2.2 减少Th2 极化,保持Th1/Th2 平衡 当致敏蛋白质进入人体内后,引起过敏反应的程度与体内淋巴细胞的免疫调控密切相关。有研究证实婴幼儿牛乳蛋白过敏反应与不同亚型的T 细胞调节体系的失衡有关,早先发现Th2 占优势的Th1/Th2 细胞失衡是牛乳蛋白过敏的一个重要因素[33]。益生菌调节Th1/Th2 平衡过程(见图3)。益生菌可通过增进Th1 型免疫反应,调控因过敏而反应过度的Th2 型免疫反应,从而减缓过敏症状[34]。Fu 等[21]研究发现植物乳杆菌ZDY2013 和鼠李糖乳杆菌GG 口服可抑制过敏反应,其原因主要是通过诱导Th1 或调节性T 细胞分化抑制Th2 的反应,调节Th1/Th2 的免疫平衡;显著增加了紧密连接蛋白的相对表达,增强肠道屏障功能;调节过敏引起的肠道菌群的改变。Shandilya等[22]在乳清蛋白致敏小鼠后喂养选育后的嗜酸乳杆菌和双歧杆菌,发现益生菌组小鼠脾脏细胞培养上清中产生的Th1 特异性辅助因子增加(包括IFN-γ,IL-12 和IL-10),Th2 特异性细胞因子IL-4 下降,这表明益生菌的调节作用使血清中Th2 特异性免疫应答向Th1 倾斜,抑制了血清中IgE 的产生,从而减轻小鼠对乳清蛋白的过敏反应。这说明益生菌可通过上调Th1 细胞因子表达,下调Th2 细胞因子表达,来调节Th1/Th2 的免疫平衡来抑制过敏。

图3 益生菌调节Th1/Th2 平衡过程[35]Fig.3 Probiotics regulate the process of Th1/Th2 balance[35]
2.2.3 诱导Foxp3+Treg,保持Treg/Th17 的平衡近年来越来越多的研究表明Treg/Th17 的失衡也是导致过敏性疾病的关键因素之一。不同转录因子的转录水平决定了Treg/Th17 的平衡。Treg 细胞的Foxp3 的表达水平在维持肠道稳态,对抗过敏反应和抗原特异性Treg 的产生中发挥着至关重要的作用。在β-乳球蛋白(BLG)致敏小鼠模型中,补充副干酪乳杆菌L9 或长双歧杆菌BBMN68 可以刺激树突细胞(如CD11c+CD103+DCs)的表达和诱导T 细胞转换Foxp3+ Treg 进而抑制CMPA[23-24]。
Esber 等[17]研究表明,鼠李糖乳杆菌LA305,唾液乳杆菌LA307 和长双歧杆菌婴儿亚种LA308 三种益生菌诱导Treg 细胞,可能与肠道菌群产生免疫调节代谢产物,特别是乙酸、丙酸和丁酸有关[36],肠道微生物产生的主要代谢物是短链脂肪酸(SCFAs)[37]。SCFAs 通过诱导保护性的黏膜Treg 细胞反应和增强肠道屏障的完整性来抑制食物过敏[38]。研究表明SCFAs 通过作用于IECs 上的受体GPR43 和GPR109a,增强CD103+DCs 中视黄醛脱氢酶(retinal dehydrogenase,RALDH)的活性和增加抗原特异性Foxp3+Treg 细胞数目[39]。例如,SCFAs(如丁酸)可以通过识别DCs 上的GPR109a 受体促进Treg 细胞的产生(缺乏GPR109a 的小鼠的Treg 细胞数量则会降低),这表明在DCs 中SCFAs-GPR109a 轴在食物过敏原的免疫耐受中起着关键作用[40]。SCFAs 也可以直接调节T 细胞优先分化成Treg 细胞,其机制可能是由于SCFAs 通过识别GPR109a 或GPR43 来增加Foxp3位点的组蛋白H3 乙酰化[41-42]。在短链脂肪酸中,丁酸是维持肠道免疫稳态所必需的,并在免疫耐受中发挥关键作用,在过敏性疾病中具有强烈的抗炎作用。另外,丁酸盐参与了食物免疫耐受性的形成,特别是在婴儿出生后的头1000 d[43]。SCFA在预防过敏中的作用,发现丁酸盐水平最高的儿童对食物过敏原过敏的风险降低[44]。近来有研究表明,益生菌胞外多糖对过敏机体内T 细胞分化与树突状细胞活化也具有调节作用。益生菌胞外多糖介导T 细胞转化为Foxp3+Treg 细胞,通过分泌调节性细胞因子来逆转特异性Th2 偏倚的免疫反应[45]。
益生菌可以调节肠道菌群、提高肠道免疫,有利于维持肠道健康。直接食用益生菌制剂具有一定的风险且不易于人们接受。利用奶及奶制品作为益生菌的载体,进而开发低致敏性产品是食用益生菌的有效途径。
3 益生菌在低致敏性牛乳开发中的应用
3.1 配方奶粉
大多数患有CMPA 的儿童年龄小于1 岁,在没有母乳的情况下可能需要低过敏性配方奶粉[46]。而添加LGG 的以酪蛋白水解物为基础的婴儿配方奶粉可以刺激CMPA 患儿的免疫耐受,并减少CMPA的发生率[47]。为了消除牛乳蛋白的致敏性,理应开发最适合婴儿生长发育的低致敏性产品。
低致敏性产品的选择取决于两个主要因素,即营养充足性和过敏原性。采用益生菌降低配方奶粉的过敏原性是一种有效方法。Guest 等[48]选择940 位对广泛水解配方粉过敏的婴儿,通过临床试验进一步证明,喂养添加鼠李糖乳杆菌的水解配方粉,24 个月后,77%的婴儿患肠道疾病、湿疹和哮喘症状显著减轻[48]。Nocerino 等[49]也证明喂养添加鼠李糖乳杆菌水解配方粉的婴儿缩短了免疫耐受的获得时间[49],这可能是由于鼠李糖乳杆菌增强了肠上皮细胞的增殖分化、紧密连接蛋白的形成,从而减缓牛乳过敏患儿的过敏进程。然而,目前根据欧洲儿科胃肠病学和营养学会(ESPGHAN)评估,由于配方粉中所含益生菌的真正安全性尚未得到充分验证,还未应用到商业生产低致敏配方粉中,有待进一步对其安全性进行研究。
3.2 发酵乳制品
发酵是最古老的食品加工技术之一。发酵乳制品的特点是具有更好的消化率和降敏性[50]。最近研究表明,CMPA 儿童可以耐受酸奶,这表明发酵的牛奶也可以作为CMPA 患者的食品。益生菌发酵生产的酸奶中,乳清蛋白的过敏性显著降低,β-乳球蛋白的致敏性显著降低,酪蛋白的致敏特性也由于牛奶发酵的干酪乳杆菌而降低[51]。不同益生菌对乳蛋白抗原性的降低效率不同,这为开发用于CMPA 管理的新型发酵乳提供了可能性。Anggraini 等[52]研究保加利亚菌是降低水牛和山羊酪蛋白过敏原的最佳菌种。保加利亚嗜热链球菌感染12~18 h。发酵后,乳清过敏原在脱脂牛奶和乳清提取物中均有轻微降解。结果表明在各种酪蛋白源中山羊酪蛋白的致敏性显著降低。Biscola 等[53]研究巴西手工成熟奶酪,手工奶酪可以作为蛋白水解益生菌的来源,具有成为新型低过敏性乳制品的潜力。其中粪肠杆菌VB43对牛奶酪蛋白具有较好的水解活性,能够广泛水解αS1-CN、αS2-CN 和β-CN。Nath 等[54]研究用液态乳蛋白浓缩物(LMPC)经嗜热链球菌、保加利亚乳杆菌水解和胰蛋白酶酶解后制备具有低致敏性的生物活性肽。由于微生物水解,酪蛋白对抗体Rb 抗酪蛋白的抗原性降低。随着0.016 g·L-1胰蛋白酶处理LMPC经发酵后未见致敏性。
发酵是开发低致敏性产品有效的技术途径,它具有条件温和、工艺简单、可行性强的优势。因此,研究生产低致敏性产品既能保证过敏人群的安全食用,也为我国低致敏性产品的开发提供关键技术。
4 结语
益生菌通过调节肠道微生物,保持Th1/Th2 和Treg/Th17 的平衡进而预防或改善儿童牛乳蛋白过敏,达到对微生物-免疫轴的适当调整,因而成为近年来预防牛乳蛋白过敏的热点。目前对于肠道菌群调节牛乳蛋白过敏的机制以及益生菌缓解牛乳蛋白过敏的研究都处于初步阶段,深入探究益生菌调节肠道菌群、提高肠道免疫的途径;寻找益生菌作用于机体肠道内的靶点;利用复合益生菌的联合降敏作为缓解CMAP 有效手段,为进一步改善CMAP 提供了可能。探索高质量且易于人体肠道吸收的低过敏性乳制品是未来开发相关低致敏产品目标。
