克罗诺杆菌环境耐受性的评价
2022-12-06庞立冬宋丹靓敏梁雅琪苏群超郑亚平满朝新姜毓君
庞立冬,宋丹靓敏,贾 嫒,李 誉,梁雅琪,苏群超,郑亚平,李 然,满朝新,姜毓君
(东北农业大学食品学院乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
发病率高和影响范围广的食源性疾病极大地威胁了公共卫生和社会经济[1-3]。而食源性致病菌作为食源性疾病的主要因素之一受到了广泛关注[4]。克罗诺杆菌(Cronobacterspp.)作为一种重要的食源性致病菌,已经在多种食品中分离得到[5-7],其中,乳制品尤其是婴儿配方奶粉(powdered infant formulas,PIF)是其主要的污染源[8]。克罗诺杆菌能够引发早产儿、婴幼儿等患上严重的败血症、脑膜炎和坏死性小肠结肠炎[9-11],其致死率高达40%~80%[12-13],已被国际食品微生物标准委员会列为严重危害特定人群、导致慢性实质性后遗症甚至威胁生命的细菌[14]。
PIF 作为克罗诺杆菌的主要污染来源和传播途径[15],它的污染途径主要包括原辅料的添加和生产环境[16]。此外,克罗诺杆菌具有很强的环境耐受性[17-18],使其能够在PIF 加工环境和终产品中存在[19-20],造成持续污染,难以完全清除,严重威胁到PIF 的质量安全。曹晨阳等[21]报道了分离自婴幼儿乳粉和米粉的15 株不同基因型阪崎克罗诺杆菌对不同温度和pH 的耐受能力。BENNOUR 等[22]研究发现,克罗诺杆菌能够在干燥的婴儿配方奶粉中存活至少3 个月。YE 等[23]对比了阪崎克罗诺杆菌野生型和OmpW突变体在高渗条件下的存活率和形态变化。目前的研究多集中在不同基因型的克罗诺杆菌环境耐受性的研究上,缺乏对不同实际生产环节中分离的克罗诺杆菌环境耐受性的研究。为彻底有效地对克罗诺杆菌进行预防和控制,本实验以从PIF 样品及其加工环境中分离得到的8 株克罗诺杆菌作为代表菌株,研究了其环境的耐受性(耐热性、耐酸碱性、耐干燥性和耐高渗性)。本研究通过评价克罗诺杆菌的环境耐受性,为更好地控制和消除克罗诺杆菌污染提供参考依据,为保障乳制品安全提供新的思路。
1 材料与方法
1.1 材料与仪器
本实验所用克罗诺杆菌均分离自PIF 样品及其加工环境,共计8 株分离菌株。详细信息见表1。
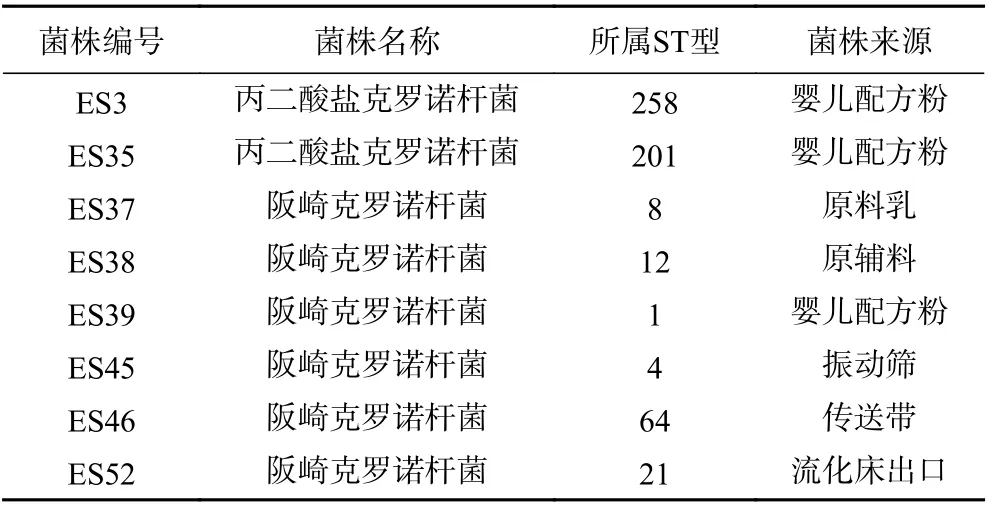
表1 实验用菌株及其来源Table 1 Bacterial strains used in this study and their sources
胰蛋白胨大豆琼脂培养基(tryptone soy agar,TSA)、LB 肉汤培养基(LB broth powder)、脑心浸液琼脂培养基(brain heart infusion, BHI) 青岛海博生物有限公司;山梨醇 阳腾化工产品有限公司;硅胶上海月杰实业有限公司;NaCl 西陇化工股份有限公司。
TGC-16G 型离心机 上海安亭科学仪器厂;DHP-9272 型电热恒温培养箱 上海一恒科技有限公司;DK-98-II 型电热恒温水浴锅 天津市泰斯特仪器有限公司;YM50L 型高压蒸汽灭菌锅 上海三申医疗器械有限公司;DU800 型紫外分光光度计 美国Beckman 公司;ME204E 型精密电子天平(0.0001 g)、PL2002 型电子天平、Delta320 型pH 计 梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 菌株活化 根据已发表研究并进行适当优化[24],将冻存的克罗诺杆菌接种于LB 液体培养基中,在37 ℃条件下200 r/min 培养12 h 进行活化,将活化后的菌株在TSA 固体培养基上进行三区划线,37 ℃培养24 h 后挑取单菌落,置于10 mL 液体LB 培养基中进行纯培养,连续传代2 次,待菌液浓度达到108CFU/mL 后,取1 mL 菌液在4 ℃下8000×g 离心10 min,用0.85%的灭菌生理盐水进行洗涤(4 ℃下8000×g 离心10 min),弃去上清液,该过程重复三次,最终向菌泥中加入1 mL 灭菌生理盐水,制成浓度为108CFU/mL 的菌悬液用于后续实验。
1.2.2 克罗诺杆菌环境耐受性研究
1.2.2.1 耐受高温能力的测定 菌株最适生产温度为37 ℃左右。根据已发表研究并进行适当优化[25],本试验取1.2.1 节所述的菌悬液用灭菌生理盐水10 倍梯度稀释至107CFU/mL,取10 mL 菌悬液分别置于53、57、61 和65 ℃的热水浴中,处理时间分别为1、2、3、5、8、10、20、30、60 min。经高温处理的菌液,冷却至室温后震荡摇匀,从每个处理后的试管中分别吸取100 μL 混合液均匀涂布TSA 平板,观察菌株生长情况。
1.2.2.2 耐受pH 能力的测定 菌株最适生长pH 为7.0 左右。根据已发表研究并进行适当优化[26],本试验取1 mL 1.2.1 节所述的菌悬液用pH 分别为1.0、1.5、2.0、12.0、12.5 和13.0 的灭菌生理盐水10 倍梯度稀释至107CFU/mL,将上述菌悬液分别在上述pH条件下处理0、30、60、90、120 s。经酸碱处理的菌液,震荡摇匀,从每个处理后的试管中分别吸取100 μL混合液均匀涂布TSA 平板,观察菌株生长情况。
1.2.2.3 耐受干燥能力的测定 根据已发表研究并进行适当优化[27],本试验将无水硅胶放入无菌的25 ℃恒温培养箱中进行干燥处理,待培养箱中的空气相对湿度为20.7%时,取50 μL 1.2.1 节所述的菌悬液于2 mL 无菌离心管中,每株菌分别分装20 个,将离心管盖打开,在培养箱中放置1.5 h 后,立即盖上离心管盖,并在培养箱中持续放置7 个月。经不同间隔时间干燥处理后,震荡摇匀,对菌悬液进行梯度稀释TSA 平板计数。
1.2.2.4 耐受高渗透压能力的测定 根据已发表研究并进行适当优化[28],本试验将各菌株冻存管从-20 ℃取出放入4 ℃冰箱中,完全解冻后,从冻存管中吸取50 μL 待测菌株的菌液分别加入到10 mL 无菌的NaCl 浓度分别为4%、6%、8%、10%的BHI 溶液和10 mL 无菌的山梨醇浓度分别为12.5%、19%、25%、31%的BHI 溶液中,放入37 ℃恒温培养箱中培养。经高渗透压处理后的菌液,震荡摇匀,每隔2 h 测定OD 值,持续24 h。
1.3 数据处理
每个试验重复三次,试验结果以平均值±标准偏差表示。用Microsoft Excel 对试验数据进行统计和分析,用SPSS 软件进行差异性分析,用Origin 软件绘图。
2 结果与分析
2.1 克罗诺杆菌在不同温度下的生长情况
8 株不同ST 型的克罗诺杆菌,分别以53、57、61 和65 ℃评价其耐热性,结果如表2 所示。PIF 的巴氏杀菌法通常为62~65 ℃,持续30 min[29]。因此,本实验设定了4 个温度(53、57、61 和65 ℃)进行耐热性分析。在53 ℃条件下,所有的菌株处理60 min时仍可存活;在57 ℃条件下,菌株ES3 和ES35 在20 min 时仍有存活,ES52 在10 min 时仍有存活,其他菌株在作用8 min 时全部失活;在61 ℃条件下,菌株ES3 和ES35 在5 min 时仍有存活,ES52 在3 min时仍有存活,其他菌株在作用3 min 时全部失活;在65 ℃条件下,所有菌株均在1 min 时全部失活。由此可见,升高处理温度和延长作用时间,所有菌株的活性都有所降低,其中克罗诺杆菌ES3 和ES35 表现出较强的耐热性,在61 ℃条件下5 min 时仍可存活,其次菌株ES52 的耐热性也较高。这可能是由于不同ST 型的菌株的基因表达不同,导致了菌株的耐热性不同[30]。
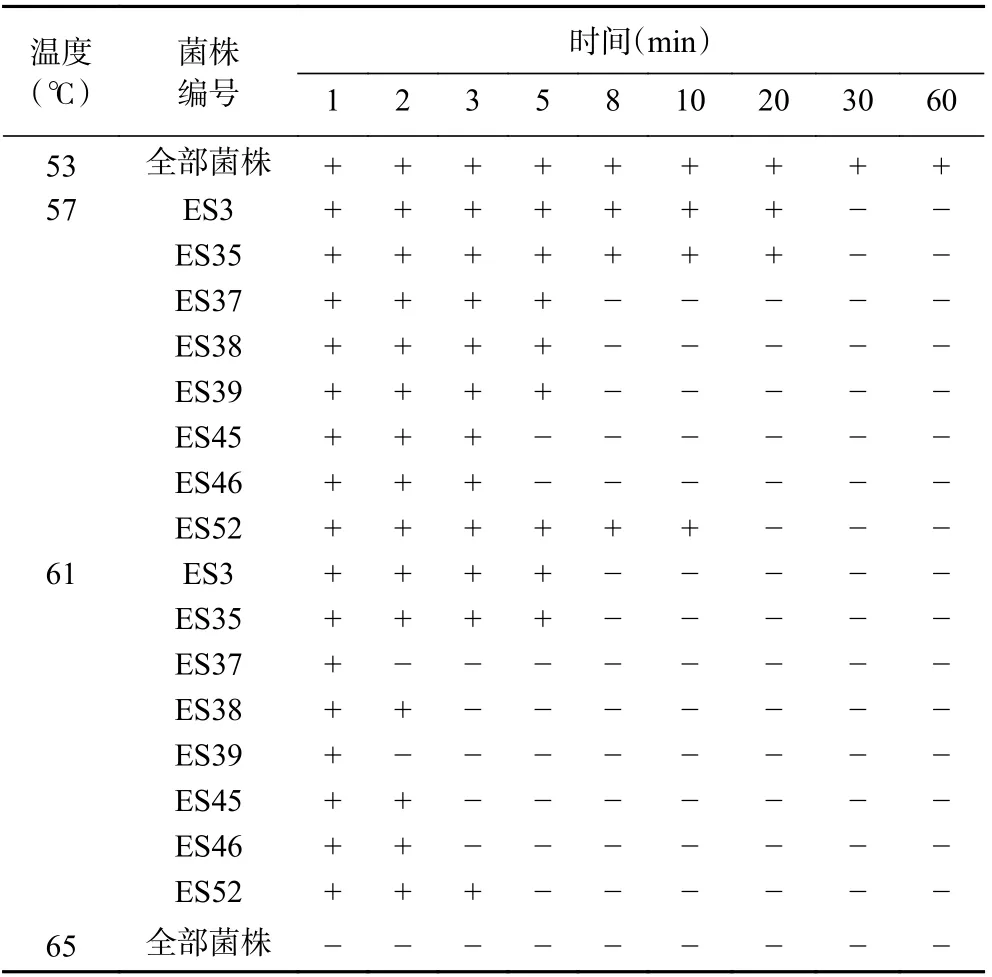
表2 克罗诺杆菌在不同温度下的生长情况Table 2 Growth of Cronobacter spp. at different temperatures
2.2 克罗诺杆菌在不同pH 下的生长情况
8 株不同ST 型的克罗诺杆菌,分别以不同pH进行酸碱处理,评价其耐酸碱性,结果如表3 所示。根据工厂的实际生产情况可知,一般采用酸洗和碱洗的方法对生产设备进行杀菌[31]。因此,本实验选取6 个pH 梯度(1.0、1.5、2.0、12.0、12.5 和13.0)进行耐酸碱性分析。在pH1.0 的酸性条件下,所有菌株均失活;在pH1.5 的酸性条件下,菌株ES3 在90 s时仍可存活,而ES35、ES37、ES39、ES52 在90 s 时失活,ES38、ES45、ES46 在60 s 时全部失活;在pH2.0的酸性条件下,ES3 在120 s 时仍可存活,ES46 在90 s 时失活,其余菌株在120 s 时全部失活。由此可见,克罗诺杆菌ES3 具有较强的耐酸性。在pH12.0的碱性条件下,只有ES38 在处理120 s 时仍可存活;在pH12.5 的碱性条件下,只有ES38、ES39 在处理30 s 时仍可存活;在pH13.0 的碱性条件下,除菌株ES38 外其余菌株立即死亡,由此可见,克罗诺杆菌ES38 具有较强的耐碱性。克罗诺杆菌对碱敏感的原因,可能是由于其属于革兰氏阴性杆菌,细胞壁中含有较多的脂类物质,而这类物质易与碱性溶液反应,致使细胞壁失去保护作用,最终造成菌体死亡。
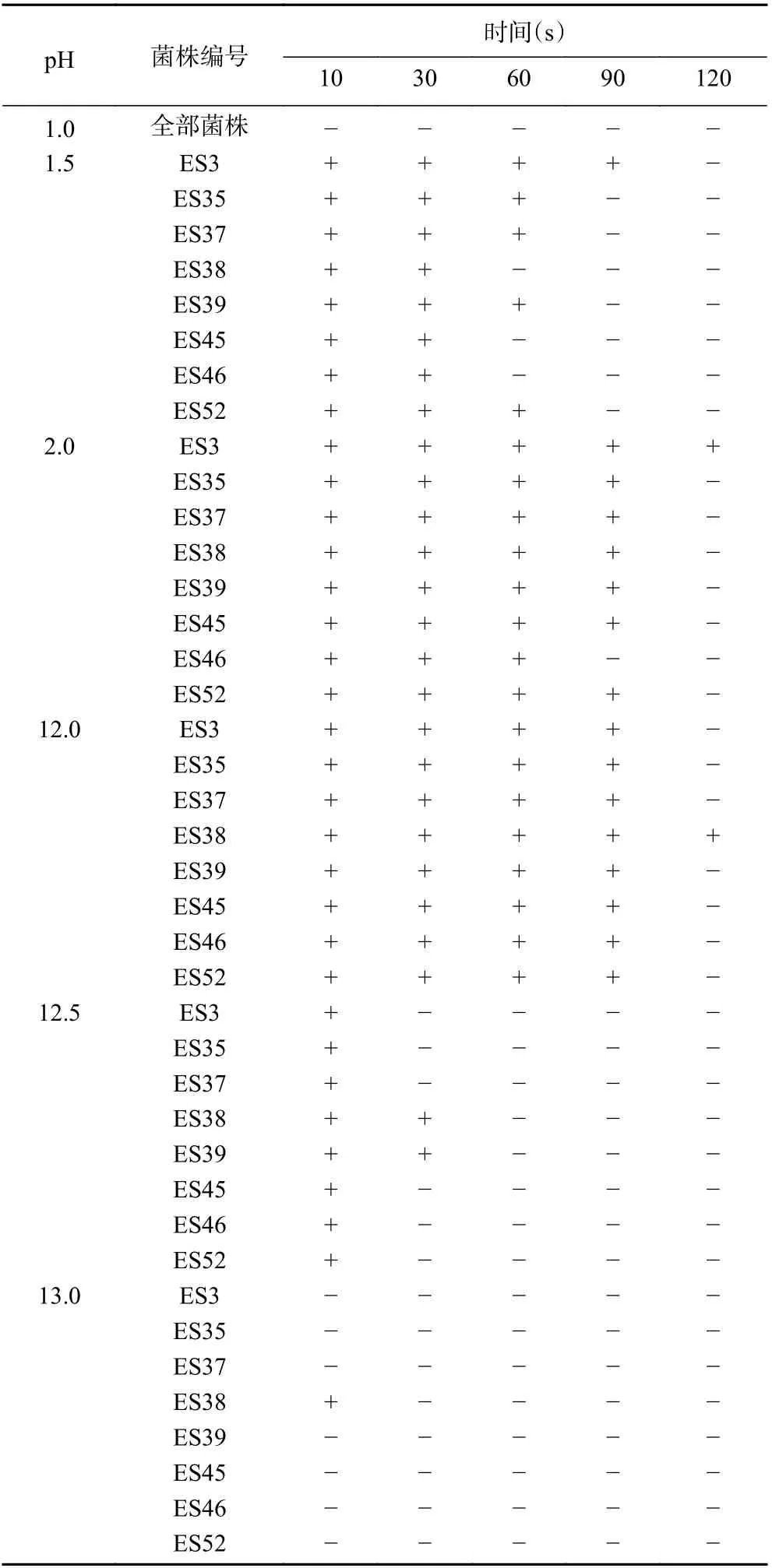
表3 克罗诺杆菌在不同pH 下的生长情况Table 3 Growth of Cronobacter spp. at different pH
2.3 克罗诺杆菌在干燥条件下的生长情况
对8 株不同ST 型的克罗诺杆菌进行干燥处理,评价其耐干燥性,结果如图1 和图2 所示。在长达7 个月的监测中,8 株菌的菌数都有不同程度地降低,但下降的趋势一直都趋于平缓,没有很大的波动。总体来看,8 株菌的菌数从初始浓度108CFU/mL 下降到105CFU/mL 左右,且在试验前期下降的趋势较为明显,在后期下降趋势趋于平缓。其中克罗诺杆菌ES37 具有相对较强的耐干燥性,而菌株ES3 的耐干燥性较弱。这种缓慢的下降趋势说明克罗诺杆菌具有很强的抵抗干燥环境的能力。这可能是由于生物膜和菌株所产生海藻糖对菌株的保护作用[32]。
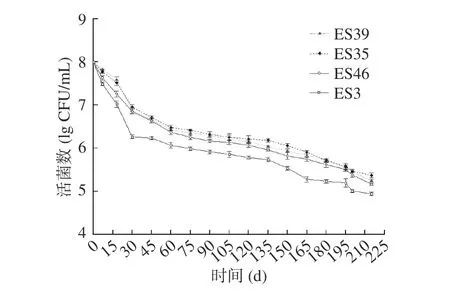
图1 ES3、ES46、ES35 和ES39 四株克罗诺杆菌在干燥条件下的活菌数Fig.1 Viable counts of four Cronobacter spp. ES3, ES46,ES35 and ES39 under dry conditions
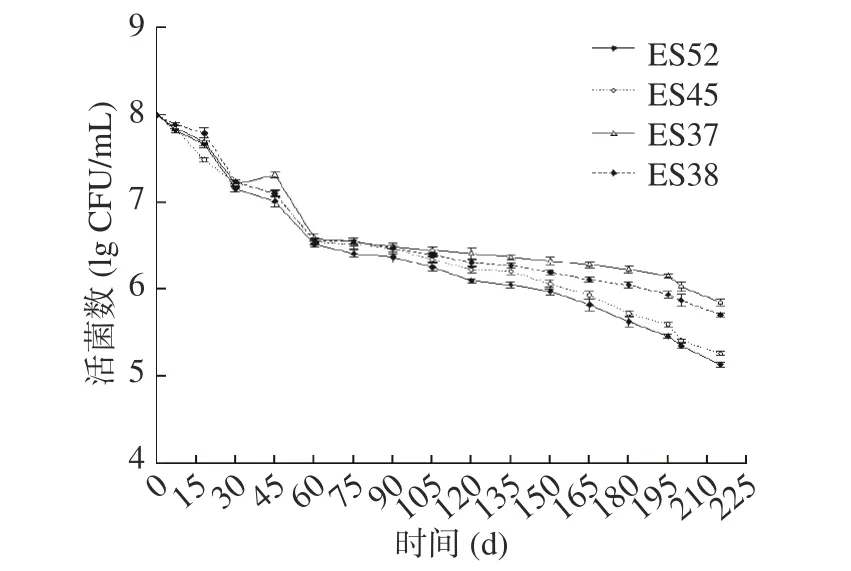
图2 ES52、ES45、ES37 和ES38 四株克罗诺杆菌在干燥条件下的活菌数Fig.2 Viable counts of four Cronobacter spp. ES52, ES45,ES37 and ES38 under dry conditions
2.4 克罗诺杆菌在高渗透压的条件下的生长情况
8 株不同ST 型的克罗诺杆菌,以不同浓度的NaCl 和山梨醇进行处理,评价其耐高渗性,NaCl 的试验结果如图3 所示。从图中可知,8 株不同ST 型的克罗诺杆菌在耐高渗性试验中呈现出相似的趋势,即随着NaCl 浓度的增大,与未添加NaCl 的空白对照组相比,实验组的OD600nm值逐渐下降,且当NaCl的浓度为8%和10%时,在24 h 内OD600nm值变化平缓,几乎呈直线趋势,说明菌体生长缓慢或阻滞。这可能是由于NaCl 属于强电解质,在溶液中很容易电离成Na+和Cl-,这就使得溶液的渗透压有所升高[18]。同时,山梨醇的渗透压与葡萄糖接近,是蔗糖的1.88 倍。通过测定克罗诺杆菌对山梨醇的耐受能力对控制PIF 中的克罗诺杆菌具有重要意义[33]。山梨醇的试验结果与NaCl 相似(未在文中体现),随着山梨醇浓度的升高,OD600nm值呈现梯度递减的趋势,但当山梨醇浓度达到最大值31%时,与10% NaCl组相比,在24 h 内OD600nm值仍有明显的上升趋势。而山梨醇属于非电解质,在溶液中不能电离,因此其作用效果没有NaCl 好[34]。所以等渗条件下,克罗诺杆菌对山梨醇的耐受性强于NaCl。对高渗透压的耐受能力则可能是因为糖被上的极性基团减少了克罗诺杆菌的水分流失以及海藻糖所形成的保护膜对克罗诺杆菌的保护作用。
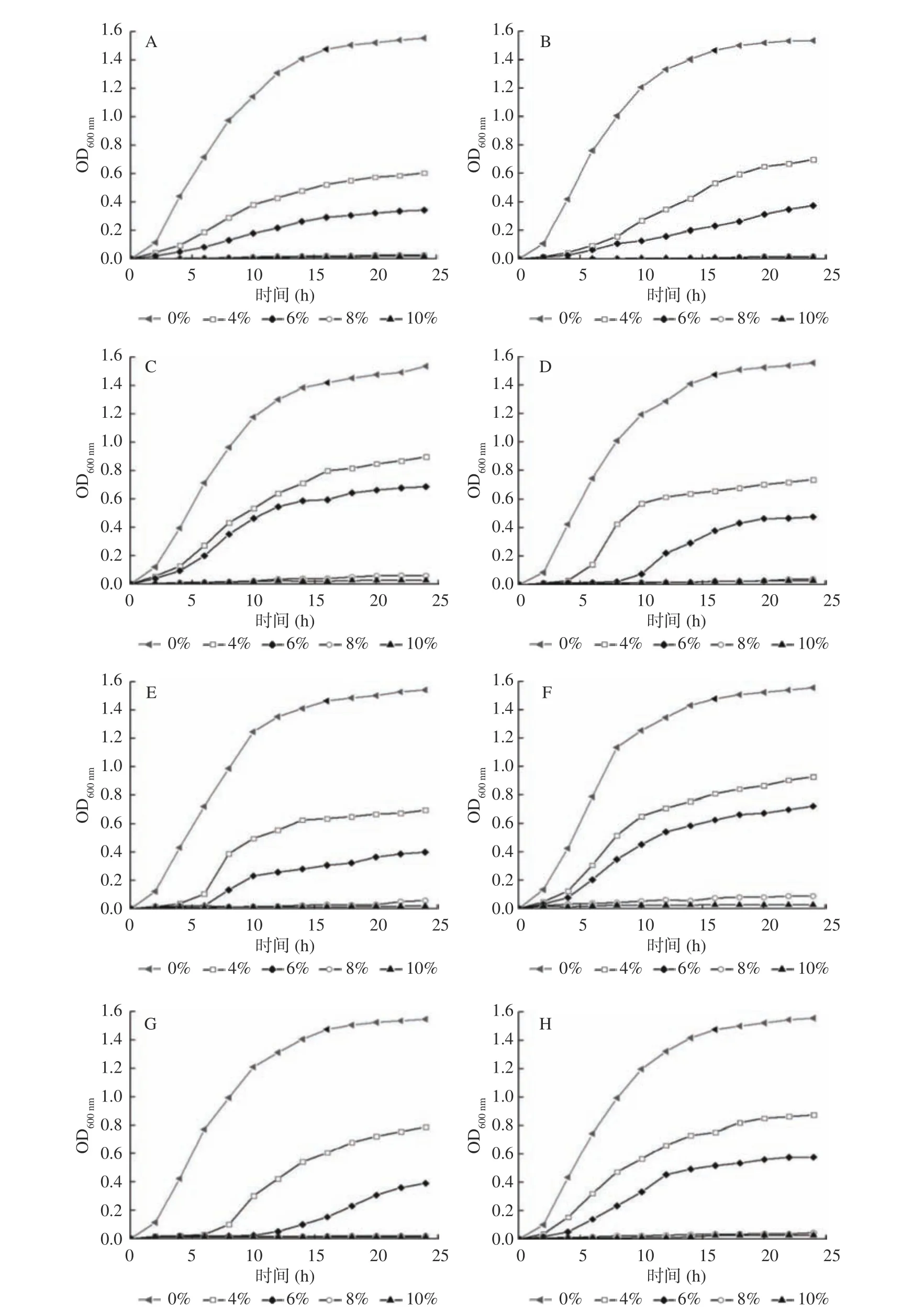
图3 克罗诺杆菌对不同浓度NaCl 的耐受性Fig.3 Resistance of Cronobacter spp. for different concentrations of NaCl
3 讨论与结论
本研究选取了从PIF 样品及其加工环境中分离得到的8 株ST 型克罗诺杆菌进行环境耐受性研究。由4 个温度的耐热性结果可知,ES3、ES35 和ES52 对高温具有较强耐热性。耐热菌株均分离自工厂的环境涂抹和终产品,且都是在经过巴氏杀菌后分离得到的,进一步说明这几株菌对高温具有较强的耐受性。根据以上结果可知,巴氏杀菌完全可以使克罗诺杆菌失活。克罗诺杆菌的污染可能是由于热处理过程中奶粉受热不均使得部分菌体得以存活或者是加工的后续过程中一些营养元素的添加引起的污染[35-36]。此外,奶粉的加工环境以及生产过程中的干燥和罐装阶段,以及暂存、输送和包装时的二次污染也不容忽视。因此,对奶粉加工工艺进行优化来使其受热均匀和对其加工环境进行全方位杀菌对于防止克罗诺杆菌污染十分重要。
本实验通过耐酸碱性结果可知,克罗诺杆菌具有耐酸不耐碱的特性。因此,可采用碱液对加工环境和生产设备进行清洗消毒,操作人员也应通过皂液洗手进行杀菌来保持手部的碱性环境,防止交叉污染[37]。此外,实验结果表明克罗诺杆菌具有较强的抗干燥能力,这也为其能在水分活度很低的奶粉中长期存活提供了事实证明和理论依据。所有分离株均能够在6% NaCl 中生长,但无法在8%及以上环境中生存,说明克罗诺杆菌对渗透压具有一定的耐受性,但高渗透环境能够抑制细菌的生长。同时,在等渗条件下,克罗诺杆菌对山梨醇的耐受性强于NaCl。
此外,为了保障食品安全,降低食品污染风险,一些更加高效、经济的杀菌方法也应该被进一步开发联合使用,例如,恒温射频技术[36]、高静水压技术[38]、脉冲电压技术[39]和冷等离子体技术[40]等。同时,采取一些有效的环境杀菌方法对防控克罗诺杆菌污染也是十分重要的[41]。
综上所述,克罗诺杆菌对环境具有较好的耐受性。其中,ES3、ES35 和ES52 对高温具有较强耐热性,在61 ℃条件下,菌株ES3 和ES35 在5 min 时仍有存活,ES52 在3 min 时仍有存活,其他菌株在作用3 min 时全部失活。所有菌株均具有耐酸不耐碱的特性,在pH1.0 的酸性条件下,所有菌株均失活,在pH1.5 的酸性条件下,所有菌株在处理120 s 时均可失活,在pH12.0、pH12.5 和pH13.0 处理一定时间时仍有部分菌株存活。所有菌株均具有较强的耐干燥性,在长达7 个月的监测中,8 株菌的活菌数的下降趋势一直都趋于平缓,没有很大的波动。所有菌株均具有较强的耐高渗性,当NaCl 的浓度低于8%时,对菌株生长的抑制较小。
