热处理和蛋白浓度对肌原纤维蛋白乳液的稳定性和流变特性的影响
2022-12-06毛书灿熊光权
郝 梦,毛书灿,周 志,汪 兰,熊光权,石 柳,*
(1.湖北民族大学生物科学与技术学院,湖北 恩施 445000;2.湖北省农业科学院农产品加工与核农技术研究所农业农村部农产品冷链物流技术重点实验室,湖北 武汉 430064)
乳液是由两种部分或完全不相溶的相经过均质剪切制备而成,按结构可分为水包油(O/W)和油包水(W/O)两种类型[1]。常见的水包油乳液中,小分子表面活性剂(连续相)吸附在油水界面形成界面膜,降低体系的界面张力、增加空间位阻和液滴之间的静电排斥,使乳液液滴的稳定性得到提升[1-2]。除了表面活性剂以外,具有部分湿润性的固体颗粒也可以稳定乳液[3]。与传统乳化剂相比,蛋白颗粒作为乳化剂能够在油水界面形成更厚的界面层,提高乳液的抗聚结性,从而使乳液更加稳定[4]。目前研究较多的食品级蛋白颗粒主要是乳清蛋白[5]、大豆分离蛋白[6]、酪蛋白[7]和明胶[8]等,鱼糜颗粒作为乳化剂的研究也逐渐增加。
肌原纤维蛋白是肌肉的主要蛋白,大约占肌肉总蛋白的50%~60%,主要由肌球蛋白、肌动蛋白、原肌球蛋白和其他小分子蛋白组成。另外,肌原纤维蛋白具有两亲性,是天然乳化剂,但其粒径较大,不易形成稳定的乳液,可以通过改性来提高其乳化性。肌原纤维蛋白的乳化性受温度、蛋白浓度、离子强度、pH 等因素的影响,其中,热处理会使肌原纤维蛋白的疏水性基团暴露,疏水性增加,形成聚集体。袁程程等[9]研究表明随温度(15~55 ℃)的升高虾蛄肌原纤维蛋白的乳化性提高,但温度过高会引起蛋白质分子变性,使乳化性降低。盖静[10]研究发现,在90 ℃时,鳙鱼肌球蛋白的变性和热聚集速度较快。康怀彬等[11]研究发现,高温处理(110、115、121 ℃)会改变牛肉肌原纤维蛋白质疏水区域的局部结构和蛋白质三级结构,使蛋白质发生降解聚集。另外,蛋白浓度对其乳化性也有影响,当肌原纤维蛋白浓度较低时,蛋白质不足以完全覆盖液滴表面;当蛋白浓度过高时,高粘度溶液不利于肌原纤维蛋白分子的流动,进而影响蛋白包裹脂肪滴,蛋白质易发生聚集导致乳液稳定性降低[12]。蛋白浓度是食品加工中的一项重要理化指标,蛋白浓度的不同会影响体系的凝胶特性和乳液稳定性等加工特性。热处理对不同浓度鱼糜肌原纤维蛋白的影响规律尚不清楚,因此开展热处理对不同浓度肌原纤维蛋白的规律研究很有必要。
本文通过研究热处理对肌原纤维蛋白结构和性质的影响,进一步研究对其乳化性的影响。为制备稳定的肌原纤维蛋白乳液提供理论基础。
1 材料与方法
1.1 材料与仪器
白鲢鱼糜 购于湖北省武汉市梁子湖水产品加工有限公司;大豆油(金龙鱼牌) 购于悦活里超市;盐酸、酒石酸钾钠、硫酸铜、磷酸氢二钠、磷酸二氢钠、氯化钾、氯化钠、95%乙醇、十二烷基硫酸钠等均为分析纯试剂 购于国药集团化学试剂有限公司;8-苯胺基-1-萘磺酸(ANS) 购于美国Sigma 公司;三羟甲基氨基甲烷(Tris) 购于广州赛国生物科技有限公司;牛血清蛋白(BSA) 购于深圳辉诺生物科技有限公司。
LE2002E/02 电子天平(0.01 g)、AL104 电子天平(0.0001 g)、FE20 pH 计 梅特勒-托利多仪器(上海)有限公司;FSH-2A 均质机 常州越新仪器制造有限公司;DF-101S 恒温加热磁力搅拌器 郑州长城科工贸有限公司;DYY-6C 电泳仪 北京六一生物科技有限公司;722N 分光光度计 上海仪电分析有限公司;ZS Nano 粒径电位分析仪 英国马尔文仪器有限公司;CR-400/410 色彩色差仪 美能达(中国)投资有限公司;Nicolet iS 50 傅里叶变换红外光谱仪 美国热电;AR2000ex 型流变仪 美国TA 仪器有限公司。
1.2 实验方法
1.2.1 肌原纤维蛋白的提取 白鲢鱼糜肌原纤维蛋白的提取参考Li 等[13]的方法并稍作修改。取适量冷冻鱼糜切碎,加入3 倍体积4 ℃的0.2 mol/L Tris-HCl (pH7.0,含0.6 mol/L KCl),6000 r/min 均质3 min,然后于4 ℃浸提60 min,去除匀浆中明显的筋膜等杂质。低温离心(9000 r/min,10 min,4 ℃),所得上清液即为实验用肌原纤维蛋白原液。放入4 ℃冰箱备用。
1.2.2 肌原纤维蛋白浓度的测定 用双缩脲法测定肌原纤维蛋白的浓度[14]。以牛血清蛋白为标准,于540 nm 处进行比色测定,绘制标准曲线(y=0.0456x+0.0954,R2=0.9989)。经测定,肌原纤维蛋白原液的蛋白浓度范围为30~35 mg/mL。
1.2.3 肌原纤维蛋白乳液的制备 采用Tris-HCl(pH7.0,含0.6 mol/L KCl) 调整上述1.2.1 制备的肌原纤维蛋白原液的蛋白浓度分别为5、10、15、20和25 mg/mL,在80 ℃下磁力搅拌加热10 min 后立即用冰水浴冷却,再高速均质3 min (10000 r/min)得到肌原纤维蛋白溶液。未加热组(myofibrillar protein,MP)标记为MP 组,加热组(myofibrillar protein Aggregate,MPA)标记为MPA 组。控制乳液中大豆油的质量分数分别为50%、60%、70%、80%,然后高速均质10 min(10000 r/min)制备肌原纤维蛋白乳液。除加热过程外,所有制备过程均在10 ℃以下进行。
1.2.4 肌原纤维蛋白溶液的SDS-PAGE 凝胶电泳参考朱萌等[15]的方法,调节溶液中蛋白浓度至1.5 mg/mL,取100 μL 样品加入50 μL 的上样缓冲液,采用5%的浓缩胶和12%的分离胶进行电泳,上样量为10 μL,样品在浓缩胶内电压恒定为80 V,进入分离胶后电压调为120 V,待蓝色条带距离分离胶底部3~5 mm 处时停止电泳。取出胶片采用0.125%R-250 考马斯亮蓝进行染色2 h,然后用50%甲醇和10%冰乙酸脱色至条带清晰无明显背景色。
1.2.5 蛋白质聚集比例的测定 取10 mL MPA 组蛋白溶液于15 mL 离心管中,室温下低速离心10 min(3000 r/min),用双缩脲法测定上清液中的蛋白浓度。

1.2.6 肌原纤维蛋白溶液粒径和电位的测定 粒径和电位的测定参照Zhang 等[16]的方法加以修改。采用Tris-HCl (pH7.0,含0.6 mol/L KCl) 将MP 和MPA 组蛋白溶液的浓度均稀释至5 mg/mL 后,使用Zeta sizer 仪器(λ=633 nm,25 ℃)测定蛋白溶液的粒径(D(4,3))及电位。
1.2.7 粘度测定 参考Diao 等[17]的方法加以修改。采用AR200ex 型流变仪测定蛋白溶液及乳液的表观粘度。选择直径40 mm、2°的椎板,板间距为1000 μm,实验在室温下进行,剪切速率为0.01~100 s-1,记录各剪切速率下的粘度值绘制相应的粘度曲线。
1.2.8 乳液外观观察 将制备的肌原纤维蛋白乳液装入玻璃瓶或离心管中,在4 ℃冰箱贮藏24 h 后对其进行外观观察。
1.2.9 光学显微镜观察 参考朱雪峰[18]的方法加以修改。使用1%(w/v)的罗丹明B 对MP 和MPA 组肌原纤维蛋白乳液进行染色,1 mL 样品加入染料50 μL,充分混合均匀后置于光学显微镜下观察,放大倍数为100 倍。
1.2.10 乳液色度的测定 参考胡亚芹等[19]的方法,用色度仪测定并记录L*(明亮度)、a*(红绿偏差)和b*(黄蓝偏差)值。
1.2.11 傅里叶红外光谱测定 参照朱明华等[20]的方法,分别取不同浓度的MP 组和MPA 组制备的乳液冻干后的粉末1 mg,按1:100 的比例加入溴化钾,研磨5 min 使粉末混合均匀后,压片,放入傅里叶变换红外光谱仪中进行分析,波数范围:500~4000 cm-1,分辨率:4 cm-1,样品和背景扫描次数:32 次。
1.3 数据处理
采用SPSS 26 对数据进行显著性及相关分析,采用GraphPad Prism 制图,采用OMNIC 和Origin 2017 软件对红外图谱数据进行处理和拟合分析。图表中误差均为标准误差,所有试验均进行3 次重复。
2 结果与分析
2.1 肌原纤维蛋白溶液性质的表征
2.1.1 肌原纤维蛋白溶液的 SDS-PAGE 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)可以探明肌原纤维蛋白溶液的蛋白质组成情况,如图1 所示。MP 组和MPA 组的蛋白质组成主要有肌球蛋白重链(MHC)和肌动蛋白(AC)。其中,不同蛋白浓度下的MP 组和经过加热处理的MPA 组蛋白溶液的主要蛋白成分并未发生变化,但对比MP 组的条带与MPA 组的条带发现,热处理后肌动蛋白和其他小分子蛋白条带强度减弱,肌球蛋白条带强度增强。由此可以说明热处理对蛋白质共价键及非共价键的共同影响,使得肌原纤维蛋白变性伸展,进而参与了蛋白质聚集的形成[21],使肌球蛋白和肌动蛋白和其他小分子蛋白构象发生一定程度的变化,但不同浓度之间的差异较小。
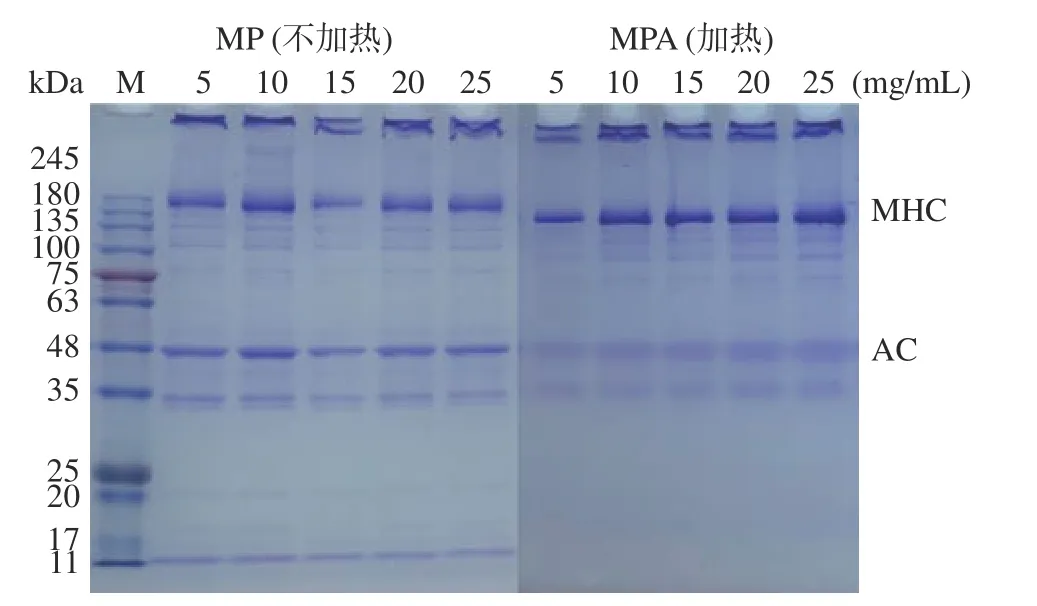
图1 不同浓度下的MP 组和MPA 组肌原纤维蛋白溶液的SDS-PAGE 凝胶电泳Fig.1 SDS-PAGE gel electrophoresis of myofibrillar protein solution in MP and MPA groups at different concentrations
2.1.2 蛋白质聚集比例 蛋白质在加热时会发生聚集,分子结构发生改变,进而影响其功能特性[22]。通过测定MPA 组肌原纤维蛋白溶液的聚集情况(如图2),发现蛋白浓度为5~25 mg/mL 时,蛋白质聚集比例分布在45%~60%。随蛋白质浓度的增加,加热过程中更多的蛋白质参与聚集,与丁群文等[23]的研究结果一致。和5 mg/mL 的MPA 组相比,当蛋白质浓度升高为25 mg/mL 时,聚集比例增加了33.3%,可能会导致乳化性能降低[24]。当蛋白浓度为15 和20 mg/mL时MPA 组蛋白溶液的聚集比例无显著差异(P>0.05)。

图2 不同蛋白浓度下热处理后的MPA 组蛋白聚集比例Fig.2 Protein aggregation ratio of MPA group after heat treatment at different protein concentrations
2.1.3 粒径分布 蛋白颗粒的粒径和分布对其功能性有重要影响[25]。由表1 可知,未经加热处理的MP 组肌原纤维蛋白溶液平均粒径范围约为92~181 μm,且蛋白浓度为10 mg/mL 时平均粒径最小(92.7 μm),浓度为15 mg/mL 时最大(181.7 μm)。加热处理后导致蛋白质发生聚集,肌原纤维蛋白溶液的平均粒径增大(166~238 μm),当浓度为25 mg/mL时平均粒径最小(166.1 μm),浓度为5 mg/mL 时平均粒径最大(238.3 μm)。由图3 可知,MP 组粒径呈双峰分布,1000 μm 左右出现的小峰可能是少部分蛋白发生自聚集。MPA 组蛋白溶液的粒径分布较MP 组向右偏移且主要为单峰分布,表明肌原纤维蛋白形成了较均一的热诱导聚集颗粒,平均粒径增大,与朱雪峰[18]的研究一致。

表1 不同浓度下MP 组和MPA 组肌原纤维蛋白溶液的平均粒径(D(4,3))Table 1 Average particle size of myofibrillar protein solution in MP group and MPA group at different concentrations (D(4,3))

图3 热处理对肌原纤维蛋白溶液粒径分布的影响Fig.3 Effect of heat treatment on particle size distribution of myofibrillar protein solution注:A:MP,未加热组;B:MPA,加热组。
2.1.4 肌原纤维蛋白溶液的Zeta 电位 Zeta 电位主要反映蛋白颗粒表面的电荷情况。如图4 所示,未经加热处理的MP 组蛋白溶液的表面电荷范围约为-12~-16 mV,电位值随着浓度的增加而显著增加(P<0.05)。热处理后的MPA 组电位值范围约为-10~-20 mV,整体呈上升趋势。15 mg/mL 时电位值最低(-10 mV),25 mg/mL 时电位值最高(-20 mV)。在5~20 mg/mL 浓度时,热处理后的MPA 组Zeta电位对比MP 组有轻微的减小,但25 mg/mL 时MPA 电位值大于MP,这可能是因为在低浓度时蛋白表面的带电氨基酸随着蛋白结构的改变而发生内卷,使蛋白颗粒表面静电荷减少;但在高蛋白浓度时,由于肌原纤维蛋白颗粒数量的增加使得氨基酸的内卷效应可以忽略[18,26]。

图4 热处理对肌原纤维蛋白溶液电位的影响Fig.4 Effect of heat treatment on myofibrillar protein solution potential
2.1.5 肌原纤维蛋白溶液粘度 粘度是蛋白质较为重要的特性之一,在一定程度上反应蛋白质的理化性质和结构的变化[27]。图5 是MP 组和MPA 组肌原纤维蛋白溶液的粘度随剪切速率0.01~100 s-1的变化曲线。随着剪切速率的增大,所有溶液的表观粘度都减小最后接近0,呈现剪切稀变性质,属于非牛顿流体[28]。MP 组的零剪切粘度范围为1~650 Pa·s,MPA组的零剪切粘度范围约为0.01~3.5 Pa·s,加热处理使肌原纤维蛋白溶液的零剪切粘度降低。一般情况下,加热可以使蛋白质之间的疏水相互作用增加,使蛋白质聚集,蛋白质分子之间的引力大于静电斥力,因而粘度随温度升高而增大。而过高的温度抑制/破坏了非共价键(氢键、疏水作用和静电引力)和共价键(二硫键)的形成,降低了疏水相互作用,使蛋白质间静电斥力逐渐大于引力,引起粘度的降低[29]。在剪切速率为0.01 s-1时,除20 和25 mg/mL 的MPA 组蛋白外,表观粘度随浓度的增加而增加,可能是因为随浓度的增加会有更多的蛋白颗粒吸附在界面上,有利于分子之间的相互作用[30]。

图5 热处理对MP(A)和MPA 组(B)肌原纤维蛋白溶液粘度的影响Fig.5 Effect of heat treatment on myofibrillar protein solution viscosity in MP (A) and MPA groups (B)
2.2 肌原纤维蛋白乳液性质的表征
2.2.1 油相比的确定 油相比是影响乳液液滴大小和分层稳定性的一个重要因素。不同蛋白浓度和油相比的肌原纤维蛋白乳液静置24 h 后的情况如图6 所示。当油相比为0.7 和0.8 时,均不能形成较为稳定的乳液,可能是油含量太高,蛋白不足以覆盖所有液滴表面,因而不能形成稳定的乳液[30]。在油相比为0.5 时,蛋白浓度为20 和25 mg/mL 时的MP组乳液能够形成稳定的乳化凝胶。在油相比为0.6时,蛋白浓度为10 和15 mg/mL 的MP 组乳液及蛋白浓度为10~25 mg/mL 的MPA 组乳液均能形成较为稳定的乳液。因此,本实验选取油相比0.6 进行后续研究。

图6 不同浓度和油相比的MP 组乳液(A)和MPA 组乳液(B)24 h 静置情况Fig.6 Emulsion of MP group (A) and MPA group (B) standing for 24 h with different concentrations and oil
2.2.2 乳液外观观察 MP 组和MPA 组肌原纤维蛋白乳液在0 和24 h 的外观变化如图7 所示。不同蛋白浓度下的MP 组和MPA 组新鲜乳液均呈现均一的状态。在4 ℃冰箱放置24 h 后,5 和25 mg/mL 的MP 组乳液及5 mg/mL 的MPA 乳液出现分层,上层为油相和水相,下层出现絮凝,其余乳液均保持稳定。这是因为浓度较低时蛋白质不足以覆盖油水界面[30],而蛋白质浓度过高时,高粘度溶液不利于肌原纤维蛋白分子的流动,易发生聚集稳定性降低[12]。

图7 肌原纤维蛋白乳液0 和24 h(4 ℃放置)放置正拍图Fig.7 Positive pictures of myofibrillar protein emulsion at 0 and 24 h (placed at 4 ℃)
2.2.3 光学显微镜观察 图8 是MP 和MPA 组肌原纤维蛋白乳液的光学显微镜图。由图中可知,当蛋白浓度为5 mg/mL 时,MP 和MPA 乳液中参与乳化的油滴最少,这可能是由于低蛋白浓度时不足以将游离的油滴包裹形成稳定的乳液[30]。当蛋白浓度为10~25 mg/mL 时,随着肌原纤维蛋白浓度的增加,油滴粒径减小,且油滴聚结程度增大,与朱雪峰[18]的研究结果一致。这可能是由于蛋白质浓度的增加,能够参与乳化的蛋白质逐渐增加,另外,肌原纤维蛋白表面净电荷增加(图4),进而形成均匀而稳定的乳液液滴。与MP 蛋白乳液相比,在低浓度时,MPA 蛋白乳液中游离的脂肪较少;在高浓度时,MPA 肌原纤维蛋白乳液中油滴更加分散,展现出更好的乳化的稳定性。
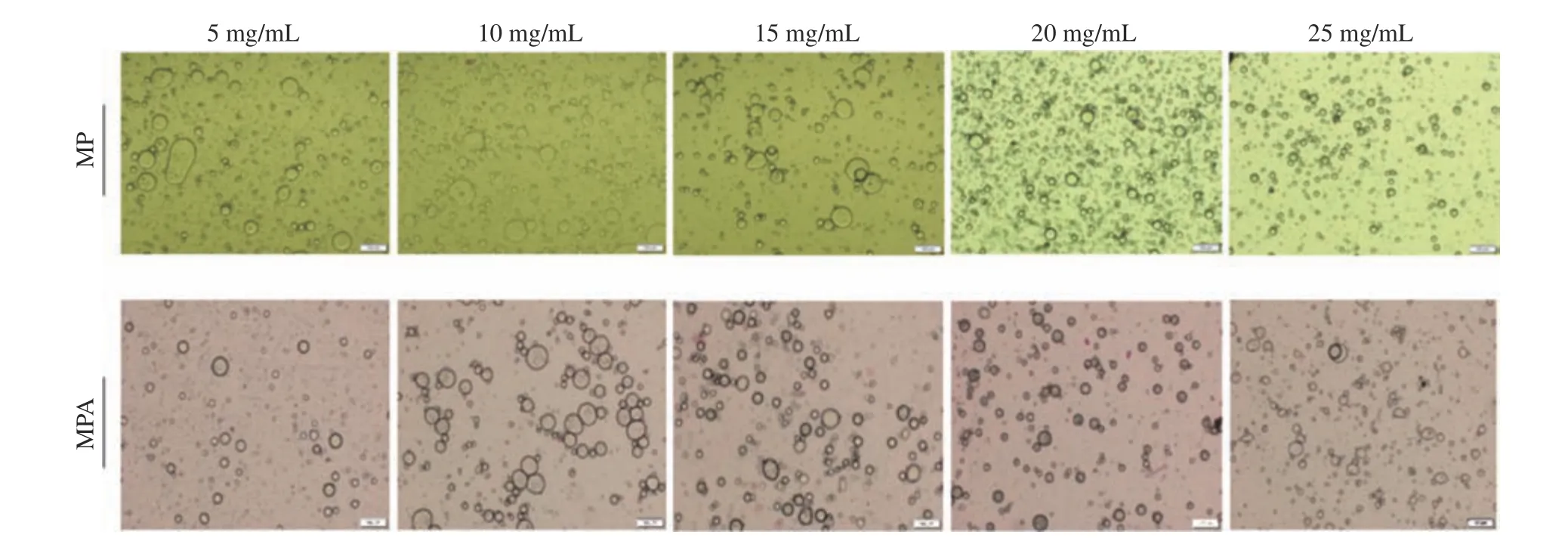
图8 热处理对MP 和MPA 组乳液微观形貌的影响Fig.8 Influence of heat treatment on micromorphology of emulsion in MP and MPA groups
2.2.4 乳液色度 乳液色度能够表征油滴参与乳化的程度。如表2 所示,随浓度的增加,MP 组乳液的L*和b*值呈现先升后降的趋势。经过加热处理的MPA 组乳液L*和b*值随着浓度的升高而增加。与MP 乳液相比,MPA 乳液的L*和b*稍有增加,可能是因为乳化的油脂更多。另外。5 mg/mL 和25 mg/mL的MP 乳液,5 mg/mL 的MPA 乳液的L*值显著低于其他组别(P<0.05),可能与其不能形成稳定的乳液相关,与图7 的结果一致。
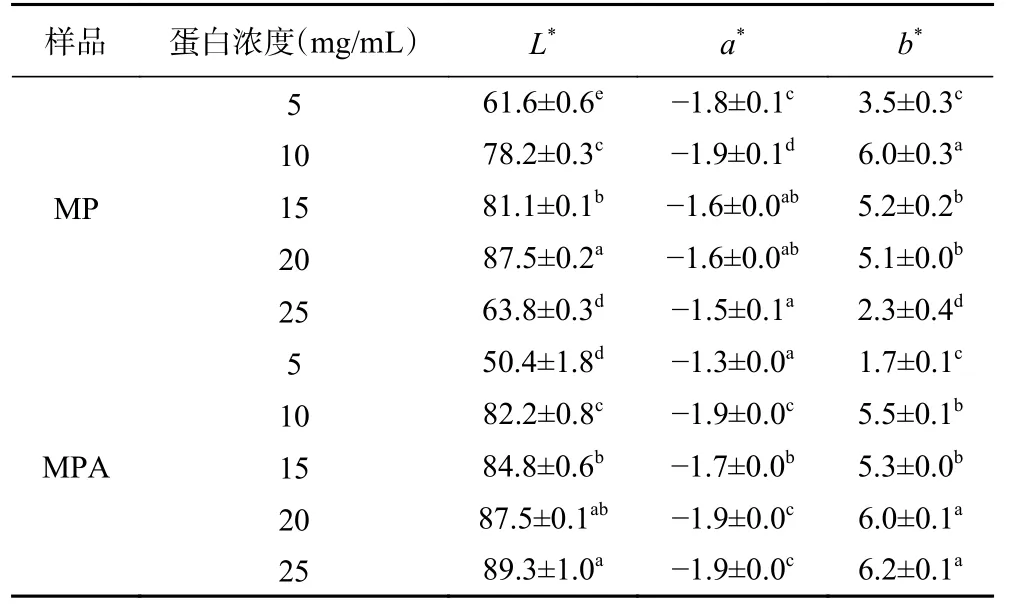
表2 热处理对MP 和MPA 组乳液色度的影响Table 2 Effect of heat treatment on chromaticity of emulsion in MP and MPA groups
2.2.5 傅里叶红外光谱 采用傅里叶变换红外光谱仪观察制备的肌原纤维蛋白乳液的分子结构。肌原纤维蛋白在3500~3250 cm-1左右的吸收峰归属为O-H 伸缩振动、N-H 伸缩振动以及结合水中的OH 基团与氨基酸中的C=O 所形成的分子内和分子间氢键;1639 cm-1处归属为酰胺Ⅰ带C=O 对称伸缩振动特征峰,与氢键作用力密切相关;1550 cm-1处归属为酰胺Ⅱ带N-H 弯曲振动与C-H 伸缩振动特征吸收峰;1078 cm-1左右的吸收峰主要是C-O 键、C-N-C 键的伸缩振动峰[31]。如图9 所示,当浓度为5 和15 mg/mL 时,MP 组乳液的官能团的吸收峰和强度没有发生明显变化,当浓度升高为25 mg/mL时,所有特征吸收峰均向左偏移且强度减弱,说明浓度增加后蛋白质的自聚集程度增加,肌原纤维蛋白乳液的稳定性减弱。经过加热处理后的MPA 组乳液结构随浓度的变化与MP 乳液基本相似。另外,与MP 乳液相比, MPA 乳液各吸收峰的强度明显减弱,表明蛋白质发生变性,部分蛋白发生一定的分解。特别是O-H 吸收峰,表明热处理改变肌原纤维蛋白乳液的疏水性。

图9 MP(A)和MPA 组(B)乳液的红外光谱图Fig.9 Infrared spectrogram of MP (A) and MPA (B) emulsion groups
2.2.6 肌原纤维蛋白乳液的粘度 图10 是不同浓度条件下MP 组和MPA 组肌原纤维蛋白乳液粘度随剪切速率0.01~100 s-1的变化曲线。与图5 趋势一致,随着剪切速率的增大,所有乳液的表观粘度都减小最后接近0,剪切变稀现象与含聚集颗粒的胶体分散体的流变学性质一样[32]。在相同的剪切速率下,蛋白质的浓度越高,乳液体系中用于稳定油水界面的蛋白质越多,乳液的粘度越大,蛋白质之间的作用力增强[33]。加热处理后的肌原纤维蛋白乳液的零剪切粘度相对MP 组显著降低,可能是因为热处理降低了疏水相互作用,破坏了共价键和非共价键的形成。
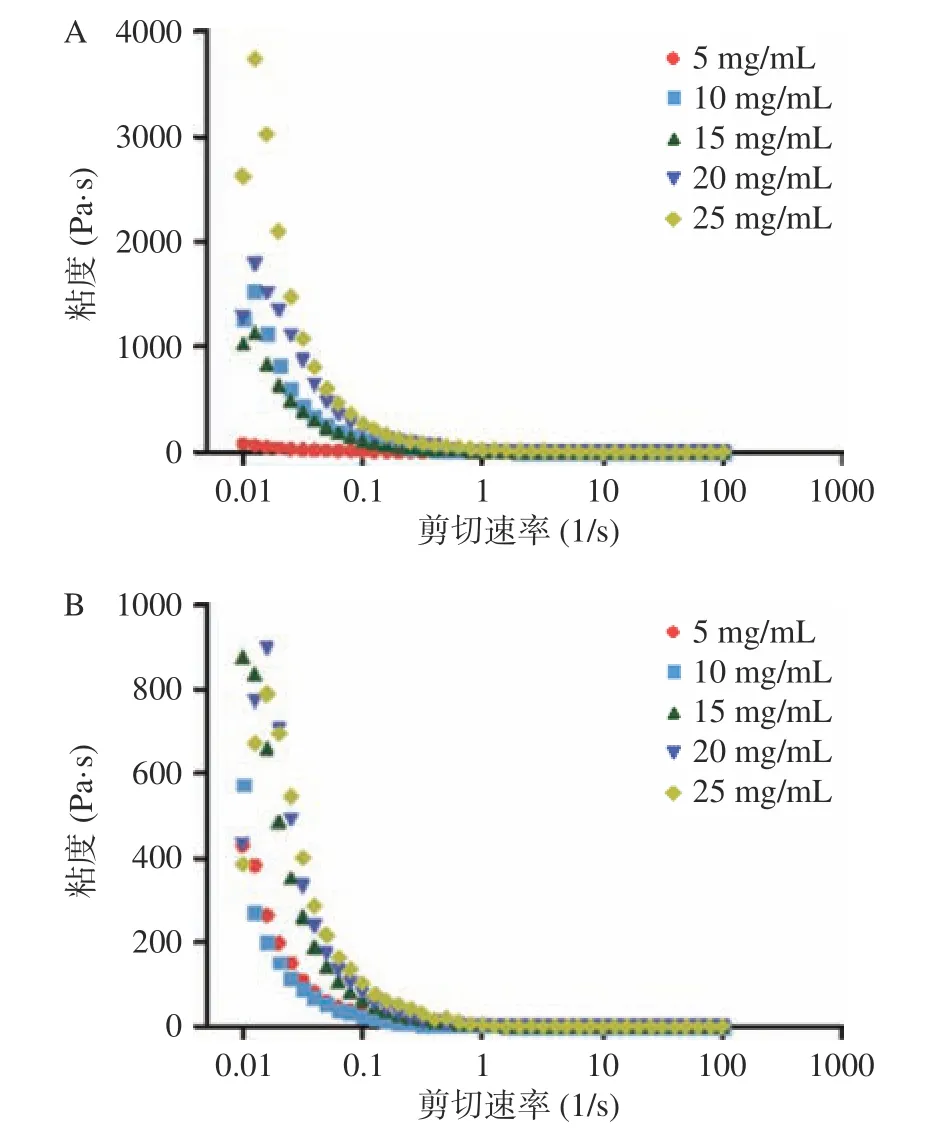
图10 MP(A)和MPA 组(B)肌原纤维蛋白乳液粘度随剪切速率的变化曲线Fig.10 Myofibrillar protein emulsion viscosity curve with shear rate in MP (A) and MPA groups (B)
3 结论
肌原纤维蛋白的性质受蛋白浓度和热处理的影响。随肌原纤维蛋白浓度的增加,MP 组MPA 组肌原纤维蛋白溶液的表观粘度增大,粒径和电位呈波动变化,MP 组10 mg/mL 时粒径最小(92.7 μm),15 mg/mL 时粒径最大(181.7 μm);MPA 组5 mg/mL时粒径最大(238.3 μm),25 mg/mL 时粒径最小(166.1 μm);肌原纤维蛋白乳液的表观粘度和自聚集程度增加。在4 ℃放置24 h 后,除5 和25 mg/mL的MP 组肌原纤维蛋白乳液及5 mg/mL 的MPA 组肌原纤维蛋白乳液外,其余乳液均能保持稳定。热处理使肌原纤维蛋白溶液发生聚集,粒径增大,表观粘度降低;乳液的L*值增大,表观粘度降低,亲水性减弱,乳液稳定的浓度范围增大。油相比为0.6 时,热处理使浓度为10~20 mg/mL 的肌原纤维蛋白的乳化性能和乳液稳定性提高。本研究可为制备稳定的肌原纤维蛋白乳液提供理论基础。
