重楼正丁醇部位指纹图谱与体外抗氧化作用的谱-效关系研究
2022-12-05王学芹顾从文韩燕全
卜 超,洪 燕,王学芹,顾从文,张 伟,韩燕全*
(1.安徽中医药大学第一附属医院 国家中医药管理局中药制剂三级实验室/中药复方安徽省重点实验室/现代药物制剂安徽省工程技术中心,安徽 合肥 230012;2.安徽中医药大学 药学院,安徽 合肥 230031)
重楼是我国传统的名贵中药材,为百合科植物云南重楼Paris polyphyllaSmith var.yunnanensis(Franch.)Hand.-Mazz.或七叶一枝花Paris polyphyllaSmith var.chinensis(Franch.)Hara的 干 燥 根 茎[1],《本草纲目》中曾对其记载:“蛇虫之毒,得此治之即休”[2]。重楼除了治疗蛇虫之毒屡见其效,还具有清热解毒、止血镇痛、抗肿瘤、抗氧化等作用[3-6]。现代研究发现甾体皂苷类是重楼的主要活性成分[7],分别为异螺甾烷醇类(isospirostanol)、螺甾烷醇类(spirostanol)、呋甾烷醇类(furostanol)和变形螺甾烷醇类(pseudospirostanol),具有抗肿瘤、抗菌消炎、止血消肿、抗氧化、保肝等功效。科学研究表明,癌症、衰老或其它疾病大多与过量自由基的产生有关联,所以对抗氧化的研究可以有效克服其所带来的危害。课题组前期研究表明重楼总皂苷部位具有较好的抗肝纤维化动物的氧化应激作用,但是其具体抗氧化的成分尚不清楚[8]。
谱-效关系是通过统计分析方法将指纹图谱与药效学关联起来,能够明确具有药效作用的物质基础[9-10],其广泛应用于中药材、复方制剂的质量和药效评价。目前对于重楼的药效研究主要集中在抗肿瘤、止血等方面,文献研究表明重楼总皂苷部位具有较明确的抗氧化活性[11],但具体与哪些成分相关,研究还较少。基于此,本研究采用正丁醇萃取法得到重楼正丁醇部位,测定出总皂苷含量,同时,建立重楼正丁醇部位的UPLC指纹图谱;采用DPPH法和ABTS法测定其抗氧化活性,通过皮尔逊相关分析法和逐步回归分析法研究其谱-效关系,以期为进一步阐明重楼正丁醇部位的皂苷类成分抗氧化活性的物质基础和重楼皂苷质量评价标准提供参考。
1 仪器与试药
1.1 仪器
Waters Acquity H-Class型超高效液相色谱仪(美国Waters公司);ME55型分析天平[梅特勒-托利(上海)有限公司];1510-02261C 型酶标仪(美国Thermo Fisher Scientific公司);KQ3200DB型超声仪(昆山市超声仪器有限公司);GL-88B型涡旋混合器(其林贝尔仪器制造公司);KDC-16H型离心机(科大创新股份有限公司);BZF-6050型真空干燥箱(上海博讯实业有限公司);17070063型旋转蒸发仪(郑州长城科工贸有限公司)。
1.2 试药
重楼干燥根茎分别收集于不同地区,经安徽中医药大学谢冬梅副教授鉴定,为百合科植物云南重楼Paris polyphylla Smithvar.yunnanensis(Franch.)Hand.-Mazz.或七叶一枝花Paris polyphyllaSmith var.chinensis(Franch.)Hara的干燥根茎,具体样品信息见表1。
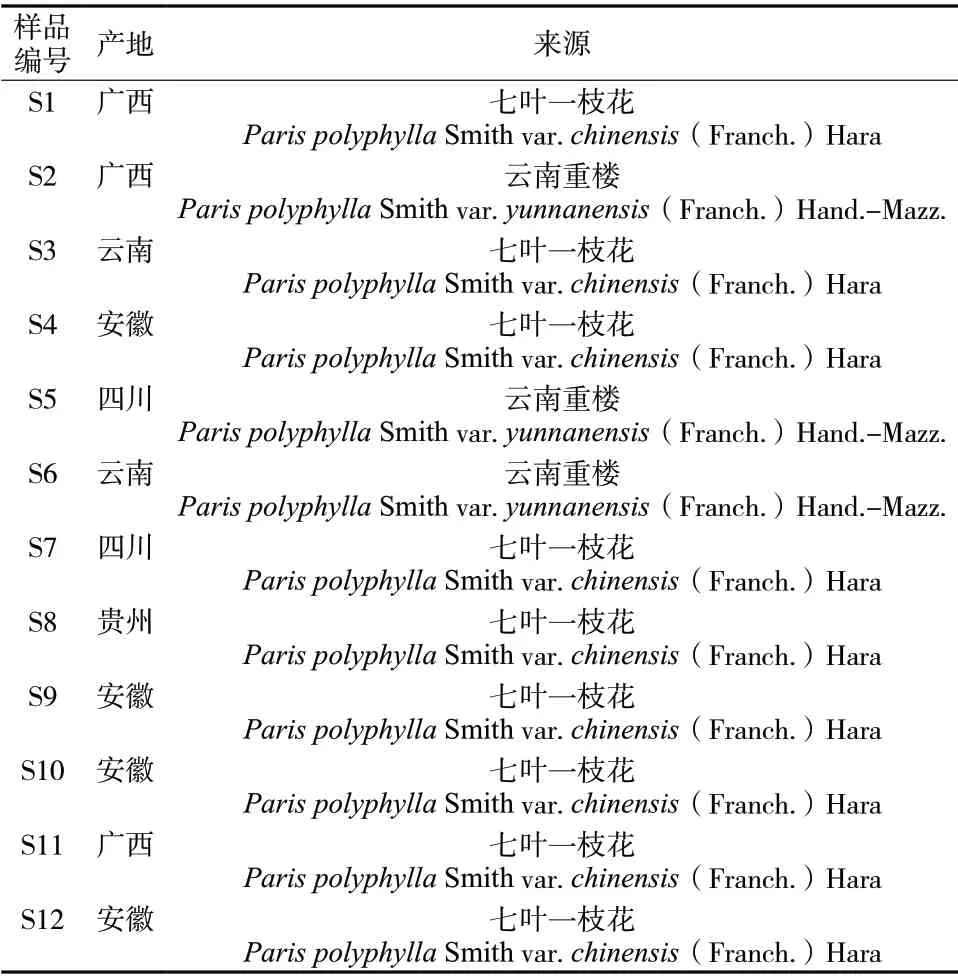
表1 重楼饮片产地信息Tab. 1 Origin information of Paridis Rhizoma
重楼皂苷Ⅰ(批号:DST201206-027,纯度≥98%),重楼皂苷Ⅱ(批号:DST201105-028,纯度≥98%),重楼皂苷Ⅵ(批号:DST200210-029,纯度≥98%),重楼皂苷Ⅶ(批号:DSTDC003001,纯度≥98%),薯蓣皂苷(批号:DST200114-005,纯度≥98%)以上对照品均购自成都德思特生物技术有限公司;1,1-二苯基-2-苦基苯肼(批号:30931-67-0,上海源叶生物科技有限公司);屈臣氏纯净水(广州屈臣氏食品饮料有限公司);过硫酸钾(K2S2O8)(批号:XK 13-011-00008,天津河东区红岩试剂厂);色谱级乙腈(Tedia,美国);正丁醇(批号:920915,芜湖日新化工);高氯酸(批号:20030801-1,广州化学试剂厂);2,2-联氮基(3-乙基苯并噻唑啉-6-磺酸)二氮盐(批号:TN1121CB14,上海笛柏生物科技有限公司)。
2 方法与结果
2.1 正丁醇部位的制备
将12个批次的重楼饮片分别打粉,过40目筛,各称取50 g,加入70%的乙醇300 mL回流提取1 h,同法再提取40 min,将两次过滤后的提取液混合摇匀,减压旋蒸法蒸去乙醇,萃取三次(浓缩液与正丁醇的比例为1∶1.5),回收正丁醇,浓缩至干得到12批重楼正丁醇部位。
2.2 重楼总皂苷含量测定
2.2.1 对照品溶液的制备 精密称取6.65 mg薯蓣皂苷元对照品于25 mL容量瓶中,用甲醇溶解并定容,制备成浓度为0.266 mg/mL的溶液。
2.2.2 总皂苷含量测定的样品制备 精密称定12批重楼的正丁醇部位20 mg于25 mL容量瓶中,加入甲醇定容,超声溶解得到12批样品溶液。
2.2.3 标准曲线 分别准确量取0.1、0.2、0.3、0.4、0.5、0.6、0.8 mL对照品溶液到10 mL容量瓶中,各加入高氯酸5.0 mL,并加甲醇定容,置60℃的水浴中显色25 min,冷却,以甲醇溶液为空白,在408 nm处分别测定吸光度。以吸光度为纵坐标(Y)对浓度为横坐标(X,mg/mL)绘制曲线,回归方程为:Y=0.016 33X- 0.005 8,回归系数R2= 0.999 4。
2.2.4 精密度试验 准确量取“2.2.1”项下薯蓣皂苷元对照品溶液0.4 mL于10 mL试管中,加入高氯酸5.0 mL,置60℃水浴中显色25 min,冷却,测定6次,RSD为0.26%,表明仪器精密度良好。
2.2.5 稳定性试验 精密称定S10重楼正丁醇部位20 mg,按“2.2.2”项下方法制备为供试品溶液,测定0、10、20、30、40、60 min的吸光度值,结果RSD为0.35%,表明溶液在60 min内稳定性良好。
2.2.6 重复性试验 准确量取S10重楼正丁醇部位20 mg 6份,按“2.2.2”项下方法制备成供试品溶液,分别测其吸光度值,结果RSD为2.22%,表明该方法重复性良好。
2.2.7 加样回收率试验 精密称取S10重楼正丁醇部位6份,每份10 mg,分别加入4.52 mg/mL薯蓣皂苷元对照品1 mL,按“2.2.2”项下方法制备6份供试品溶液,测定并计算加样回收率,结果见表2。
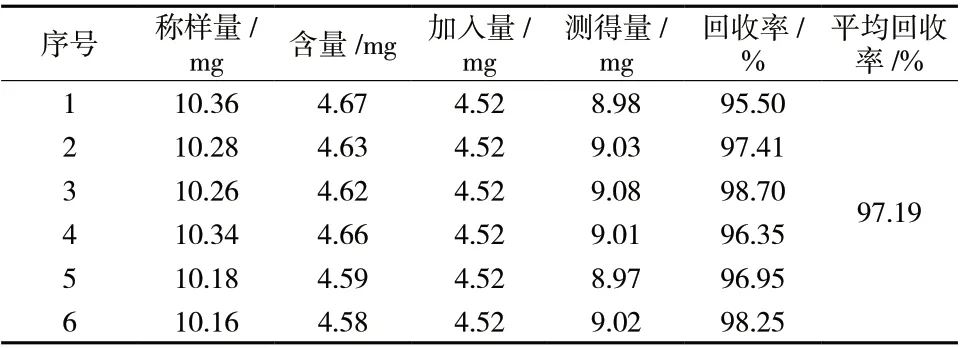
表2 回收率试验结果Tab. 2 Average recoveries results
2.2.8 总皂苷含量测定 参考文献[10]方法,准确量取12批样品溶液各0.3 mL分别于10 mL试管中,加入高氯酸5.0 mL,置60℃水浴中显色25 min,冷却,分别测其吸光度值并计算其含量,结果显示总皂苷含量在41.21% ~ 47.99%,计算其RSD为5.30%,表明12批重楼正丁醇部位的总皂苷含量具有一定的差异,具体见表3。
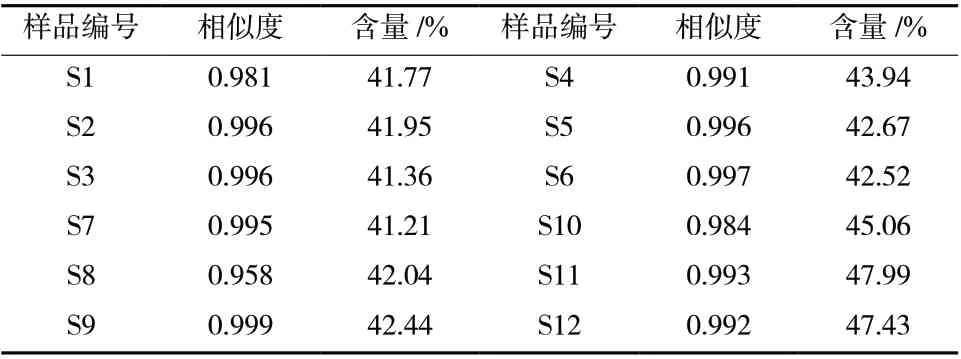
表3 12批重楼正丁醇部位UPLC图谱相似度及含量Tab. 3 UPLC similarity and content of n-butanol parts in 12 batches of Paridis Rhizoma
2.3 重楼正丁醇部位指纹图谱的建立
2.3.1 对照品溶液的制备 分别精密称定重楼皂苷Ⅰ、重楼皂苷Ⅱ、重楼皂苷Ⅵ、重楼皂苷Ⅶ对照品适量,加甲醇配制成浓度分别为0.025 6 mg/mL、0.025 2 mg/mL、0.056 2 mg/mL、0.060 2 mg/mL的混合对照品溶液。
2.3.2 供试品的制备 精密称定“2.1”中重楼正丁醇部位各50 mg置5 mL容量瓶,加甲醇定容,超声溶解,0.22 μm微孔滤膜滤过,即得。
2.3.3 色谱条件 Waters Acquity BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);流动相为乙腈(A)-水(B),洗脱程序:0 ~ 2 min,5% → 25%A;2 ~6 min,25%A;6 ~ 11 min,25% → 50%A;11 ~ 13 min,50% → 70%A;13 ~ 15 min,70% → 100%A;15 ~17 min,100%A,流速:0.20 mL/min,柱温:30 ℃,检测波长:203 nm。
2.3.4 方法学考察 (1) 精密度试验 取S10供试品溶液,按“2.3.3”项下方法重复进样6次,结果各色谱峰保留时间和峰面积基本一致,相似度均大于0.999(中位数),表明仪器精密度良好。
(2) 稳定性试验 取S10供试品溶液,在“2.3.3”项方法下分别在0、2、4、8、10、12、24 h进样,得到相似度均大于0.998(中位数),表明样品稳定性良好。
(3) 重复性试验 取6份重楼正丁醇部位按照“2.3.2”项下方法制备供试品溶液,在“2.3.3”项方法下进样,结果相似度均大于0.996(中位数),表明此方法重复性良好。
2.3.5 指纹图谱中的共有峰指认 将12批供试品溶液和混合对照品溶液,在“2.3.3”项方法下依次进样检测,结果导入“指纹图谱相似度软件2004(A)版”,生成重楼共有模式的对照指纹图谱,其中共有峰14个。通过比对保留时间,确定6号峰为重楼皂苷Ⅶ、7号峰为重楼皂苷Ⅵ、11号峰为重楼皂苷Ⅱ、12号峰为重楼皂苷Ⅰ。
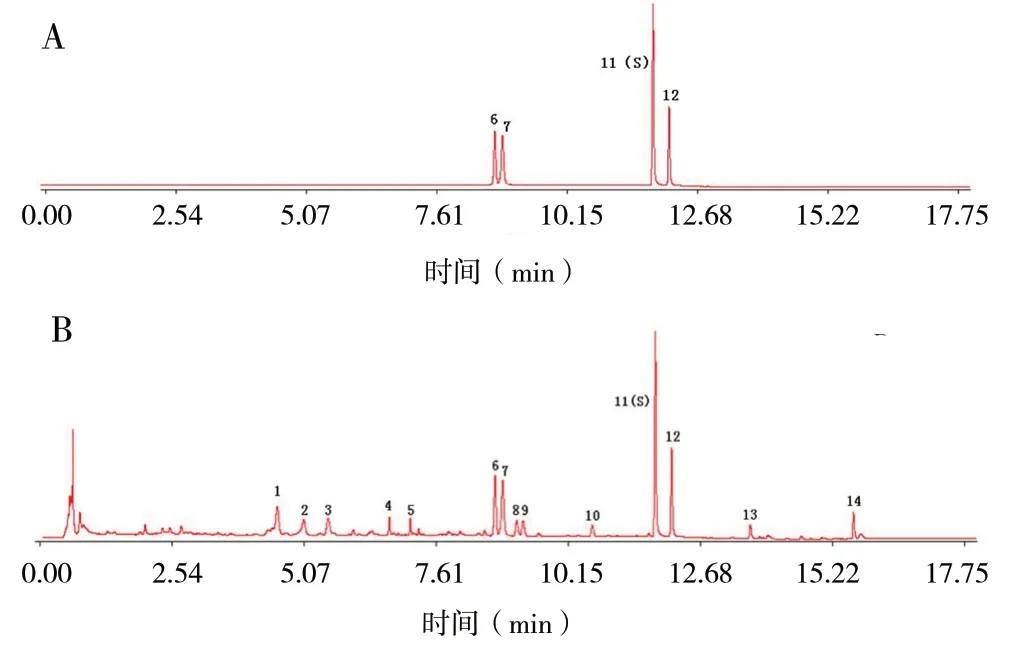
图1 重楼皂苷混合对照品(A)和重楼正丁醇部位的UPLC图谱共有峰色谱图(B)Fig. 1 The common peaks UPLC fingerprints of mixed reference substance (A) and n-butanol fraction of Paridis Rhizoma (B)
2.3.6 指纹图谱相似度评价 将所得的12组供试品溶液的图谱导入“指纹图谱相似度软件2004(A)版”,得到指纹图谱叠加图见图2,相似度结果见表3,共有峰的相对峰面积和RSD见表4。结果12批重楼正丁醇部位的色谱峰相似度均大于0.958,12批重楼正丁醇部位的14个共有色谱峰相对峰面积RSD差异较明显,最大达到26.75%,表明其皂苷的含量有一定差异。
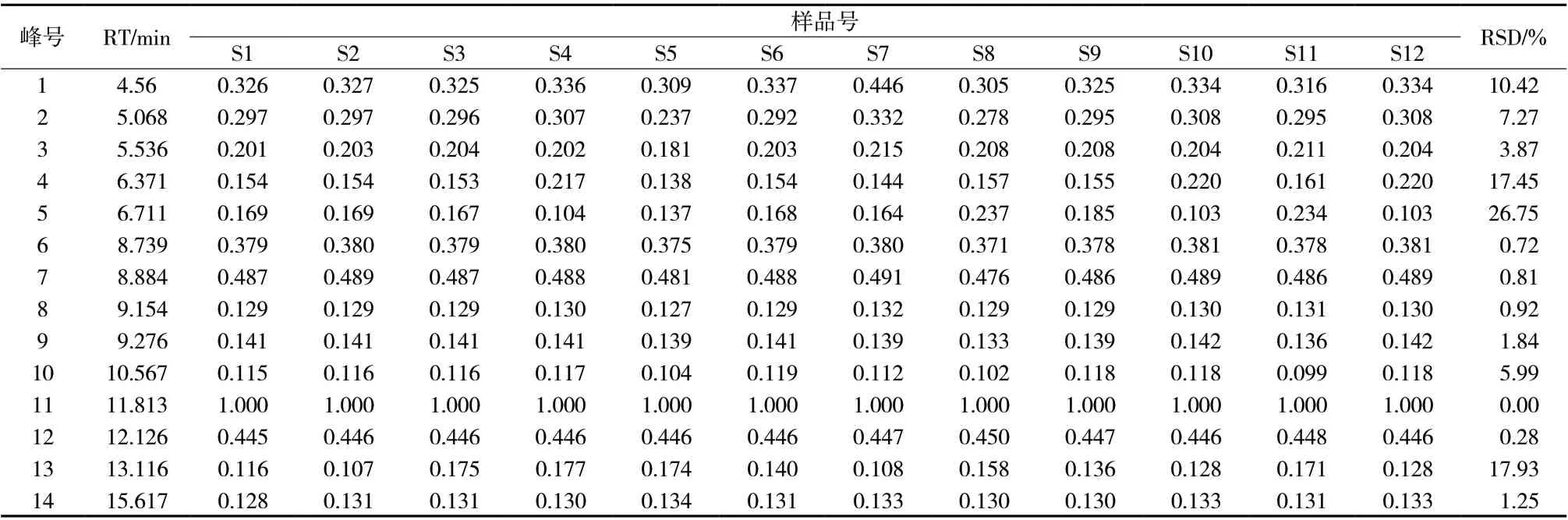
表4 12批重楼正丁醇部位指纹图谱共有色谱峰的相对保留时间和相对峰面积Tab. 4 The relative retention time, relative peak area of chromatographic peaks of 12 batches of n-butanol chromatographic fingerprints
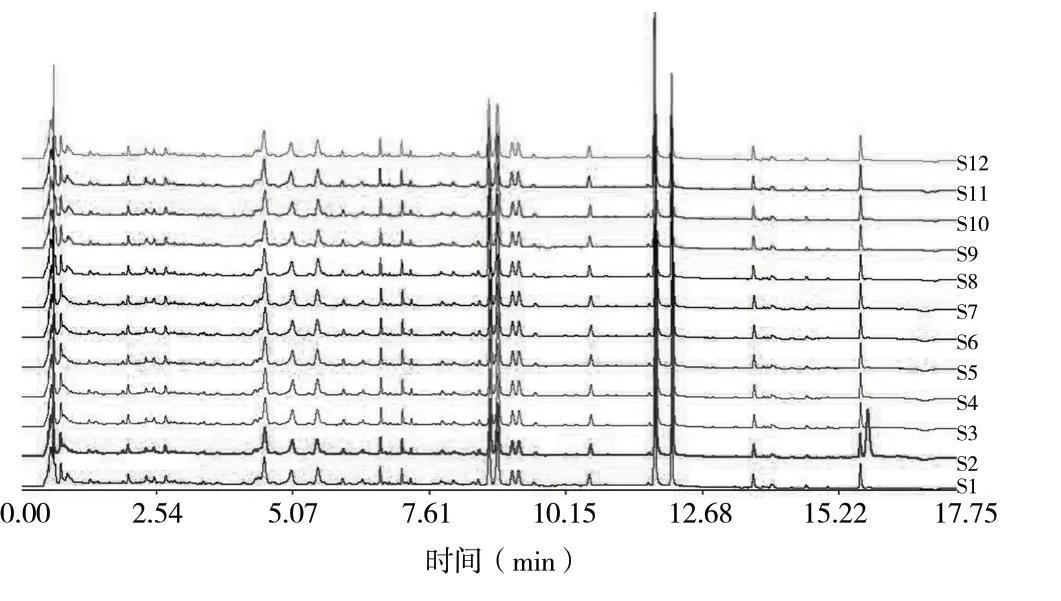
图2 12批重楼正丁醇部位UPLC叠加图谱Fig. 2 UPLC atlas of n-butanol parts in 12 batches of Paridis Rhizoma
2.4 体外抗氧化实验
2.4.1 清除DPPH自由基能力 参考张静等[8]的方法,用70%的乙醇配制浓度25.5 mg/L的DPPH自由基溶液。取12批样品溶液各1 mL,加入DPPH溶液5 mL,混合避光反应30 min,在517 nm测定吸光度Ai;对照组为1 mL样品溶液与70%乙醇5 mL混合均匀,测定的A值记为A1;空白组以5 mL DPPH溶液与1 mL甲醇混合,测定的A值记为A0。通过公式清除率(SH)=[1-(Ai-A1)÷A0]×100%计算重楼总皂苷的抗氧化能力。以清除百分率(%)为纵坐标,样品浓度C(μg/mL)为横坐标,制作拟合曲线,根据拟合方程计算重楼正丁醇部位抗氧化的IC50值。结果显示,12批重楼正丁醇部位的IC50值在1.031~1.284,具体见表5。
2.4.2 清除ABTS自由基能力 参考徐坤勇等[12]的方法,取7.5 mmol/L的ABTS溶液1.50 mL与2.6 mmol/L过硫酸钾溶液2.86 mL混合,置于暗处孵育15 h,加入去离子水稀释,在波长734 nm处其A值为0.700±0.005(0.702、0.703、0.704)。分 别 取12批样品溶液50 μL与ABTS溶液200 μL于96孔板中,在室温下反应6 min后测量反应物在734 nm处的Ai值,对照组以200 μL去离子水与50 μL的样品溶液混合均匀,测定吸光度值A1。空白组则以200 μL ABTS溶液与50 μL甲醇混合均匀,测定吸光度值A0。通过公式清除率(SH)=[1-(Ai-A1)÷A0]×100%,计算重楼总皂苷抗氧化能力。以清除百分率(%)为纵坐标,样品浓度C(μg /mL)为横坐标,制作拟合曲线,根据拟合方程计算重楼正丁醇部位抗氧化的IC50值。结果显示12批重楼正丁醇部位的IC50值在1.079~1.325,具体见表5。
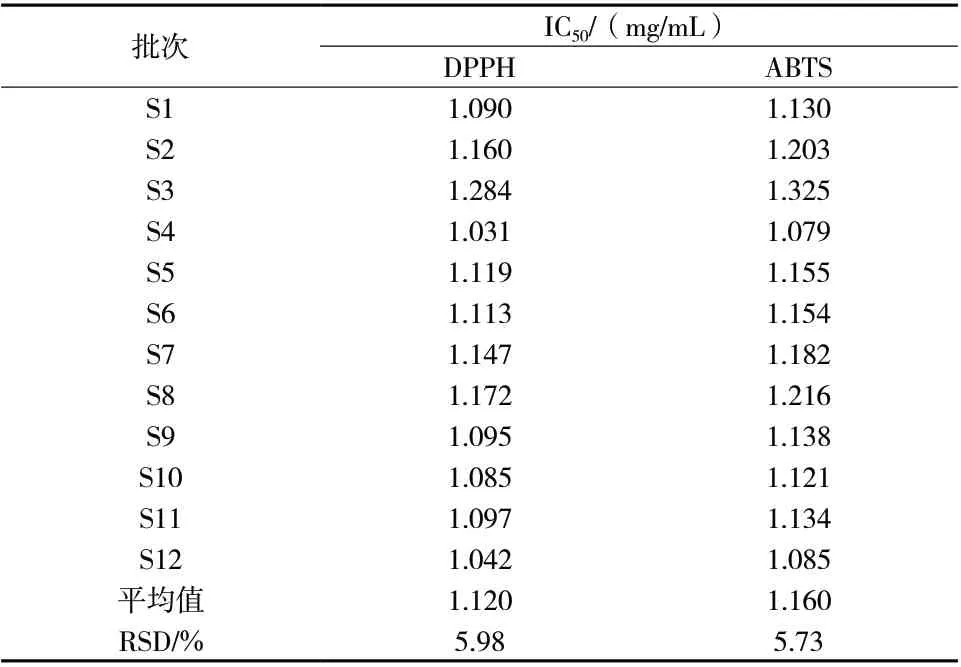
表5 抗氧化实验IC50值Tab. 5 IC50 values of anti-oxidant test
2.5 谱-效相关分析
2.5.1 皮尔逊相关分析 对14个共有峰面积与12批重楼正丁醇部位的IC50,采用SPSS 26.0软件,进行双变量分析,见表6。由表6得出,峰6、峰11、峰12与抗氧化活性相关性很高(P<0.01),且呈正相关。通过与重楼对照品分析,峰6为重楼皂苷Ⅶ、峰11为重楼皂苷Ⅱ,峰12为重楼皂苷Ⅰ。此结果反应出这3个成分为发挥抗氧化活性的物质基础。
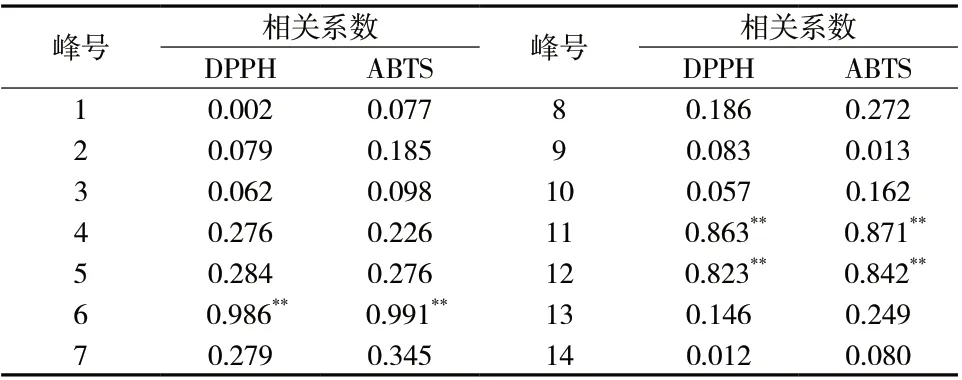
表6 共有峰与抗氧化活性成分的相关系数Tab. 6 Correlation coefficient between common peaks and anti-oxidant active components
2.5.2 逐步回归分析 以IC50值和共有峰面积分别作为因变量和自变量,采用SPSS 26.0软件,进行逐步回归分析,得到方差分析表(表7)和回归系数分析表(表8)。由表7得出显著性P<0.05,可以说明整体存在显著的回归模型,共有峰面积对IC50值具有明显的预测作用,证明重楼正丁醇部位的指纹图谱峰与其抗氧化活性之间存在明显的线性关系。由表8得出6号峰和11号峰与抗氧化活性呈现正相关(P≤0.01),6号峰为重楼皂苷Ⅶ,12号峰为重楼皂苷Ⅰ。得到的结果与皮尔逊相关分析一致,而逐步回归分析结果中没有表明重楼皂苷Ⅱ与抗氧化作用具有相关性,因此对于重楼皂苷Ⅱ的抗氧化作用还需进行进一步的验证。
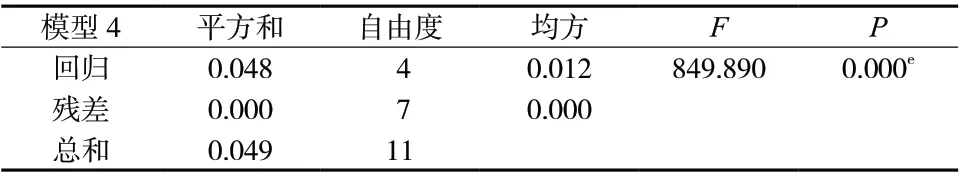
表7 方差分析表Tab. 7 Analysis of variance table
3 讨论
中药是多成分、多靶点、多途径的复杂体系,研究成分与靶点的协同作用存在一定的难度,谱-效关系即在中药指纹图谱与药效研究的基础上,通过数据分析方法建立指纹图谱与药效之间的关系,揭示了化学成分与药效之间的相互关系,明确了发挥作用的具体活性成分。谱-效关系已成为了现代中药研究的热点,并广泛应用于中药的质量控制。
重楼中的主要有效成分为甾体皂苷类成分,现代研究表明,此类成分具有酚羟基,可与自由基反应形成稳定半酮式自由基结构,从而终止自由基链式反应,起到抗氧化的作用[13];YAN S等[14]研究证实重楼皂苷类成分能够通过促进细胞凋亡和细胞周期阻滞,抑制环氧化酶-2通路发挥抗氧化作用。测定体外抗氧化能力的方法现如今已有许多种,例如二苯基苦基苯肼(DPPH)法、邻苯三酚自氧化(Pyrogallol autoxidation)法、羟基自由基清除能力法、ABTS(ABTS assay)法、铁离子还原/抗氧化能力测定(Ferric reducing anti-oxidant power, FRAP)法等。本实验选取了ABTS法和DPPH法,以综合比较重楼皂苷的抗氧化能力,且这二种方法的原理都以清除自由基来测定抗氧物质的抗氧化能力,因其方法快速、便捷,成为了目前使用最多的方法。因此,实验采用ABTS法、DPPH法验证了重楼的正丁醇部位具有较强的体外抗氧化能力,同时,采用皮尔逊法和逐步回归法对谱效关系进行分析,发现重楼皂苷Ⅶ、重楼皂苷Ⅰ与抗氧化活性成显著正相关,可能是重楼起到抗氧化作用的主要活性成分。皮尔逊法分析得到的重楼皂苷Ⅱ与抗氧化活性的相关性在逐步回归法中没有体现,此结果可能与两种分析方法存在差异有关,而现代已有研究表明重楼皂苷Ⅱ具有抗氧化作用[15-16],因此,关于重楼正丁醇部位抗氧化活性还需后期动物体内实验进行验证。
本实验在文献基础上,对重楼正丁醇部位的乙醇回流提取、正丁醇萃取和样品处理条件等实验条件进行了优化,最终得到较稳定的提取、萃取和样品处理条件。参考课题组前期方法,实验对总皂苷测定的紫外分光光度法条件进行了优化和改进;本实验根据前期对条件的优化采用了甲醇超声溶解的方法,实验中考察了不同洗脱条件、流动相配比、不同柱温、不同流速及不同型号的色谱柱,经过优化确定以乙腈-水溶液为流动相,Waters Acquity BEH C18(2.1 mm×100 mm,1.7μm)为色谱柱,柱温为30℃,在此条件下测定的各色谱峰分离度较好,峰形较好且基线平稳。最终得到较理想的指纹图谱测定条件,这为重楼正丁醇部位的整体性质量评价方法提供了参考。
4 结论
本实验成功建立了重楼正丁醇部位的UPLC指纹图谱,指认了14个共有峰,通过谱-效关系相关性研究,明确了其中3种成分可能是重楼正丁醇部位抗氧化活性的物质基础,实验为后续建立化学特征关联功效活性的评价方法来评价不同产地重楼的质量奠定了基础。后期还需对其它色谱峰进行进一步的定性归属,同时,需要通过整体动物实验来验证重楼皂苷的抗氧化作用及其量-效关系。
