基于HPLC指纹图谱对不同基原茵陈的区分及各品种茵陈质量评价
2022-12-05周仔莉贾文江陈雪琴苏阳阳郭宏波
周仔莉,贾文江,李 鹏,陈雪琴,苏阳阳,郭宏波
(1.商洛市药品检验所,陕西 商洛 726000;2.西北农林科技大学 化学与药学院,陕西 杨凌 712100)
2020年版《中国药典》收录茵陈为菊科植物滨蒿Artemisia scopariaWaldst.et Kit.或茵陈蒿Artemisia capillarisThunb.的干燥地上部分,其中,春季采收的习称“绵茵陈”,秋季釆割的称“花茵陈”。茵陈苦微寒而清利,并兼梳理,入脾、胃与肝、胆经,善清利湿热而退黄,为治湿热黄疸之要药,用于治疗黄疸尿少、湿温暑湿、湿疮瘙痒等症[1-2]。
茵陈含有有机酸类、香豆素类、挥发油类、黄酮类、萜类等化合物以及丰富的微量元素,具有广泛的药理作用[3-5]。茵陈复方制剂种类众多,仅2020年版《中国药典》(一部)就收录了十余种,如:茵栀黄系列、茵胆平肝胶囊、茵山莲颗粒、茵芪肝复颗粒等。因茵陈有2种基原且目前各基原茵陈标准仅用单一成分作为指标性成分,缺乏全面的质量评价和监督体系;现有文献对茵陈及茵陈标准汤剂水提物[6-8]、醇提物[9-10]、挥发油[11]有少量研究,但尚无对滨蒿和茵陈蒿二者成分及质量差异的研究,并且鲜有对不同基原茵陈药材使用指导原则的报道。本研究同时建立滨蒿和茵陈蒿HPLC指纹图谱,全面比较滨蒿和茵陈蒿两种基原茵陈所含化学物质种类及含量的差异,为茵陈制剂原料的选择及茵陈饮片的质量控制提供指导依据。
1 仪器与试药
1.1 仪器
Waters e2695型高效液相色谱仪(Empower色谱工作站,美国Waters公司);Agilent 1260Ⅱ型高效液相色谱仪(DAD检测器,美国安捷伦科技公司);SQP型电子分析天平(北京赛多利斯科学仪器有限公司,精度:0.1 mg);KQ-250DE型数控超声波清洗器(昆山市超声仪器有限公司,功率:250 W,频率:40 kHz);Hitech型纯水机(上海和泰仪器公司);FW-200D型高速万能粉碎机(天津鑫博得仪器有限公司);药筛(湖南省常德粒度分析仪器厂)等。
1.2 试药
没食子酸(批号:110831-201906,纯度:96.5%)、原儿茶酸(批号:110809-201906,纯度:97.7%)、绿原酸(批号:110753-202018,纯度:96.1%)、香草酸(批号:110776-201503,纯度:99.8%)、咖啡酸(批号:110885-201703,纯度:99.7%)、阿魏酸(批号:110773-201915,纯度:99.4%)、芦丁(批号:100080-202012,纯度:91.6%)、金丝桃苷(批号:111521-201809,纯度:94.9%)、丁香酚(批号:110725-201917,纯度:100%)、3, 5-O-二咖啡酰奎宁酸(批号:111782-201807,纯度:94.3%)、滨蒿内酯(批号:111511-201704,纯度:99.9%)、滨蒿对照药材(批号:120950-201608、120950-201007)、茵陈蒿对照药材(批号:121555-201602、121555-201107)均购于中国食品药品检定研究院;甲醇(分析纯,天津市天力化学试剂有限公司)、乙醇(分析纯,成都市科隆化学品有限公司)、色谱乙腈 [赛默飞世尔科技 (中国)有限公司],超纯水等。
本研究分别从不同产地收集了16批次茵陈药材,样品经西北农林科技大学郭宏波教授鉴定为滨蒿Artemisia scopariaWaldst.et Kit.或茵陈蒿Artemisia capillarisThunb.的干燥地上部分,药材信息详见表1。
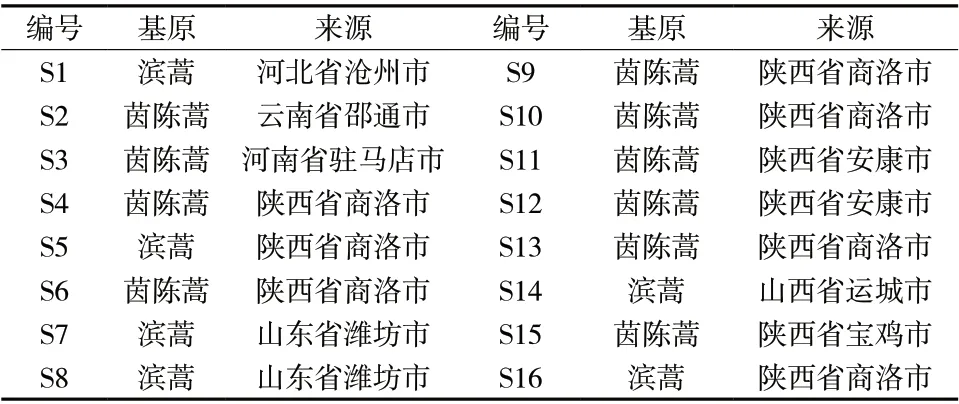
表1 茵陈样品信息Tab. 1 Information of Artemisia Scoparia Herba
2 方法与结果
2.1 色谱条件
Welch Ultimate xB C18色谱柱(250 mm×4.6 mm,5 μm),流动相:乙腈(A)-5 mL/L磷酸水溶液(B),梯度洗脱:0 ~ 30 min,10%→15%A;30 ~ 45 min,15%→30%A;45 ~ 60 min,30%→10%A;60 ~65 min,10%A;流速:1.0 mL/min;检测波长:220 nm和360 nm;柱温:30℃;进样体积:20 μL。
2.2 供试品溶液制备
精密称取各批次茵陈样品及对照药材0.5 g置具塞锥形瓶中,精密加入70%甲醇25 mL,称定初始重量,室温超声提取30 min(功率:250 W,频率:40 kHz),冷却后用70%甲醇补足失重,摇匀,用0.45 μm微孔滤膜滤过,取续滤液,即得。
2.3 对照品溶液制备
分别精密称取各对照品适量,加甲醇制成含没食子酸、原儿茶酸、绿原酸、香草酸、咖啡酸、阿魏酸、芦丁、金丝桃苷、丁香酚、3, 5-O-二咖啡酰奎宁酸、滨蒿内酯质量浓度分别为0.80、2.19、254.67、2.04、112.16、3.25、12.05、19.36、600.00、188.60、10.49 μg/mL混合对照品溶液。
2.4 HPLC指纹图谱的建立及相似度评价
2.4.1 精密度试验 精密吸取滨蒿对照药材溶液,按照“2.1”项下色谱条件,连续进样6次,以5号峰(绿原酸)为参照峰,计算各共有峰相对峰面积RSD在0.27% ~ 1.91%,表明该方法精密性良好。
2.4.2 重复性试验 精密称取滨蒿对照药材(批号:120950-201608)6份,按“2.2”项下方法制备供试品溶液,按照“2.1”项下色谱条件进行测定,以5号峰(绿原酸)为参照峰,计算各共有峰相对峰面积RSD在0.66% ~ 2.51%,表明该方法重复性良好。
2.4.3 稳定性试验 取滨蒿对照药材溶液,按照“2.1”项下色谱条件,分别在0、2、4、8、12、24 h进样测定,以5号峰(绿原酸)为参照峰,计算各共有峰相对峰面积的RSD在0.35% ~ 2.18%,表明该溶液在24 h内稳定。
2.4.4 滨蒿及茵陈蒿指纹图谱相似度评价 按照“2.1”项下的色谱条件及“2.2”项下供试品制备方法,测定4批次对照药材及16批次茵陈的指纹图谱。分别将4批次对照药材及16批次样品在不同波长(220 nm和360 nm)测定的HPLC指纹图谱导入“中药指纹图谱相似度评价系统(2012版)”,以S1为参考,设定时间窗宽度为0.01,利用平均数法,选择多点校正、自由匹配,建立2种基原茵陈对照指纹图谱(见图1)及16批次茵陈药材的HPLC指纹图谱叠加图(见图2A、2B),通过指纹图谱比较,根据滨蒿对照药材和茵陈蒿对照药材图谱标定共有峰23个,已知化合物11个,即峰1、3、5、7、8、13、16、17、19、21、22分别为没食子酸、原儿茶酸、绿原酸、香草酸、咖啡酸、芦丁、金丝桃苷、阿魏酸、丁香酚、3,5-O-二咖啡酰奎宁酸、滨蒿内酯;根据已有相关研究[12-13]推测出峰2、4、6、9、10、18、20、23分别为1-咖啡酰奎宁酸、新绿原酸、隐绿原酸、对羟基苯乙酮、1,3-二咖啡酰奎宁酸、异槲皮苷、3,4-二咖啡酰奎宁酸、4,5-O-二咖啡酰奎宁酸,尚有4个未知化合物有待进一步研究,初步推断峰11、12为滨蒿特有峰,由图谱可得出不同基原茵陈差异较大,且在220 nm更适合于茵陈各类有机酸的检出,在360 nm处特异峰(峰11、峰12)更加明显,构建的指纹图谱可以很好地区分2种基原的茵陈,根据图谱可判定样品S1、S5、S7、S8、S14、S16为滨蒿,S2、S3、S4、S6、S9、S10、S11、S12、S13、S15为茵陈蒿。
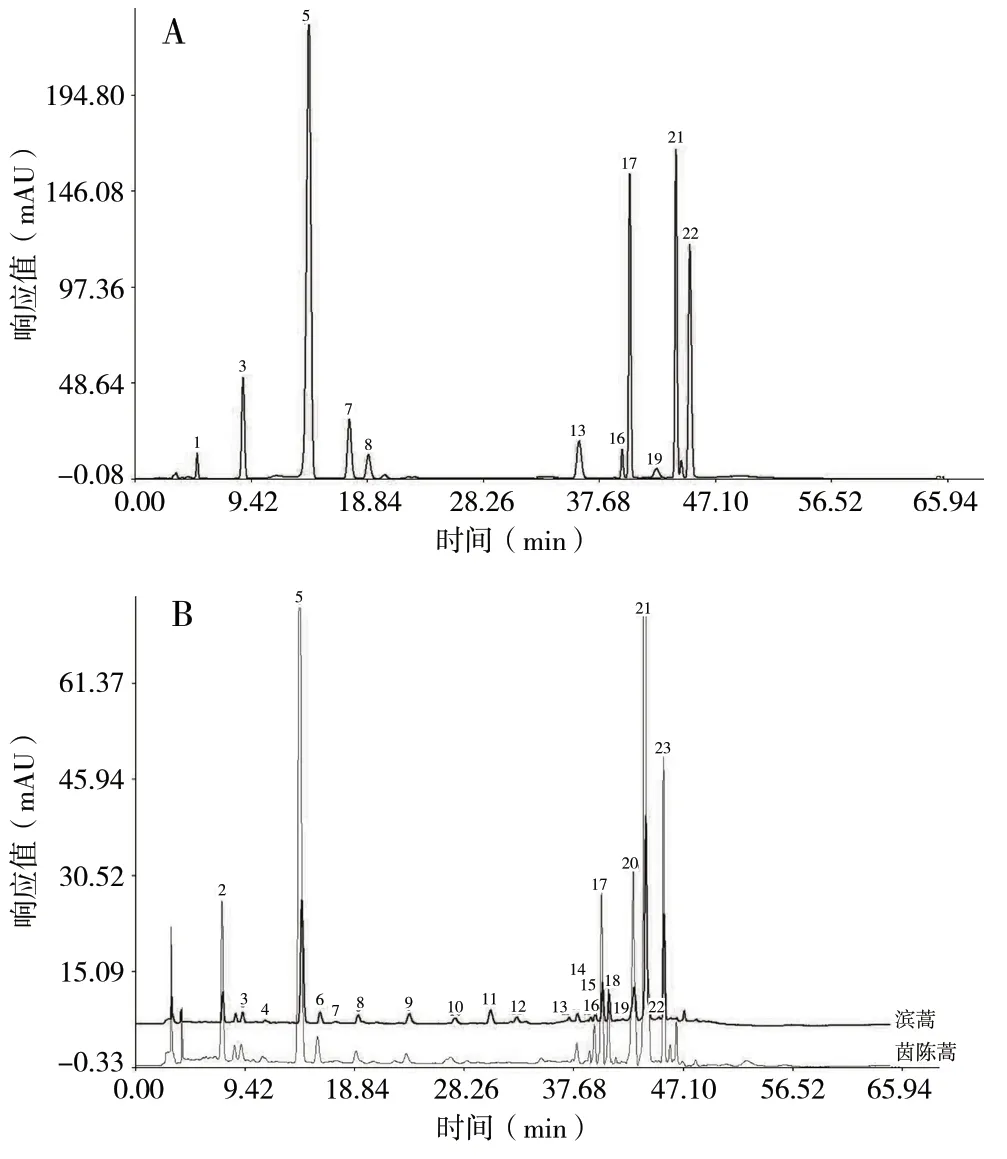
图1 混合对照品及2种基原茵陈对照指纹图谱(360 nm)Fig. 1 Chromatograms of mixed reference substances and fingerprints of 2 origins of Artemisia Scoparia Herba(360 nm)
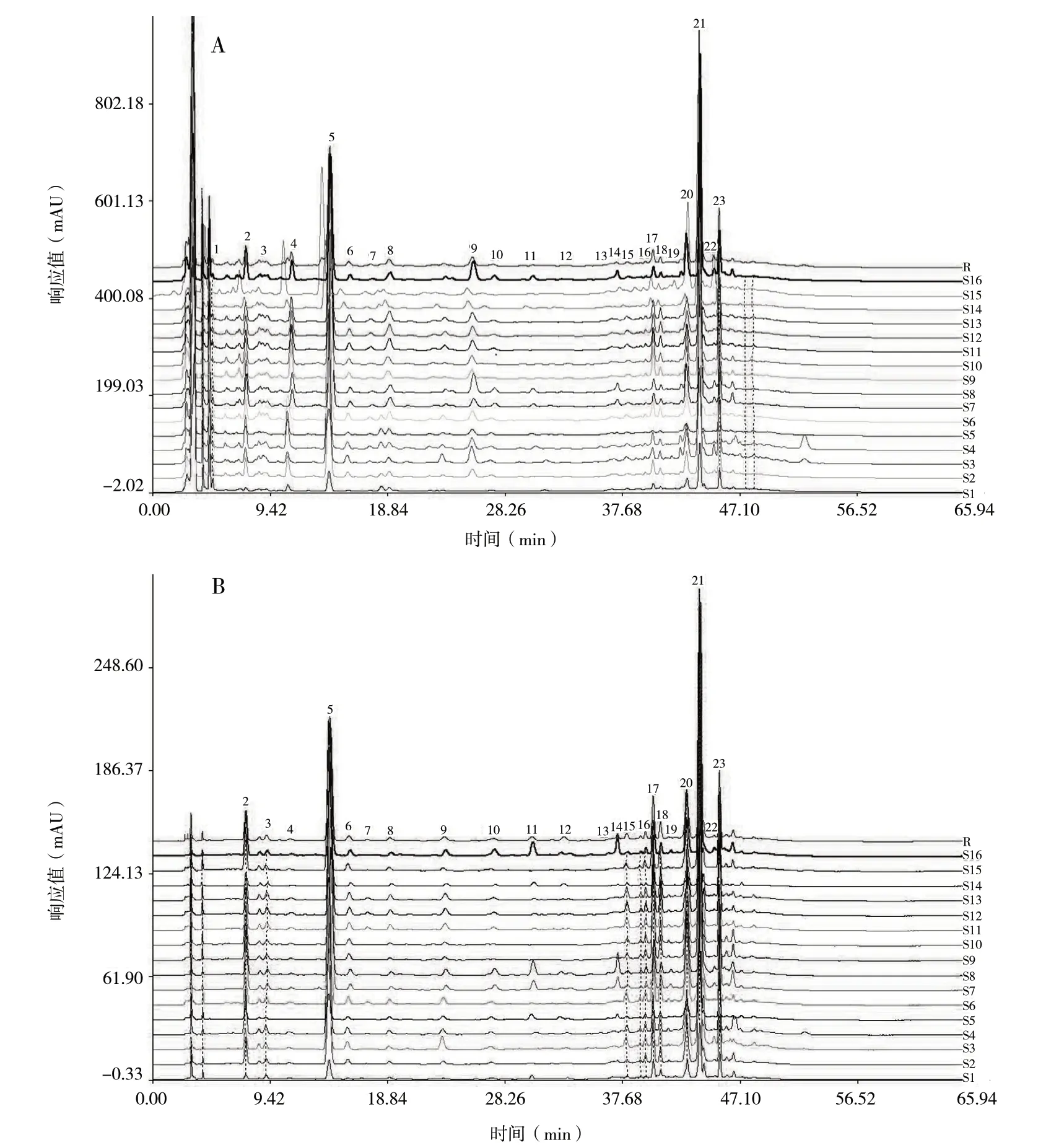
图2 茵陈样品HPLC指纹图谱Fig. 2 Overlay of HPLC fingerprints of Artemisia Scoparia Herba samples
分别以共有模式峰和滨蒿对照药材图谱作为参照图谱,得到16批次茵陈药材样品与共有模式色谱峰和滨蒿对照药材图谱相似度分别为 0.694 ~ 0.951、0.872 ~ 0.989,见表2。

表2 相似度分析结果Tab. 2 Similarity evaluation results of 20 batches of Artemisia Scoparia Herba
2.4.5 基于化学模式对茵陈药材的分析 应用SPSS 21.0软件,以指纹图谱23个共有峰的峰面积为变量,对16批次茵陈样品进行聚类分析[14-15],结果见图3。当判别距离大于10时,样品可以分为3类,S1、S5、S14分为一类,S3、S7、S8、S16归为一类,S2、S4、S6、S9、S10、S11、S12、S13、S15归为一类,与相似度评价结论基本一致。
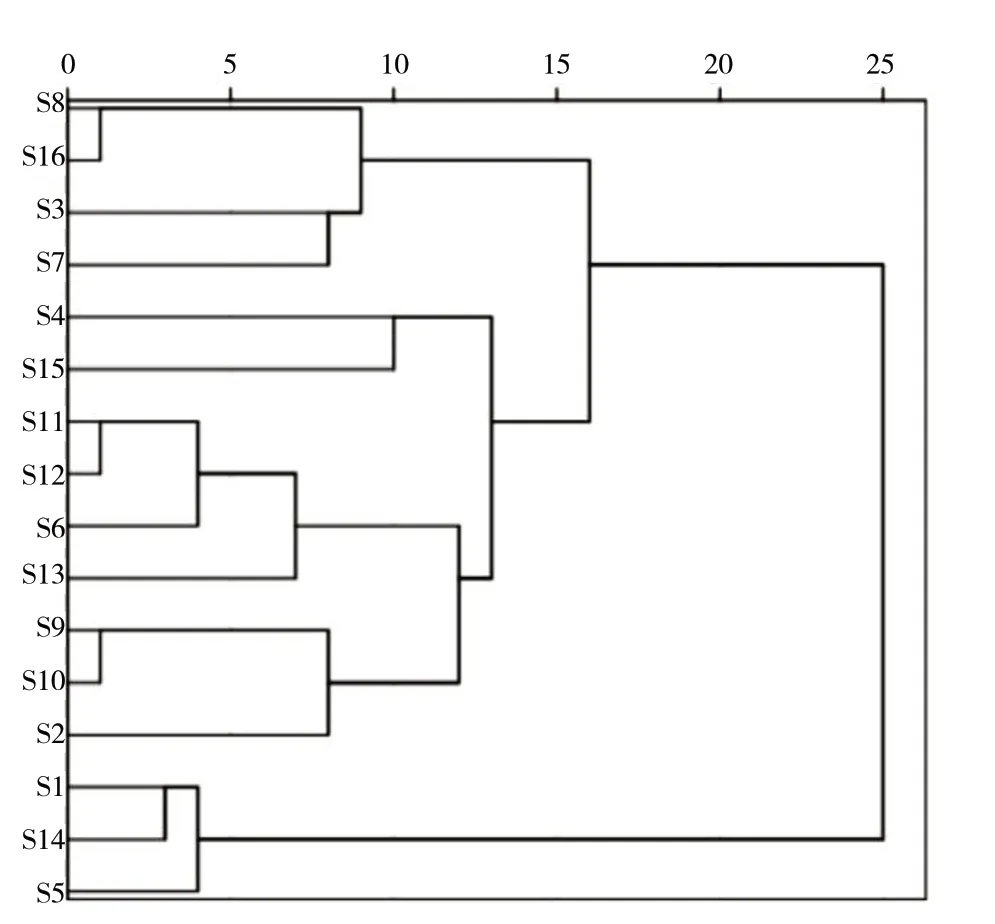
图3 16批茵陈样品聚类分析树状图Fig. 3 Dendrogram of cluster analysis of 16 batches of Artemisia Scoparia Herba samples
为了进一步分析茵陈样品间及不同基原茵陈的差异,将指纹图谱得到的23个共有峰峰面积数据导入SIMCA 14.1软件,基于PCA分析,进一步进行OPLS-DA判别分析,得分图见图4,可得知16批茵陈样品可大致分为两组,即S1、S5、S7、S8、S14、S16归 为 一 类,S2、S3、S4、S6、S9、S10、S11、S12、S13、S15归为一类,正交偏最小二乘判别分析与聚类分析结果一致。

图4 16批茵陈样品 OPLS-DA 散点图Fig. 4 Scatter diagram of OPLS-DA of 16 batches of Artemisia Scoparia Herba samples
提取共有峰峰面积作为变量的权重值(VIP)进行分析,以VIP>1作为对整体模型的贡献度高于平均水平值为标准,筛选出了5个对样本分类具有统计学意义的差异标志物,即绿原酸、3,5-O-二咖啡酰奎宁酸、4,5-O-二咖啡酰奎宁酸、新绿原酸、金丝桃苷,VIP值分别为3.05、2.38、1.39、1.35、1.08(见图5),这些化学成分对不同基原样品分类具有显著影响,是区分滨蒿和茵陈蒿的主要标志性成分。
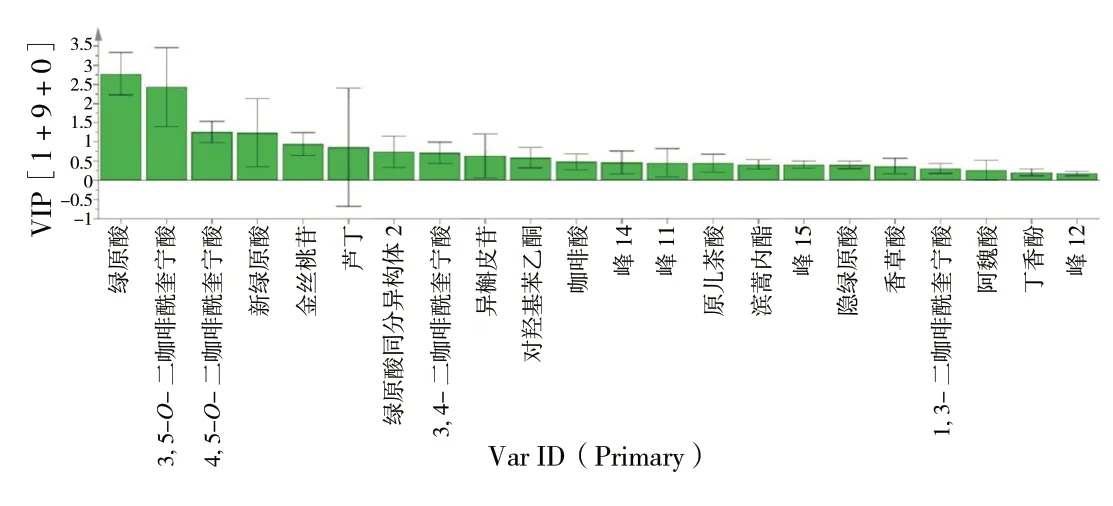
图5 茵陈样品各成分VIP图Fig. 5 VIP diagram of components in Artemisia Scoparia Herba samples
2.5 不同基原茵陈含量分析
2.5.1 线性关系考察 分别精密吸取“2.3”项下混合对照品溶液0.5、1、2、5、15、20μL,注入色谱仪中,按照拟定色谱条件进行分析。以对照品 质 量 浓 度(μg/mL)(X1,X2,X3,X4,X5,X6,X7,X8,X9,X10,X11)对 峰 面 积(Y1,Y2,Y3,Y4,Y5,Y6,Y7,Y8,Y9,Y10,Y11)进行线性回归,结果见表3。说明11个组分在拟定色谱条件下,具有较好的线性关系及检测灵敏度。
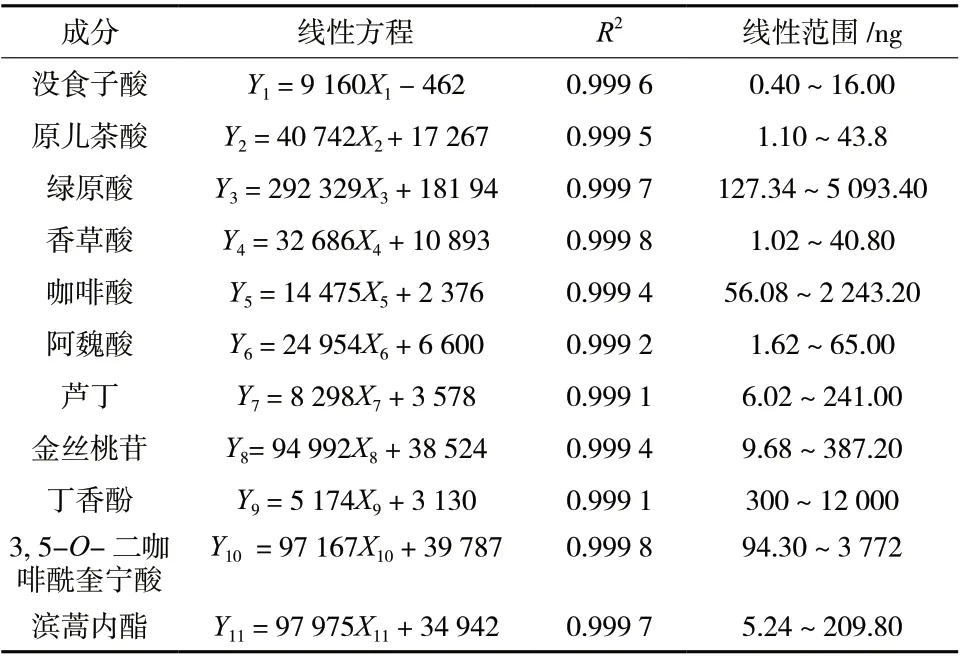
表3 成分线性关系Tab. 3 Linear relashionship of components
2.5.2 精密度试验 精密吸取混合对照品溶液10μL,按照“2.1”项下色谱条件,连续进样6次,记录色谱图,结果没食子酸、原儿茶酸、绿原酸、香草酸、咖啡酸、芦丁、金丝桃苷、阿魏酸、丁香酚、3, 5-O-二咖啡酰奎宁酸、滨蒿内酯峰面积的RSD均小于1.5%,表明该方法精密度良好。
2.5.3 重复性试验 精密称取滨蒿对照药材(批号:120950-201608)6份,按“2.2”项下方法制备供试品溶液,按照“2.1”项下色谱条件进行测定,结果没食子酸、原儿茶酸、绿原酸、香草酸、咖啡酸、芦丁、金丝桃苷、阿魏酸、丁香酚、3,5-O-二咖啡酰奎宁酸、滨蒿内酯峰面积的RSD均小于1.5%,表明该方法重复性良好。
2.5.4 稳定性试验 精密吸取同一滨蒿对照药材溶液(批号:120950-201608),按照“2.1”项下色谱条件,分别在0、2、4、8、12、24 h进样测定,结果没食子酸、原儿茶酸、绿原酸、香草酸、咖啡酸、芦丁、金丝桃苷、阿魏酸、丁香酚、3, 5-O-二咖啡酰奎宁酸、滨蒿内酯峰面积的RSD均小于1.5%,表明该溶液在24 h内稳定。
2.5.5 加样回收率试验 取已知含量的S6样品6份 ,精密称取0.5 g,分别加入没食子酸、原儿茶酸、绿原酸、香草酸、咖啡酸、芦丁、金丝桃苷、阿魏酸、丁香酚、3,5-O-二咖啡酰奎宁酸、滨蒿内酯对照品适量,按照“2.2”项下的方法平行制备6份供试品溶液,分别进样,计算回收率,结果见表4。
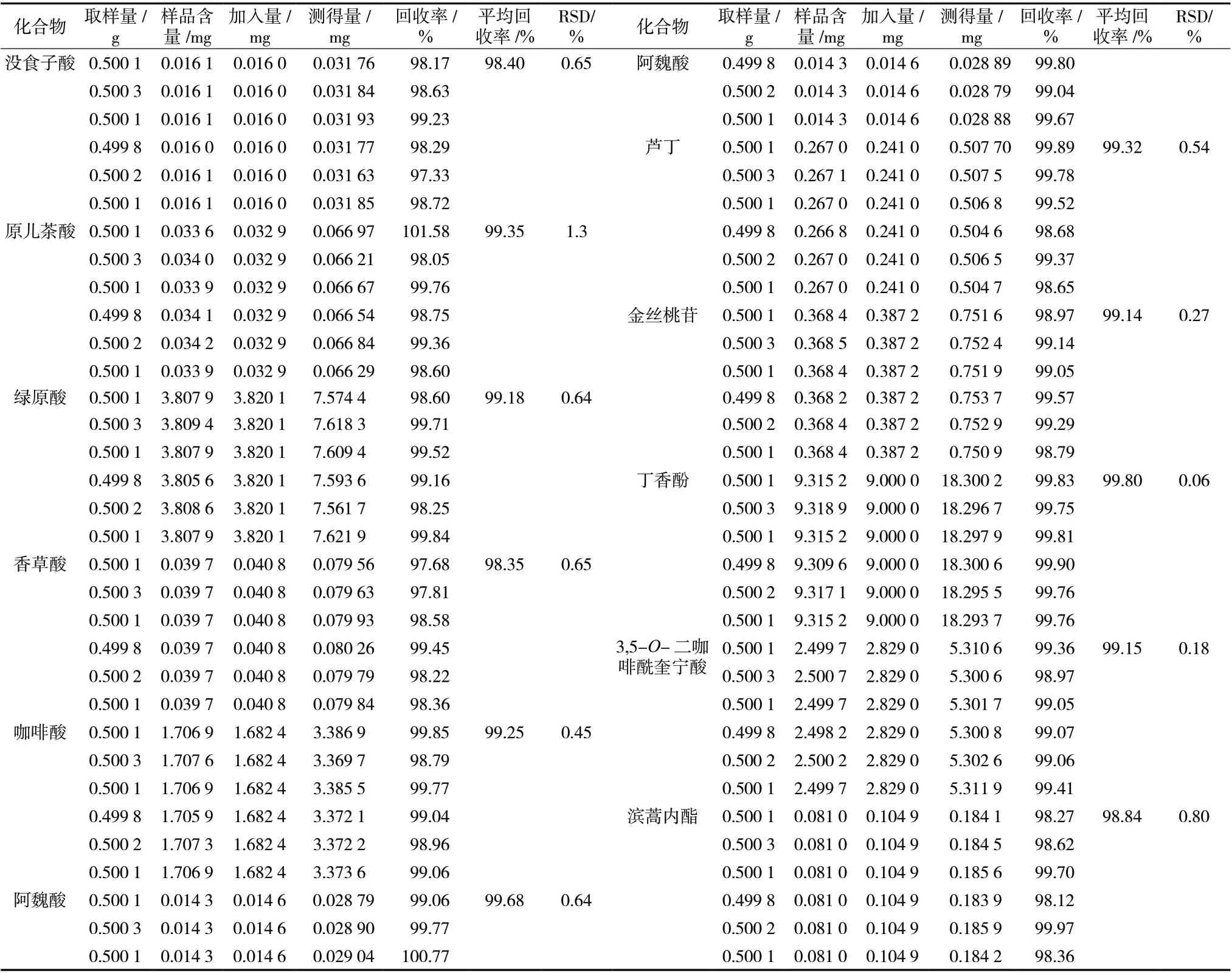
表4 茵陈11个共有成分加样回收率试验结果(n = 6)Tab. 4 The recoveries of 11 common components in Artemisia Scoparia Herba(n = 6)
2.5.6 样品测定 分别取16批次样品,按“2.2”项下方法制备供试品溶液,按照“2.1”项下色谱条件进行测定,记录色谱图,采用外标法分别对样品中的11种共有成分含量进行测定,结果见表5。
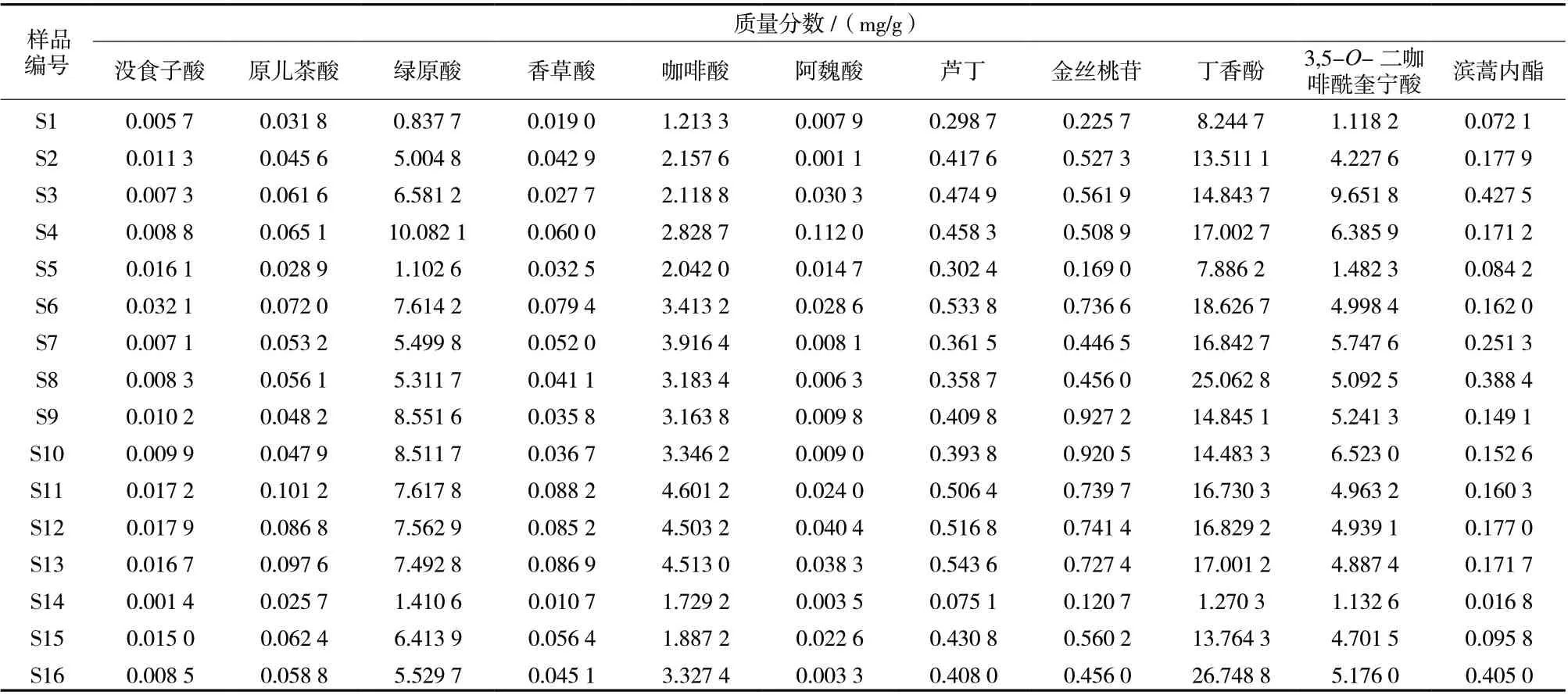
表5 茵陈11个共有成分含量测定结果(n = 3)Tab. 5 Result of determination of 11 components in Artemisia Scoparia Herba(n = 3)
3 讨论
3.1 提取溶剂及提取方法的选择
本研究采用DAD检测器对样品进行全波长210 ~800 nm扫描,发现茵陈样品中所含绿原酸、咖啡酸等有机酸在220 nm附近有很强吸收,滨蒿特异峰(峰11、峰12)在360 nm附近有较强吸收及较好的分离,故而最终确定了双波长测定;对比了茵陈采用不同溶剂超声提取图谱,发现茵陈70%甲醇提取液对各种有机酸类及黄酮类提取效果好;研究中用70%甲醇作为提取溶剂,对比滨蒿对照药材回流和超声提取的色谱图,发现两种处理方式对目标成分影响差异不大,最终选择了操作简便的超声提取方法。
3.2 不同基原茵陈的区别
茵陈药材不同基原品种在性状上差异不大,仅能从气味等细微的差别上进行判定,而本研究构建的方法可以作为茵陈基原鉴定除性状之外的一种有效的补充方法。结合指纹图谱相似度评价、聚类分析、PCA分析、正交偏最小二乘判别以及含量测定结果分析所得结论与本研究中药材基原的鉴定结论是一致的,即S1、S5、S7、S8、S14、S16被判定为滨蒿,S2、S3、S4、S6、S9、S10、S11、S12、S13、S15被判定为茵陈蒿;从样品S1、S5、S7、S8、S14、S16中检测到了峰11、峰12,而S2、S3、S4、S6、S9、S10、S11、S12、S13、S15未检测到,与滨蒿对照药材及茵陈蒿对照药材指纹图谱一致,进一步证明了此差异是真实存在的,未受其它干扰因素影响。
研究中共收集到了6个省的16批次茵陈样品及中国食品药品检定研究院4批次对照药材,发现不同基原茵陈共有成分含量差异较为明显,茵陈蒿中金丝桃苷、芦丁平均含量是滨蒿的2倍 ~ 6倍,绿原酸、阿魏酸、香草酸、咖啡酸等有机酸平均含量均高于滨蒿,各成分加样回收率试验结果显示回收率均在98% ~100%范围,RSD均小于1.5%,表明含量测定结果准确可靠,故可作为茵陈药材不同基原区分的一个量化指标。S1样品中23个共有峰峰面积整体偏小,结合性状及含量分析,推测可能是采收贮存时间过长,造成所含成分整体降低,但当增加取样量或进样体积时,峰11、12峰面积成比例增大,继而验证峰11、12也为S1样品的特征峰。通过性状观察发现S3样品老茎较多,猜测是春季采收较晚或是秋季采收,检测到滨蒿内酯成分积累较多,与相关文献[16] “绵茵陈”几乎不含滨蒿内酯及《中国药典》收录“花茵陈”以滨蒿内酯为指标性成分相一致。目前尚无有关两种基原的茵陈品种比较研究,有关滨蒿特有的2种差异成分具体化学结构,需要进一步确定。
4 结论
本研究成功构建了滨蒿与茵陈蒿的HPLC指纹图谱,可将两种基原茵陈进行有效区分,综合指纹图谱相似度评价的结果与聚类分析、共有化学成分PCA分析、OPLS-DA综合分析结果,均可明确将不同基原茵陈分为滨蒿和茵陈蒿,且结论一致。根据PCA分析可确定绿原酸、3, 5-O-二咖啡酰奎宁酸、4,5-O-二咖啡酰奎宁酸、新绿原酸、金丝桃苷5种成分为茵陈药材的主要质量标志性成分,不同基原的茵陈含量差异明显,茵陈蒿中各成分平均含量明显高于滨蒿。结合相似度评价、指纹图谱分析研究及多成分同时测定协同多指标定量评价不仅为茵陈的质量控制提供优化方案,同时也为茵陈药材两种不同基原(滨蒿、茵陈蒿)的特异性、差异性研究提供了科学依据。
