西藏地区藏族人群胃癌组织中H3K27me3表达水平及其临床意义
2022-12-05罗含欢边巴扎西尼玛卓玛廖瑞倩次仁曲珍
罗含欢,师 杰,边巴扎西,杨 旭,尼玛卓玛,王 倩,李 梅,王 寒,廖瑞倩,次仁曲珍
西藏自治区人民医院 1病理科 3普外科,拉萨 850000 中国医学科学院北京协和医院 2病理科 4肝脏外科,北京 100730
胃癌是消化系统最常见的恶性肿瘤之一,其在中国乃至全球均具有较高的发病率和疾病负担。流行病学数据显示,2020年全球胃癌发病率居所有癌症第5位,死亡率居第4位;在中国,胃癌发病率和死亡率在所有癌症中均居前3位,严重威胁居民的生命健康[1]。胃癌在我国的流行情况存在明显地域差异,调查显示西藏自治区拉萨市社区人群胃癌发病率明显高于全国平均水平[2];作为西藏最大的三甲医院,西藏自治区人民医院病理科有存档记录的恶性肿瘤病理资料中,胃癌的占比最高,提示西藏为胃癌的高发区,肿瘤防治任务艰巨。
近年来,表观遗传学研究结果证实组蛋白修饰与肿瘤发生发展关系密切[3- 5],针对组蛋白乙酰化酶抑制剂的疗法在T细胞淋巴瘤[6- 7]、多发性骨髓瘤[8]治疗,逆转非小细胞肺癌耐药性[9- 10]等方面表现出令人瞩目的临床疗效,多种组蛋白修饰相关酶及蛋白已成为潜在的肿瘤治疗新靶点。组蛋白H3的N末端赖氨酸残基K27是最常见的甲基化修饰位点,经三甲基化修饰后生成H3K27me3,能抑制下游靶基因转录,调控相应基因表达,参与多种肿瘤发生与发展,但其在不同瘤种中的表达水平及临床意义不尽相同。研究者已针对H3K27me3与胃癌的相关性进行了探索,多项研究显示,H3K27me3在胃癌组织中呈强阳性表达[11- 12],且其高表达与肿瘤分化程度、远处转移、pTNM分期等多种病理特征相关,可作为此类人群预后不良的独立预测因子[13]。但既往研究主要针对汉族人群,西藏地区高寒、低压、低氧的特殊环境,使得长期居住于此的藏族人群呈现出特异性生理特征和疾病谱,目前尚缺乏西藏地区藏族人群胃癌组织中H3K27me3表达情况及其临床意义的研究。本研究收集了西藏自治区人民医院连续3年胃癌患者的临床与病理资料,针对上述问题进行了分析。
1 资料与方法
1.1 研究对象
本研究为回顾性分析。研究对象为2019年8月至2021年8月西藏自治区人民医院诊治的胃癌患者及同期确诊的非胃癌患者。胃癌患者纳入标准:(1)均行手术切除,组织病理证实为原发性胃癌;(2)藏族患者且长期生活在西藏地区。排除标准:(1)合并其他系统肿瘤者;(2)术前接受过化疗者;(3)临床与病理资料存在明显缺失的患者。非胃癌患者为随机选取同期行胃活检检查,证实为非胃癌的藏族居民。
本研究已通过西藏自治区人民医院伦理审查委员会审批(审批号:ME-TBHP- 21-KJ- 054),并豁免患者知情同意。
1.2 方法
1.2.1 资料收集
收集胃癌患者的年龄、性别、诊断结果等基本资料,以及肿瘤最大径、Lauren分型、分化程度、浸润深度、TNM分期等病理特征。其中肿瘤分期、分化程度、分型等的判读标准依据2019年第五版《世界卫生组织消化系统肿瘤分类》[14]。
1.2.2 H3K27me3免疫组化检测
取胃癌患者手术切除肿瘤组织、癌旁正常胃黏膜组织(距癌灶边缘3~5 cm)及非胃癌患者正常胃黏膜组织活检标本,经4%中性甲醛液固定、石蜡包埋、连续切片,采用EnVision两步法进行H3K27me3免疫组化测定。采用二甲苯对石蜡切片进行脱蜡至水,PBS洗涤3次,每次2 min;加入3%双氧水,室温下孵育15 min,PBS洗涤3次,每次2 min;将切片置于含柠檬酸盐缓冲液的高压锅中热修复15 min,自然冷却后PBS洗涤3次,每次2 min;滴加H3K27me3单克隆抗体(克隆号:RM175),37 ℃水浴45 min,滴加生物素化二抗工作液孵育25 min,PBS洗涤3次,每次2 min。去除PBS液,每张切片滴加1滴新配置的DAB显色液,5 min后用蒸馏水清洗,终止显色反应,苏木精复染2 min,依次进行1%盐酸酒精分化、氨水反蓝、梯度乙醇脱水、二甲苯透明、中性树胶封片,显微镜下观察。
1.2.3 结果判读
本研究采用阳性细胞半定量分级法,即结合细胞核着色强度与着色细胞数量综合判定H3K27me3表达情况[15]。(1)着色强度评分:细胞核未着色为0分,淡黄色颗粒状着色为1分,棕黄色颗粒状着色为2分,深褐色颗粒状着色为3分;(2)着色细胞数量评分:靶组织中H3K27me3着色细胞数<5%为0分,5%~<25%为1分,25%~<50%为2分,≥50%为3分。将着色强度评分与着色细胞数量评分相乘,作为H3K27me3表达水平的判读依据:0~2分为低表达,3~9分为高表达。
1.3 样本量估计
本研究为病例对照试验,依据胃癌组织及正常胃黏膜组织中H3K27me3高表达率进行样本量估算。查阅文献,H3K27me3在胃癌中高表达率为56.4%~80.3%,癌旁正常胃黏膜中为7.25%~25%[16- 17]。双侧检验,α=0.05,β=0.1,两组样本量比例为1∶1,经计算两组最低样本量均为51例。
1.4 统计学处理
采用SPSS 23.0软件进行统计学分析。符合正态分布的计量资料(年龄、肿瘤最大径)以均数±标准差表示,H3K27me3表达情况及组织学分级、分化程度等计数资料,以频数和/或百分数表示。不同组织或不同病理特征之间H3K27me3高表达率的比较采用卡方检验或Fisher精确概率法。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共入选符合纳入和排除标准的藏族胃癌患者54例,藏族非胃癌患者55例。胃癌患者中,男性37例、女性17例;年龄(54.8±9.2)岁(范围:27~70岁);肿瘤最大径(4.0±1.8)cm(范围:0.9~9.2 cm);早期胃癌10例(18.5%),中晚期胃癌44例(81.5%);组织学分级:中-高分化腺癌23例(42.6%),低分化腺癌/印戒细胞癌31例(57.4%);Lauren分型:肠型21例(38.9%),弥漫型18例(33.3%),混合型15例(27.8%);神经侵犯34例(63.0%);脉管侵犯23例(42.6%);淋巴结转移阳性38例(70.4%);TNM分期:Ⅰ~Ⅱ期26例(48.1%),Ⅲ~Ⅳ期28例(51.9%)。
2.2 不同组织中H3K27me3表达水平比较
H3K27me3定位于细胞核,其阳性表达时细胞核呈棕黄色颗粒状着色,细胞膜和细胞质不着色(图1~3)。免疫组化结果显示,胃癌组织中H3K27me3低表达19例(35.2%,19/54),高表达35例(64.8%,35/54);癌旁正常胃黏膜组织中,H3K27me3低表达38例(70.4%,38/54),高表达16例(29.6%,16/54);非胃癌患者正常胃黏膜组织中,H3K27me3低表达36例(65.5%,36/55),高表达19例(34.5%,19/55)。

图1 H3K27me3蛋白在胃癌组织中表达的免疫组化图(EnVision,×200)
卡方检验显示,胃癌组织中H3K27me3高表达率高于癌旁正常胃黏膜组织(P<0.001)和非胃癌患者正常胃黏膜组织(P=0.002),H3K27me3高表达率在癌旁正常胃黏膜组织与非胃癌患者正常胃黏膜组织之间无显著差异(P=0.683)。
2.3 H3K27me3表达水平与胃癌患者临床与病理特征的相关性
H3K27me3表达水平在不同年龄、性别及Lauren分型、分化程度、浸润深度胃癌患者之间均无显著差异(P均>0.05),见表1。
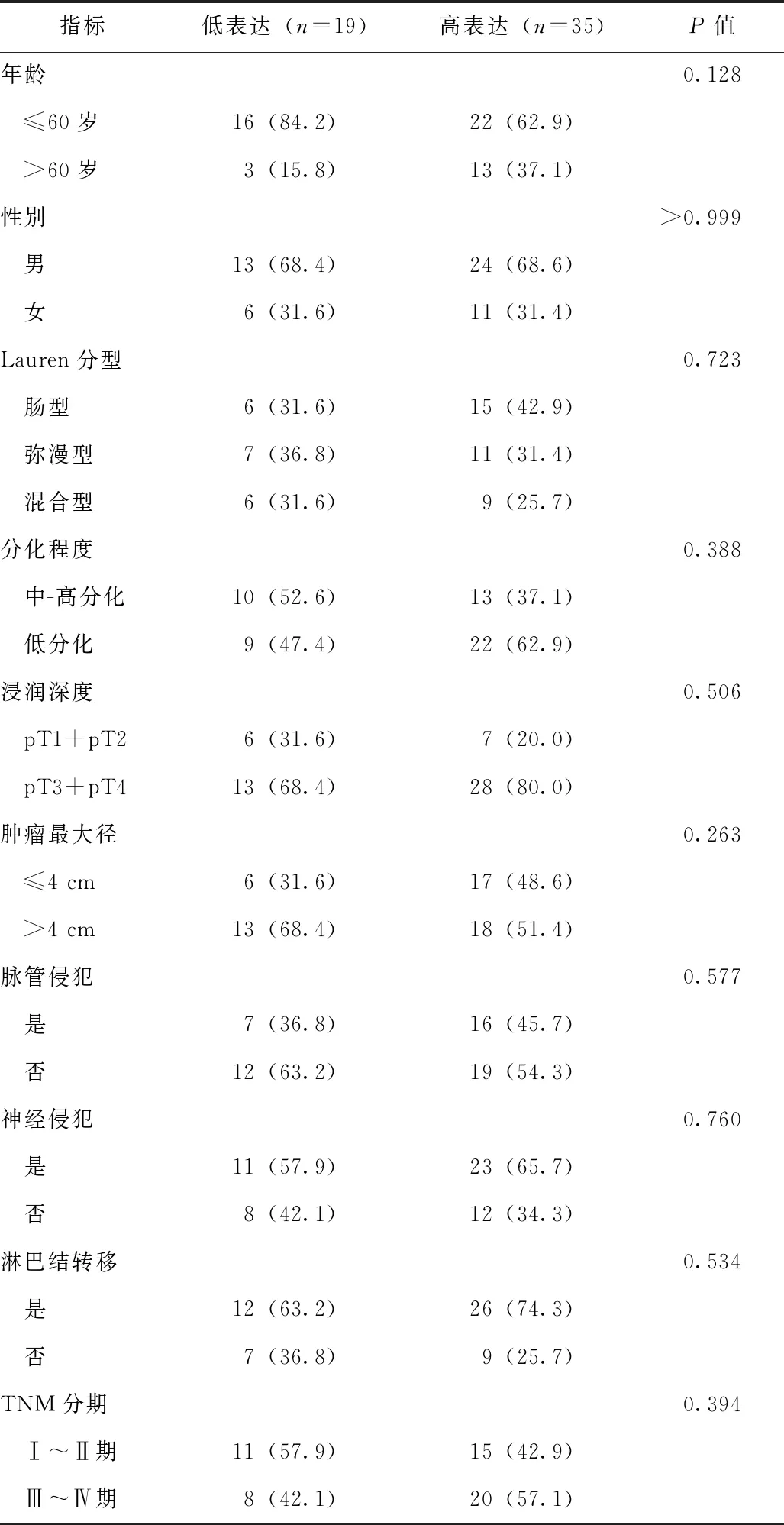
表1 不同临床与病理特征西藏地区藏族胃癌患者H3K27me3表达情况比较[n(%)]
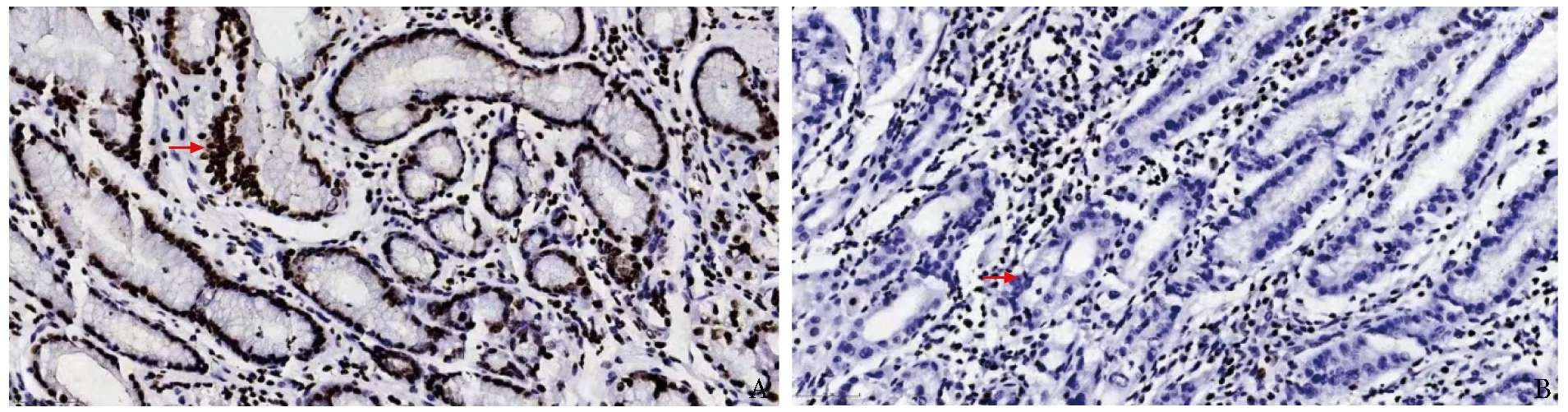
图2 H3K27me3蛋白在癌旁正常胃黏膜组织中表达的免疫组化图(EnVision,×100)

图3 H3K27me3蛋白在非胃癌患者正常胃黏膜组织中表达的免疫组化图(EnVision,×100)
3 讨论
作为一种组蛋白修饰因子,探索H3K27me3与肿瘤的关系可为该疾病的诊治提供新思路。鉴于西藏为胃癌高发区,本研究对西藏地区藏族人群中H3K27me3表达水平及其与病理特征的相关性进行了初步分析,结果显示相较癌旁正常胃黏膜组织(29.6%)和非胃癌患者正常胃黏膜组织(34.5%),藏族居民胃癌组织中H3K27me3高表达率(64.8%)显著升高,但其表达水平与临床及病理特征无明显相关。
H3K27me3是一种与基因抑制密切相关的修饰蛋白,由多梳抑制复合物2(polycomb repressive complex 2,PRC2)所产生。PRC2由果蝇Zeste 基因增强子同源物2(enhancer of Zeste homolog 2,EZH2)、胚胎外胚层发育蛋白(embryonic ectoderm development,EED)及Zeste基因抑制子基因12(suppressor of zeste gene 12,Suz12)三部分核心亚基组成,任一组分改变(如EZH2过表达或功能改变,EED突变等)均可能导致H3K27me3表达失衡,进而影响细胞增殖和分化过程[18],诱导肿瘤发生发展[19]。对文献进行系统检索后发现6篇胃癌组织中H3K27me3表达变化的报道[11- 13,16- 17,20]。Zhang等[11]通过染色质免疫共沉淀联合芯片技术检测了胃癌患者不同基因中H3K27me3表达水平,结果显示与正常胃黏膜比较,胃癌组织128种基因存在H3K27me3差异性表达,其中119种基因表达升高,9种基因表达降低;128种基因包括癌基因、肿瘤抑制基因、凋亡调节基因、蛋白转录和合成基因以及DNA修复基因等,认为H3K27me3可作为基于表观遗传学机制胃癌治疗的潜在生物标志物或有前景的治疗靶点。Huang等[12]整合了芯片技术与生物信息分析结果,以探索胃腺癌的发生机制,结果证实胃腺癌差异性表达基因主要由H3K27me3所调控,进一步验证了该蛋白在胃癌进展中发挥的重要作用。He等[17]基于117例患者的资料比较了胃癌组织与癌旁组织中H3K27me3表达差异,结果显示前者的H3K27me3阳性率显著升高(56.4%比7.25%)。Li等[13]研究得到了类似结果,相较癌旁正常组织,胃癌组织中H3K27me3表达强度显著增高(7.338±0.228比6.034±0.234,P<0.001)。本研究免疫组化结果支持上述结论[13,16- 17,20],再次验证H3K27me3高表达参与了胃癌发生的调控。
针对H3K27me3表达率与胃癌患者临床及病理特征的相关性,研究者亦进行了多方面探索。高福利等[16]对61例胃癌患者的临床资料总结后发现,H3K27me3阳性表达与肿瘤直径、浸润深度、淋巴结转移、血管侵犯、TNM分期等均具有相关性,而与分化程度无相关性。张宁等[20]则认为,胃癌组织H3K27me3阳性表达率仅与淋巴结转移呈正相关,与患者性别、年龄等临床资料及肿瘤直径、浸润深度、Lauren分型、分化程度、TNM分期等病理资料均无显著相关性。He等[17]将免疫组化结果与临床、病理资料相结合后发现,H3K27me3表达水平与肿瘤T分期及临床分期均呈正相关,与分化程度、远处转移及淋巴结转移状况无相关性;多因素Cox回归分析显示H3K27me3高表达是胃癌患者预后不良的独立预测因子。根据上述多项研究报道可明确,胃癌组织中H3K27me3水平与多种病理特征相关,其高表达提示患者预后不良,不同研究之间结果不完全一致,可能与胃癌分期或H3K27me3测定方法不同有关。本研究暂未发现H3K27me3表达水平与胃癌患者临床及病理特征具有相关性,可能与样本量较小或H3K27me3表达谱存在民族、地域差异有关。
虽然本研究是目前在西藏地区藏族胃癌患者中检测H3K27me3表达变化样本量最大的研究,但亦存在局限性:(1)为回顾性研究,可能存在信息偏倚;(2)未进行多因素分析,H3K27me3表达水平与胃癌患者病理特征的相关性仍需进一步验证。
综上,西藏地区藏族人群胃癌组织中H3K27me3表达水平显著增高,为胃癌分子机制的研究提供了新思路,并为以组蛋白修饰酶为靶点的新型抗肿瘤药物的研发提供了客观依据。H3K27me3表达水平与藏族胃癌患者病理特征的相关性仍有待多中心、前瞻性、大样本研究进一步阐明。
作者贡献:罗含欢负责试验设计、免疫组化结果判读及论文撰写;师杰负责免疫组化结果判读和论文修订;杨旭进行数据统计学分析;边巴扎西、尼玛卓玛、王倩、王寒、廖瑞倩、次仁曲珍、李梅负责临床病理资料收集、免疫组化制片。
利益冲突:所有作者均声明不存在利益冲突
