m6A修饰的LncRNA对宫颈癌预后及免疫治疗反应评估的价值
2022-12-05郭依琳林钰博白洋洋王武亮
郭依琳,林钰博,白洋洋,赵 虎,王武亮
1)郑州大学第二附属医院妇产科 郑州 450014 2)桂林医学院临床医学系 广西桂林 541199 3)河南省中医院泌尿外科 郑州 450002
随着宫颈癌筛查的逐步开展及HPV疫苗的普及,更多的早期宫颈癌被发现,然而仍有部分宫颈癌患者在首诊时便被确诊为晚期,晚期转移性及复发性宫颈癌预后差,患者生活质量低[1-2]。寻找新的、有效的治疗方案是目前临床需要解决的问题。近年来,针对程序性死亡受体-1(programmed cell death-1,PD-1)及其配体的免疫检查点抑制剂开始应用于晚期转移性及复发性肿瘤,然而由于肿瘤免疫微环境的差异,不同患者免疫治疗效果差别较大[3-4]。
N6-甲基腺嘌呤(N6-methyladenosine,m6A)是腺嘌呤第六位氮原子受甲基转移酶催化作用形成的甲基化修饰[5],受甲基转移酶、去甲基酶和m6A读取蛋白三类相关分子的可逆调控[6]。m6A修饰已被证实参与多种肿瘤细胞的增殖、侵袭和转移[7]。有研究[8]发现,甲基转移酶METTL3可以通过靶向HK2,招募m6A读取蛋白YTHDF1,稳定其表达,从而促进宫颈癌的发生发展。长链非编码RNA(long noncoding RNA,LncRNA)由200多个通常不编码蛋白质的核苷酸组成,参与转录和转录后修饰、染色体重构、表观遗传调节等生物过程[9],同样受到m6A修饰的调控。有研究[10]发现LncRNA GAS5-AS1可以与去甲基酶ALKBH5结合,减少GAS5的m6A修饰,抑制宫颈癌的增殖和侵袭。然而,与m6A相关的LncRNA(m6A-LncRNA)在宫颈癌中的作用机制仍不明确。本研究利用癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库,建立基于m6A-LncRNA的风险评分,构建宫颈癌预后预测模型,以期为宫颈癌的预后和免疫治疗反应评估提供参考。
1 资料与方法
1.1 数据获取从TCGA数据库(http://cancergenome.nih.gov/)下载304例宫颈癌病例的RNA表达数据和临床资料,下载时间为2021年11月29日。病例纳入标准:有完整的RNA表达数据,有完整的生存时间数据。排除重复数据。使用R(v4.1.2)中的Create Data Partition函数从304例中随机抽取184例作为验证集。
1.2 m6A-LncRNA的筛选选择25个公认的m6A调节因子,包括8个甲基转移酶(METTL3、METTL5、METTL14、METTL16、WTAP、ZC3H13、RBM15、RBM15B),14个读取蛋白(YTHDC1、YTHDC2、YTHDF1、YTHDF2、YTHDF3、HNRNPC、FMR1、LRPPRC、HNRNPA2B1、IGF2BP1、IGF2BP2、IGF2BP3、ELAVL1、RBMX)和3个去甲基酶(FTO、ALKBH5、ALKBH3)。利用人类参考基因组及注释文件区分RNA表达数据中的mRNA和LncRNA。对304个病例m6A调节因子和LncRNA的表达量进行Pearson相关分析,参考文献[11-12],选择“相关系数>0.35或<-0.35,P<0.05” 的LncRNA为m6A-LncRNA。使用R中的igraph包绘制m6A-LncRNA共表达网络图。
1.3 宫颈癌预后相关m6A-LncRNA的筛选以304例为数据集,利用R中的survival包,以筛选出的m6A-LncRNA表达水平作为自变量,以死亡为终点事件,通过Cox回归分析,筛选出与宫颈癌总生存密切相关的m6A-LncRNA。
1.4 基于m6A-LncRNA的宫颈癌风险评分的建立以304例为数据集,以筛选出的m6A-LncRNA表达水平作为自变量,以死亡为终点事件,通过LASSO筛选变量,建立Cox回归模型。风险评分=∑LncRNAi的回归系数×LncRNAi表达量。
1.5 基于风险评分的宫颈癌预后预测模型的构建在304例中,筛除临床信息不完整者,最终纳入266例作为建模数据集构建预测模型。以年龄、组织学分级、临床分期和风险评分作为自变量,以死亡为终点事件,采用Cox回归筛选影响宫颈癌预后的影响因素,然后在回归结果的基础上构建预后预测模型,绘制宫颈癌1、3和5 a生存率预测列线图。
从验证集的184例中,筛除临床分期和风险评分数据不完整者,最终纳入181例用于模型验证。在建模数据集和验证集中,分别通过C指数、ROC曲线和校准曲线对列线图的判别和校准能力进行评估。为了缩小偏差,上述分析均经Bootstrap法重复进行1 000次。检验水准α=0.05。
1.6 肿瘤浸润免疫细胞和免疫表观评分(immunopheno score,IPS)分析采用CIBERSORT反卷积算法对304例病例中的22种肿瘤浸润免疫细胞转录特征进行模拟计算。从癌症免疫组图谱(The Cancer Immunome Atlas,TCIA)数据库(https://tcia.at/)中下载304例的IPS[13],下载时间为2021年12月8日。以风险评分的中位数作为界值,将304例分为高风险和低风险组,采用两独立样本t检验比较两组免疫细胞比例和IPS的差异,检验水准α=0.05。
2 结果
2.1 宫颈癌病例一般资料304例宫颈癌病例和184例验证集病例的一般资料见表1。两个数据集的基线特征,如年龄、人种、临床分期、组织学分级等,差异均无统计学意义。
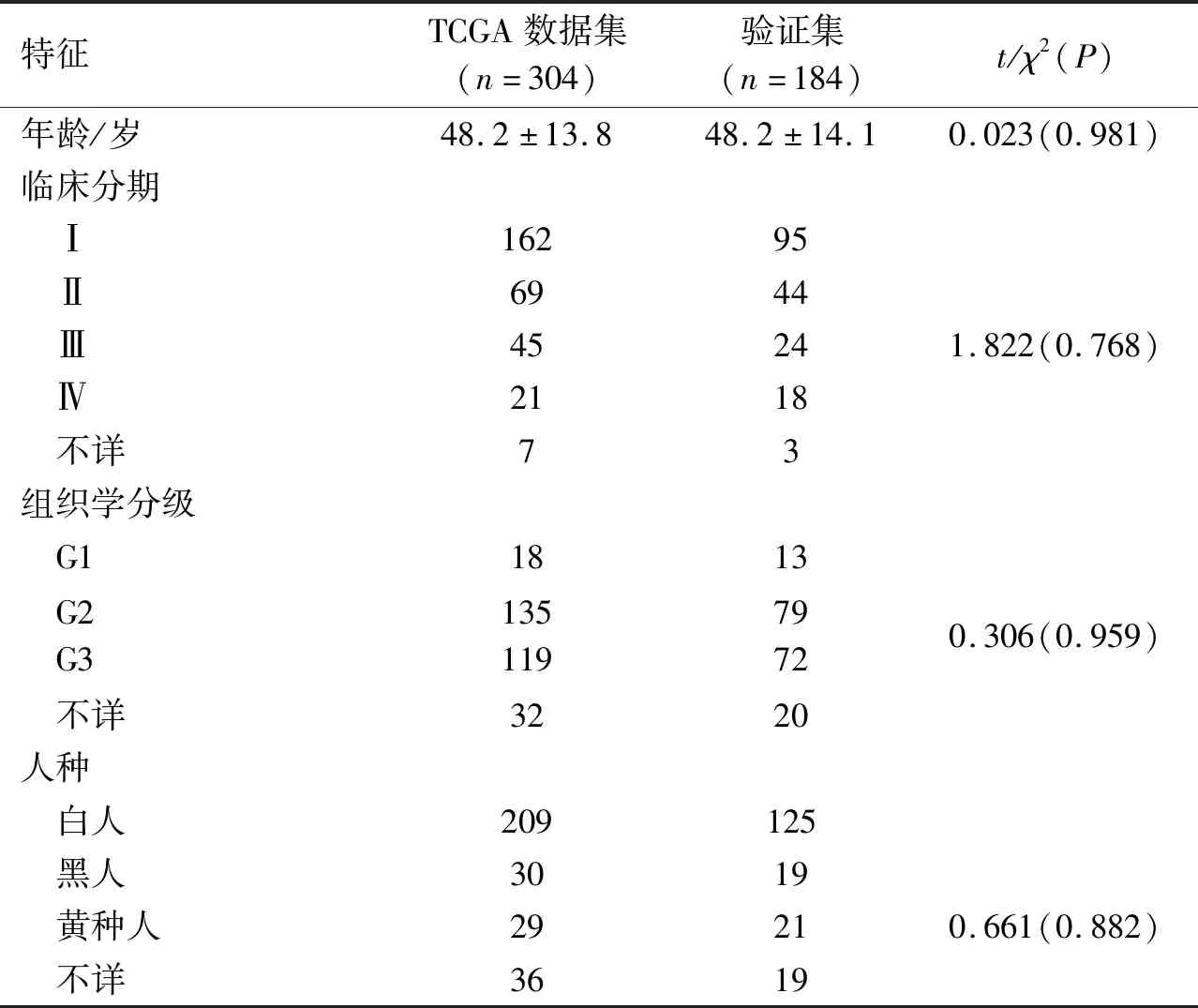
表1 宫颈癌病例一般特征 例
2.2 预后相关m6A-LncRNA的筛选在304例宫颈癌病例中,共鉴定出200个m6A-LncRNA,共表达网络图见图1。通过Cox回归分析,筛选出14个宫颈癌预后相关m6A-LncRNA(表2)。
2.3 基于m6A-LncRNA的宫颈癌风险评分经过筛选,最终构建的风险评分包含11个m6A-LncRNA。风险评分=FAM198B-AS1×0.133-AC233728.1×0.136-AL021707.6×0.053-AC131159.1×0.603+DDN-AS1×0.561+AC099850.4×0.002-DDX11-AS1×0.070-U62317.4×0.030+LINC02802×0.322+AC015922.2×0.077-EP300-AS1×0.145,其中LncRNA名称表示该RNA的表达水平。
2.4 宫颈癌预后预测模型的建立在建模数据集中,经过Cox回归分析,最终筛选出临床分期和风险评分是宫颈癌预后影响因素,基于这2个变量构建预后预测模型(表3),绘制列线图(图2)。

图1 m6A调节因子和LncRNA共表达网络图
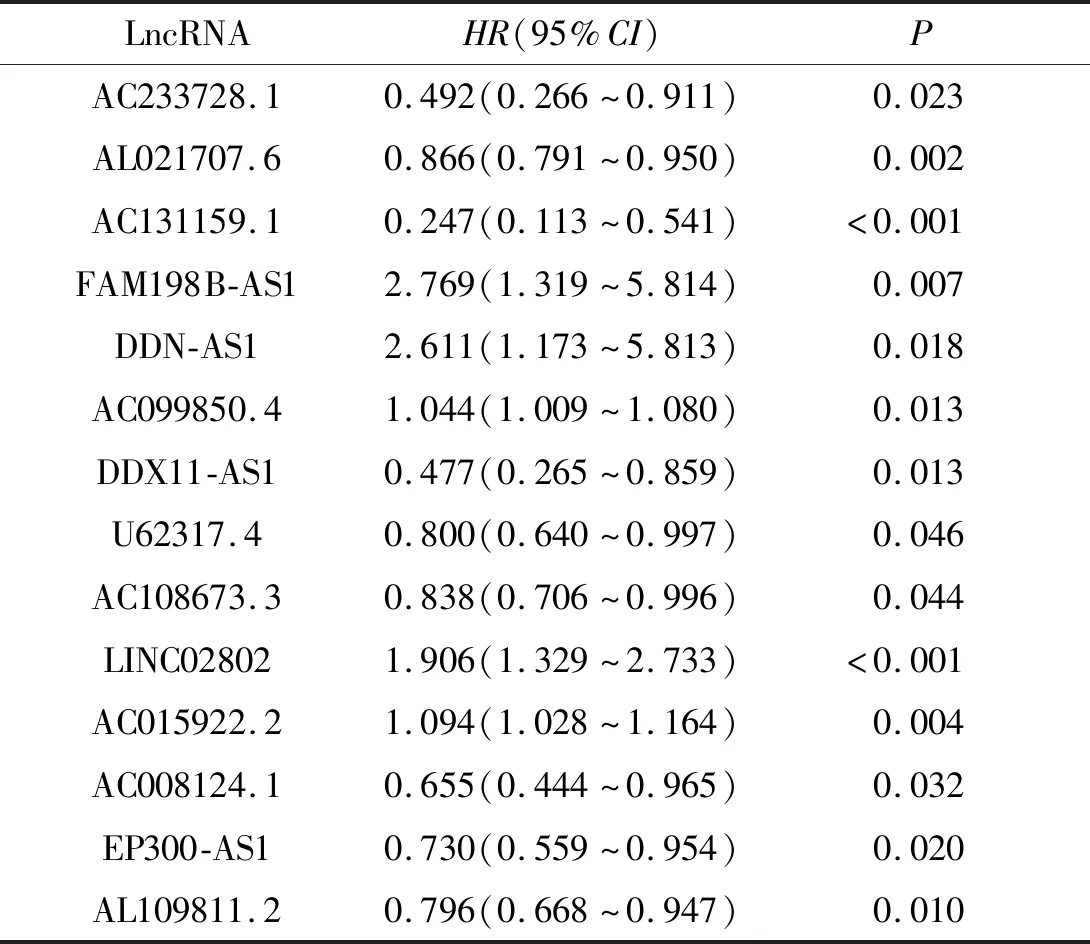
表2 通过Cox回归分析获得的14个宫颈癌预后相关m6A-LncRNA
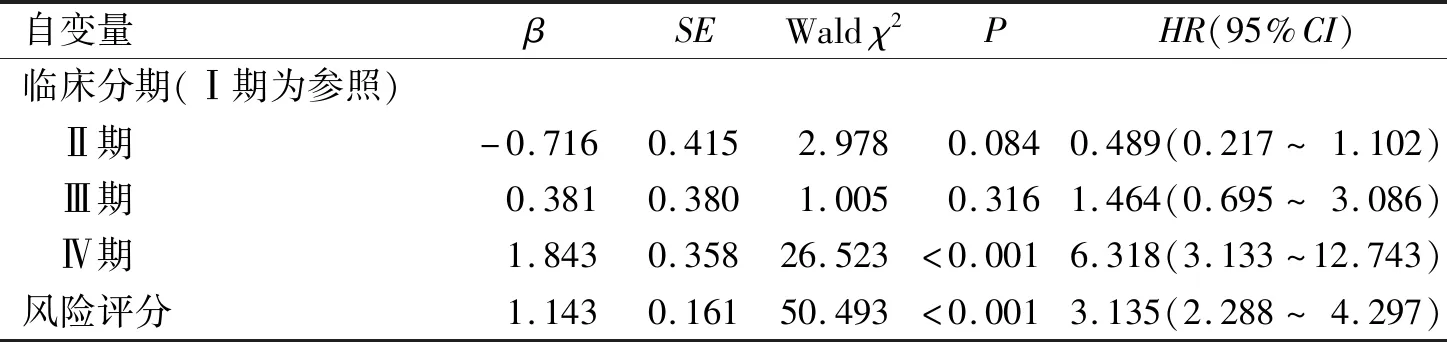
表3 宫颈癌预后预测模型的Cox回归结果

图2 宫颈癌预后预测的列线图
2.5 列线图预测效能的评价在建模数据集中,宫颈癌预后列线图的C指数(95%CI)为0.764(0.759~0.769),Bootstrap法内部验证后C指数为0.753。利用该模型对1、3和5 a生存预测的ROC曲线下面积(95%CI)分别为0.792(0.667~0.918)、0.777(0.686~0.867)和0.755(0.653~0.857)。在验证集中,宫颈癌预后预测模型的C指数为(95%CI)为0.775(0.770~0.780),Bootstrap法内部验证后C指数为0.755。利用该模型对1、3和5 a生存预测的ROC曲线下面积(95%CI)分别为0.806(0.682~0.930)、0.817(0.730~0.905)和0.822(0.716~0.927)。在建模数据集和验证集中,校正曲线显示1、3和5 a的预测结果与实际结果相关性良好(图3)。

图3 在建模数据集(A、B、C)和验证集(D、E、F)中列线图预测的校准曲线
2.6 基于m6A-LncRNA的风险评分与免疫微环境的关系高风险组和低风险组22种肿瘤浸润免疫细胞丰度的比较见图4。低风险组CD8+T细胞、调节T细胞和未活化的肥大细胞比例更高,而高风险组中M0巨噬细胞和活化的肥大细胞比例更高。低风险组PD-1+CTLA-4-和PD-1+CTLA-4+IPS均高于高风险组(表4)。

图4 两组22种肿瘤浸润免疫细胞丰度的比较
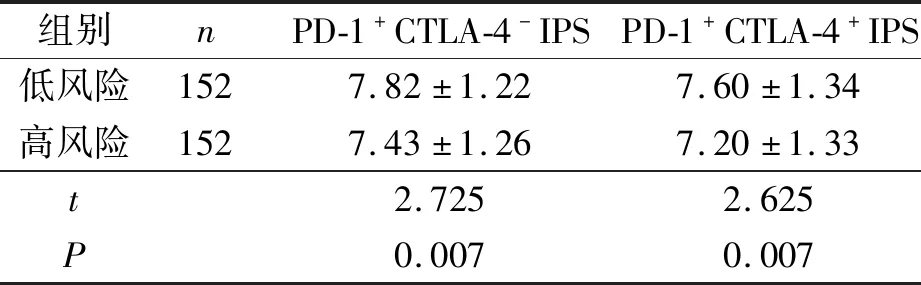
表4 高、低风险组IPS的比较
3 讨论
m6A甲基化修饰是最常见的RNA修饰,在肿瘤的增殖、侵袭和转移中具有重要作用[7]。对于LncRNA的m6A修饰已在多种肿瘤,如乳腺癌、胃癌、肝癌等中被发现与肿瘤进展相关[14]。然而,m6A-LncRNA在宫颈癌中的作用机制尚不明确。本研究从TCGA数据库中下载304例宫颈癌病例的转录组数据和对应的临床信息,利用生物信息学方法,基于m6A-LncRNA建立了宫颈癌风险评分,利用风险评分与临床特征构建宫颈癌预后预测的列线图,通过C指数、ROC曲线和校准曲线对列线图的判别和校准能力进行评估;同时,比较了高低风险组肿瘤浸润免疫细胞表达和IPS的差异,以期对宫颈癌的免疫治疗指导提供理论依据。
本研究从25个公认的m6A调节因子中最终筛选出11个m6A-LncRNA(AM198B-AS1、AC233728.1、AL021707.6、AC131159.1、DDN-AS1、AC099850.4、DDX11-AS1、U62317.4、LINC02802、AC015922.2、EP300-AS1)用于构建宫颈癌风险评分。Liu等[15]发现DDN-AS1在宫颈癌中高表达,DDN-AS1可通过miR-15a/16-TCF3信号通路促进宫颈癌细胞的增殖和转移。Ye等[16]发现LINC02802是免疫相关LncRNA,可以用作宫颈癌预后标志物,并为免疫治疗选择提供参考。DDX11-AS1在多种恶性肿瘤中异常高表达,如肝癌、结直肠癌、骨肉瘤、膀胱癌、非小细胞肺癌和胃癌,通过直接或间接方式调控相关基因的表达,发挥其致癌作用[17]。U62317.4可能与肿瘤自噬相关,并被用于乳腺癌和膀胱癌预后风险模型的构建[18-19]。Zhao等[20]发现AC099850.4是高级别浆液性卵巢癌细胞的核心调控因子,参与多种调控机制。AC015922.2在肾透明细胞癌中表达下调,低表达肾透明细胞癌患者总生存期和无病生存期均缩短[21]。AL021707.6可能参与自发中性粒细胞凋亡的调节[22]。FAM198B-AS1、AC131159.1、AC233728.1和EP300-AS1是新发现的LncRNA,未见相关文献报道。
本研究利用Cox回归构建了一个包括临床分期和风险评分的宫颈癌预后预测模型并绘制了1、3和5 a生存预测的列线图。在建模数据集和验证集中,该列线图的C指数经Bootstrap法内部验证后分别达0.753和0.755,1、3和5 a生存预测的ROC曲线下面积均大于0.7,校准曲线显示预测的生存率与实际生存率有着较好的一致性。这表明该列线图预测价值较高,有助于高危宫颈癌患者的识别和个体化治疗策略的建立。
宫颈癌的免疫治疗发展迅速,其通过调节并激活人体自身的免疫系统杀灭肿瘤组织[2]。肿瘤免疫微环境中免疫细胞浸润程度与疗效相关,免疫细胞浸润程度越高,免疫抑制剂治疗效果越好[23]。本研究对基于m6A-LncRNA的宫颈癌风险评分高、低风险组22种肿瘤免疫细胞的浸润水平进行了比较,结果显示低风险组富含CD8+T细胞、调节T细胞和未活化的肥大细胞,而高风险组中富含M0巨噬细胞和活化的肥大细胞。目前针对PD-1和CTLA-4的免疫治疗药物已被批准用于治疗不同类型的肿瘤。本研究还发现低风险组PD-1+CTLA-4-和PD-1+CTLA-4+IPS均高于高风险组。上述结果提示低风险患者具有更高的免疫原性,其肿瘤免疫微环境为免疫炎症型,又称为“热肿瘤”,可能对免疫检查点抑制剂治疗更敏感,预后更好。
本研究从TCGA数据库中获取国外的病例数据构建模型,该模型是否适用于中国人,还有待进一步的深入研究。另外,部分所筛选的LncRNA尚未在基础实验层面得到验证。尽管存在一定的不足,但本研究基于11个m6A-LncRNA建立的宫颈癌风险评分和宫颈癌预后预测列线图可为宫颈癌预后和免疫治疗反应评估提供参考。
