类生理循环流动下血管内皮细胞生理特征的微流控芯片记录
2022-12-05张胜叶户富栋郭胜存李云鹏桑海强
张胜叶,户富栋,郭胜存,李云鹏,程 栋,汤 毅,桑海强
郑州大学第一附属医院心血管内科 郑州 450052
血管内皮细胞处于循环流动的体液环境中,血流剪切力对维持内皮细胞形态和功能起重要作用[1-2]。传统的血管内皮细胞培养方法是在静止培养皿或培养瓶中培养,无法分析流体剪切力的作用,实验结果的解析与应用转化受到影响。后来发展起来的微流控芯片和流体泵,提供不同的流体剪切力,使细胞能够在流动状态下的3D环境中培养,促进了医学研究的发展。然而目前微流控通道横截面多数是矩形,主要应用注射泵和蠕动泵提供流体剪切力,不符合体内血管形状和生理流体剪切力的特点[3-4]。在应用脉冲泵(模拟心脏的脉冲式搏动)的研究[5-6]中,微通道内表面仍多数是矩形横截面。本实验利用自制的圆形横截面微通道,用脉冲泵提供不同流体剪切力,模拟体内血管形状(小动脉)和脉冲式搏动,研究血管内皮细胞在类生理循环流动下的生理特征,尤其是抗凝与抗氧化特性。
1 材料与方法
1.1 材料弹性硅胶(美国Dow Corning公司),固化剂、胶原蛋白-I、DMEM培养基、青霉素、链霉素(美国Thermo Fisher Scientifc公司),戊二醛(瑞士Sigma Aldrich公司),体积分数10%胎牛血清(德国Biochrom公司),内皮细胞生长因子(美国PromoCell公司),血小板-内皮细胞黏附分子CD31(美国R&D公司),血管内皮细胞钙黏连蛋白(VE-cadherin,美国Santa Cruz公司),血管性血友病因子(vWF,丹麦Dako公司),硫酸乙酰肝素(HS,西班牙Amsbio公司),成纤维细胞特异性蛋白-1(FSP-1,英国Abcam公司),超氧化物歧化酶1(SOD1,美国Pierce公司),罗丹明鬼笔环肽[标记F-肌动蛋白(F-actin),美国Cytoskeleton公司],反转录试剂盒、RNA提取试剂盒(日本TAKaRa公司),引物、RT试剂盒、荧光定量PCR试剂盒(美国Applied Biosystems公司),脉冲泵Miniplus 3(法国Gilson公司)。
1.2 原代血管内皮细胞的分离与鉴定采用机械方法分离猪主动脉内皮细胞(瑞士伯尔尼大学医学临床研究中心赠予),具体如下:用D-Hank′s液冲洗主动脉,无菌条件下沿纵轴剪开,使血管内皮朝上向外暴露,用棉签沿一定方向轻轻擦拭血管内表面(忌返回擦拭)。用DMEM培养液将棉签擦拭的细胞收集到离心管,以1 000 r/min离心5 min,去除上清液。将一部分细胞转移到纤连蛋白包被的T25培养瓶,一部分转移到6孔培养板,置于37 ℃、体积分数5%CO2细胞培养箱中培养,每12 h换培养液。培养液为DMEM液+体积分数10%胎牛血清+0.1 IU/L青霉素+0.1 μg/L链霉素+4 mg/L内皮细胞生长因子。采用免疫荧光染色检测内皮细胞标志物CD31、VE-cadherin、vWF表达,以FSP-1来排除成纤维细胞污染。取第3~5代细胞用于本实验。
1.3 圆形横截面微通道的制备与内表面修饰将弹性硅胶与固化剂按照质量比10∶1配制聚二甲基硅氧烷(PDMS)。以内径550 μm无菌针头为模具,内径120 μm无菌针头作为底部支持,将两者垂直交叉放置于PDMS内,经过60 ℃烤箱加热固化过夜,裁出PDMS芯片,均匀用力拔出针头,打孔制作微通道出入口,清洗干净后在氧气等离子体机将芯片-载玻片黏合一起。然后进行微通内表面化学修饰,紫外线消毒。
1.4 微流控芯片体系的构建在细胞生长达85%~90%融合时,胰蛋白酶消化、离心、计数,按照2×106个/mL细胞密度接种于微通道内,缓慢旋转45 min后静置培养,于12 h更换培养液。在细胞培养24 h时,连接脉冲泵系统。首先在5 r/min转速下,以蒸馏水、PBS、40 g/L葡聚糖DMEM培养液分别冲洗高压消毒灭菌后的硅胶管。然后将两端带有固定端的硅胶管固定于脉冲泵通道内,通过连接器连接另外的硅胶管作为延长管,一端连接于15 mL离心管作为灌流液池,另一端插入微通道入口,在微通道出口连接另一根硅胶管,通入灌流液池。
1.5 血管内皮细胞在微流控芯片体系的培养从0.5 r/min开始,第1 h增加0.5 r/min,以后每1 h增加1 r/min,直至目标流体剪切力达1、5、10、15 dyn/cm2,每24 h更换灌流液,维持循环培养2~3 d。
1.6 血管内皮细胞生长顺应性的评估根据内皮细胞在微通道内的生长形状和特性,利用Image J软件计算内皮细胞长轴与灌流液方向之间的夹角,评估内皮细胞在一定流体剪切力下的生长顺应性,每组重复3次。
1.7 免疫荧光染色检测血管内皮细胞生理特性指标取出微流控芯片,常规免疫荧光染色,在荧光显微镜和共聚焦显微镜下观察内皮细胞标志物CD31、VE-cadherin、vWF,以及细胞骨架蛋白F-actin、HS、SOD1表达,应用Image J软件分析CD31、F-actin在微通道正交视图和体积视图上的立体分布特点。实验重复3次。
1.8 血管内皮细胞SOD1 mRNA表达水平的qRT-PCR检测将微通道内细胞按照Trizol说明书进行裂解,提取细胞总RNA,分光光度计法测定并计算提取的总RNA含量与浓度。按照反转录试剂盒说明书将总RNA反转录成cDNA,SOD1及内参β-actin引物序列见表1,退火温度均为60 ℃。按定量PCR试剂盒说明进行操作,取20 μL反应体系进行PCR,取2 μL反转录产物与SOD1及内参β-actin引物进行PCR,反应条件:预变性95 ℃10 min;95 ℃15 s、60 ℃ 20 s、72 ℃ 32 s,40个循环。采用2-ΔΔCt法计算SDO1 mRNA的相对表达量。实验重复3次。

表1 引物序列和产物长度
1.9 统计学处理采用Graphpad Prism 7进行数据分析。在流体剪切力分别为0、1、5、10、15 dyn/cm2时,内皮细胞长轴与灌流液方向之间夹角的比较采用单因素方差分析,两两比较采用Bonferroni法;在类生理流体剪切力(15 dyn/cm2)和静止状态下培养内皮细胞时,HS荧光强度、SOD1荧光强度、SOD1 mRNA相对表达量的比较采用两独立样本t检验。检验水准α=0.05。
2 结果
2.1 原代血管内皮细胞的鉴定免疫荧光染色结果提示CD31、VE-cadherin、vWF均正常表达在内皮细胞,其中CD31和VE-cadherin主要表达在内皮细胞间的紧密连接处,vWF主要表达在W-P小体内。同时FSP-1染色阴性,排除了成纤维细胞的污染(图1)。

A:CD31;B:VE-cadherin;C:vWF;D:FSP-1
2.2 流体剪切力对血管内皮细胞顺应性的影响在静止状态下,内皮细胞呈梭形、多角形、类椭圆形等不规则形状,排列杂乱无序;在流体剪切力逐渐增大的情况下,内皮细胞长轴逐渐出现与灌流液流动方向一致的趋势,由原来无序的不规则形状逐渐转变为长梭形,排列整齐(图2),内皮细胞长轴与灌流液流动方向之间的夹角逐渐变小(表2)。在15 dyn/cm2时夹角最小,确定此为模拟体内生理状态的最佳流体剪切力。
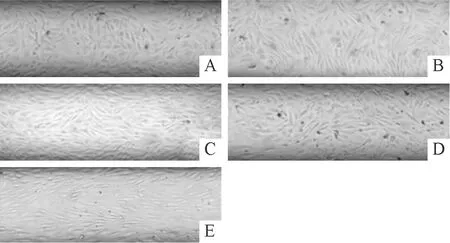
A、B、C、D、E:流体剪切力分别为0、1、5、10、15 dyn/cm2

表2 各组内皮细胞长轴与灌流液流动方向之间的夹角比较
2.3 血管内皮细胞标志物在类生理循环流动下的表达特点结果见图3。在静止状态下,内皮细胞标志物CD31、VE-cadherin、vWF表达无方向性。而在类生理循环流动下,内皮细胞均匀覆盖于微通道内表面,形成一层单细胞层,CD31、VE-cadherin、vWF表达具有方向性,均与微通道内灌流液流动方向一致;其中CD31在正交视图XY、XZ、YZ方向均匀分布并表达在内皮细胞紧密接处,在体积视图上可见CD31在部分圆形横截面微通道内的立体展示。

A:CD31;B:VE-cadherin;C:vWF;1:静止状态;2:类生理循环流动状态;3:XY方向;4:XZ方向;5:YZ方向;6:体积视图
2.4 F-actin在类生理循环流动下的表达特点在静止状态下,F-actin大量表达于内皮细胞丝状纤维骨架上,没有方向性;而在类生理循环流动下,F-actin与微通道内灌流液流动方向一致;在正交视图XY、XZ、YZ方向均匀分布并表达于内皮细胞纤维骨架上,在体积视图上可见F-actin在部分圆形横截面微通道内的立体展示(图4)。
2.5 HS在类生理循环流动下的表达特点在静止状态下,HS在内皮细胞的表达微弱,荧光染色弱;而在类生理循环流动下,HS表达增多,荧光染色强于静止状态,且其表达具有方向性,与微通道内灌流液流动方向一致(图5和表3)。

A:静止状态;B:类生理循环流动状态;C:XY方向;D:XZ方向;E:YZ方向;F:体积视图
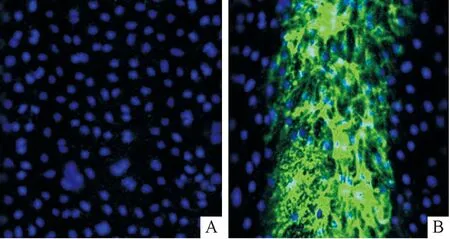
A:静止状态;B:类生理循环流动状态

表3 静止和类生理循环流动状态下HS荧光强度的比较
2.6 类生理循环流动下SOD1的表达特点及水平在静止状态下,SOD1在内皮细胞的表达微弱,荧光染色淡;而在类生理循环流动下,SOD1表达增多,荧光染色强于静止状态,且其表达具有方向性,与微通道内灌流液流动方向一致(图6和表4)。在类生理循环流动下,SOD1 mRNA表达水平高于静止状态(表4)。

A:静止状态;B:类生理循环流动状态

表4 静止和类生理循环流动状态下SOD1荧光强度及mRNA表达水平的比较
3 讨论
三维立体细胞培养较传统平面培养具有巨大的优越性,可以建立起生理上细胞-细胞或细胞-细胞外基质相互作用,影响细胞的增殖、凋亡与分化,模拟在体组织的天然特性。前期多数微通道研究[7-8]发现内皮细胞生长形状和排列具有剪切力依赖性,但多是在非生理血管形状的矩形横截面微流控芯片得出此结论。本研究利用脉冲泵提供流体剪切力,在圆形横截面微通道内培养内皮细胞,发现内皮细胞具有生长顺应性的改变,由不规则形状逐渐转变为长梭形,生长方向与灌流液流动方向一致。在流体剪切力为15 dyn/cm2时,内皮细胞长轴与灌流液流动方向之间的夹角最小,内皮细胞顺应性达到最佳,依此确定为类生理流体剪切力。进一步分析发现内皮细胞标志物在微通道内表面正常表达,抗凝和抗氧化指标高表达,且与灌流液流动方向一致,表明本实验成功地模拟体内小血管系统,内皮细胞维持其天然的抗凝、抗氧化生理特性。
天然血管内壁具有良好的抗凝特性,主要是由于内皮细胞有一层毛绒状的多糖-蛋白复合结构即糖萼层覆盖,由糖胺聚糖、蛋白聚糖和糖蛋白构成。糖胺聚糖是糖萼中含量最多的成分,主要包括HS、透明质酸等。许多抗凝调节蛋白(C蛋白、S蛋白、组织因子途径抑制剂、抗凝血酶Ⅲ、组织型纤溶酶原激活物、血栓调节素等)、抗氧化应激蛋白(SOD、过氧化氢酶、谷胱甘肽过氧化物酶等)、细胞因子、生长因子等均结合在HS侧链。生理流体剪切力在维持糖萼结构和功能等方面起至关重要的作用,而非脉冲式流体可能导致内皮糖萼层降解[9]。本研究发现,糖萼层HS在类生理循环流动下高表达,且与灌流液流动方向一致。早期微流控芯片研究[10]报道HS可以作为机械传感器,感知流体剪切应力变化,调控内皮细胞大量基因表达,进一步影响新生血管形成。这表明本实验体系成功模拟体内生理流动状态下的内皮细胞,其表面保持大量表达的HS。
天然血管内壁还具有抗氧化功能。SOD是清除氧自由基的代谢酶,主要位于细胞质、线粒体、糖萼层等,能够抑制超氧阴离子自由基对血管内皮细胞的损害、促进血管内皮细胞一氧化氮依赖的血管舒张反应、抑制白细胞在血管内皮的黏附、减轻血管内皮细胞自噬与凋亡等,进而抑制动脉粥样硬化的发生和发展[11-12]。本实验分别在蛋白和mRNA水平上分析SOD1的表达水平,发现其在类生理循环流动下的水平均明显高于静止状态,这与前期研究[13]结果一致。
综上,本研究在类生理循环流动下培养内皮细胞,内皮细胞基本保持其体内内皮细胞的生长特点,并维持其天然的抗凝和抗氧化生理特征,为进一步研究血管内皮细胞的其他生理特性,及内皮损伤、动脉粥样硬化、慢血流、血栓栓塞等病理机制提供良好的体外疾病模型。然而本研究的局限性在于微通道内仅有内皮细胞,无血管平滑肌细胞,灌注液为细胞培养液,未使用生理的血清、血浆、全血,缺乏体内血管所处的内分泌、物质交换等微环境,这些都是将来要进一步提高和完善之处。
