3株酵母菌的分离鉴定及发酵液除草潜力的研究
2022-12-05施生姣宋维敏魏有海
施生姣,宋维敏,程 亮,魏有海
(1.青海大学, 青海 西宁 810016;2.青海省农林科学院, 青海 西宁 810016;3.青海省农业有害生物综合治理重点实验室, 青海 西宁 810016;4.农业农村部西宁作物有害生物科学观测实验站, 青海 西宁 810016;5.青藏高原生物技术教育部重点实验室, 青海 西宁 810016)
0 引言
【研究意义】猪殃殃、密花香薷、藜等杂草是我国农田的重要恶性杂草,繁殖能力强,蔓延扩散快,危害损失重[1-3],生产中依赖化学除草剂控制其危害。由于化学除草剂长期连续使用及不合理使用同种或同类除草剂,导致农田杂草群落演变加速、抗药性杂草生物型数量和程度明显增加、作物药害发生频繁、农产品质量安全以及环境污染加剧等问题凸显[4-5],杂草防治难度不断加大,农药使用量呈上升趋势。杂草生物防控已引起全球环保与植保工程科技人员的高度重视。微生物除草剂具有制作原料来源丰富、开发费用相对较低、对环境和非靶标生物安全等显著优势,其高效利用模式研发及应用对于实现农药减量使用,遏制杂草加重发生的态势,进而实现可持续的现代农业发展具有重要意义。【前人研究进展】自然界中的致病菌是微生物除草剂的来源之一[6],目前已有多个属的真菌被研发或登记成为微生物除草剂,用于多种杂草的生物防治。目前世界范围内商品化的微生物除草剂产品有20余种[7]。我国已成功建立多个病原菌与杂草之间的致病体系[8-9],且研发出具有自主知识产权的微生物除草剂产品,例如鲁宝一号[10]。朱海霞等[11]研究发现镰刀菌GD-5对密花香薷及藜的致病性较强,其鲜重防效可达65%以上。链格孢HZ-1粉剂对密花香薷及藜在田间环境下抑制作用显著[12]。程亮[13]研究发现生防菌PA-2可通过影响猪殃殃的细胞膜透性导致其死亡而达到生物防除的目的,针对猪殃殃、密花香薷和藜等3种杂草的生防菌主要为真菌,可通过孢子直接侵入或产生代谢产物以达到控制杂草的目的。【本研究切入点】酵母菌的次生代谢物生物活性广泛,主要用于食品发酵等[14-16],但目前应用酵母菌进行杂草防除方面的研究鲜见报道。【拟解决的关键问题】本研究通过3株酵母菌对猪殃殃、密花香薷和藜等3个青海省农田优势杂草的生物活性测定及其对青海主要农作物的安全性评价并采用形态学观察结合ITS序列及26S rDNA序列分析明确3株酵母菌的分类地位,丰富了可用于杂草防控的微生物菌种资源,为该菌株在杂草防控中的研发与应用提供基础,可有效减少化学除草剂的使用量,延缓杂草抗药性生物型的产生和发展。
1 材料与方法
1.1 供试材料
杂草:猪殃殃(Galium spuriumL.)、密花香薷(Elsholtzia densaBenth.)、藜(Chenopodium albumL.)种子,于2020年采于青海省农林科学院试验田(36.724 458oN,101.750 661oE)。
作物:燕麦(加燕2号)、小麦(青春38号)、蚕豆(青海13号)、青稞(柴青1号)、油菜(青杂11号)、豌豆(草原26号)和马铃薯(青薯9号)。
酵母菌培养采用酵母浸出粉胨葡萄糖培养基(Yeast Extract Peptone Dextrose Medium,YPD):酵母膏 10.0 g·L-1,蛋白胨 20.0 g·L-1,葡萄糖 20.0 g·L-1,琼脂20.0 g·L-1;酵母菌发酵采用YPD液体培养基。
1.2 土壤酵母菌分离
采用稀释涂布法分离西宁市湟中区温室辣椒根际土壤酵母菌[17]。取90 mL无菌水加入10 g土样,制备成土壤悬浮液后将其稀释至10-3、10-4,吸取200 μL土壤稀释液涂布于YPD培养基平板上,每个处理设置3个重复。于28 ℃培养3~5 d后挑取颜色形态不同的单菌落,在YPD平板上纯化培养并4 ℃保存。
1.3 具有除草潜力酵母菌菌株筛选
将纯化的菌株培养7 d,打取菌饼(直径0.5 cm)接种至YPD液体培养基中(每250 mL三角瓶100 mL YPD),于 25 ℃、180 r·min-1培养 7 d,发酵液真空抽滤后经0.22 μm微孔滤膜过滤备用。将杂草幼苗培育至1叶1心时,选取整齐一致的健壮幼苗移栽至43 cm×25 cm×12 cm花盆中,每盆20株,在温度25 ℃、光照周期12 L/12 D,环境相对湿度60%~70%的条件下培养。待杂草幼苗长至7~10叶期时,取100 mL发酵滤液倒入小喷壶中,加入0.5%吐温-80,将滤液以250 mL·m-2喷施于杂草植株上,喷雾处理后的杂草植株置于上述条件的温室中培养。每处理重复4次,以只喷无菌加等量吐温-80的YPD培养液的植株作为对照。于处理7 d后观察杂草发病情况,参考文献[18]记录密花香薷、藜、猪殃殃的伤害程度。7 d后按下式计算伤害率和鲜重抑制率。

1.4 酵母菌分离菌株对主栽作物安全性测定
将酵母菌株发酵滤液以250 mL·m-2分别喷雾于3~4叶期的马铃薯、青稞、豌豆、小麦、燕麦、蚕豆和油菜上,培养方法同方法1.3。以只接YPD培养液植株为对照,每处理重复4次。7 d后调查作物受害情况,测定株高和鲜重,计算株高抑制率和鲜重抑制率。参考程亮等[19]的方法记载作物受害程度。

1.5 菌株16-8发酵液与氯氟吡氧乙酸混用对猪殃殃的除草活性测定
20%氯氟吡氧乙酸乳油(美国陶氏益农公司)按推荐剂量750、375、187.5 mL·hm-2设置3个单用及和16-8菌株发酵液250 mL·m-2混用处理,以菌株16-8发酵液单用为对照,另设等量清水为空白对照,共计8个处理,每处理10株,每个处理3次重复,随机排列。于猪殃殃3~4叶期进行喷雾处理,记录猪殃殃受害症状,7、14 d后调查鲜重防效。
1.6 菌株鉴定
1.6.1 形态学鉴定 取在YPD平板上培养7 d的酵母菌菌落的孢子,制成临时玻片,显微镜下观察孢子形态并拍照。
1.6.2 分子生物学鉴定 DNA提取采用Ezup柱式提取试剂盒[生工工程(上海)股份有限公司]。用引物 ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和 ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增 ITS 基因序列, 用NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和 NL4 (5′-GGTCCGTGT-TTCAAGACGG-3′)扩增26S rDNA基因序列。PCR反应体系(25 μL):10×PCR buffer(含 Mg2+) 2.5 μL, 模 板 DNA 0.5 μL,dNTPs 1.0 μL,上、下游引物各 0.5 μL(10 μmol·L-1),5 U·μL-1Taq酶 0.2 μL,ddH2O 补足至 25 μL。PCR 反应条件:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。PCR产物进行1.0%琼脂糖凝胶电泳,送至由生工生物工程(上海)股份有限公司进行测序。测序所得序列在NCBI数据库中进行BLAST比对,采用MEGA 7.0软件以邻近法(neighbor-joining,NJ)构建系统发育树。
1.7 数据分析
试验数据采用DPS 15.10软件进行统计分析,显著性检验采用邓肯氏法(P<0.05)。
2 结果与分析
2.1 酵母菌分离及其除草潜力
共获得8株不同形态和颜色的酵母菌,对杂草生长的抑制作用程度不同,其中16-8发酵液对猪殃殃、密花香薷和藜的伤害率分别为90.17%、66.67%和95.00%,鲜重抑制率分别为88.63%、56.90%和78.77%,3种杂草的鲜重均低于对照组,差异显著(P<0.05)(表1);12-6菌株对猪殃殃、密花香薷和藜的伤害率分别为87.50%、75.00%和43.33%,对猪殃殃的鲜重抑制率达75.80%,密花香薷和藜的鲜重抑制率分别为62.72%和43.25%,3种杂草的鲜重与对照组相比,均差异显著(P<0.05);6-3菌株对猪殃殃、密花香薷和藜的伤害率分别为0%、36.67%和41.67%,对3种杂草的鲜重抑制率为9.41%、46.29%和43.46%,猪殃殃和藜的鲜重与对照相比,均差异不显著(P>0.05),但密花香薷鲜重低于对照组,差异显著(P<0.05),从各个分离菌株看,16-8菌株发酵液对猪殃殃和藜幼苗生长的抑制作用要高于12-6和6-3菌株发酵液,但12-6菌株发酵液对密花香薷幼苗生长抑制作用要高于16-8和6-3菌株发酵液。

表1 3株酵母菌菌株发酵液对杂草幼苗生长的抑制作用Table 1 Inhibition effect of yeast fermentation broths on growth of weed seedlings
16-8处理后猪殃殃表现症状为植株矮小、叶片轻微失绿、发黄叶片明显萎蔫,而12-6处理后,猪殃殃植株表现为矮小、叶片轻微失绿发黄、萎蔫、植株茎干变细、分蘖数变少。6-3发酵液处理7 d后,猪殃殃除表现植株叶片轻微萎蔫之外无其他明显症状,10 d以后伤害症状没有恢复,继续加重(图1-A)。12-6处理条件下的密花香薷植株矮小,叶缘干枯新生叶片向内卷曲严重,花苞明显枯焦发黄、叶面积窄小,10 d后病情持续加重。16-8处理对密花香薷表现症状与12-6相似但伤害较轻。6-3处理的植物略微矮小,花苞枯焦发黄较12-6、16-8处理较轻,10 d以后伤害症状没有恢复,且继续加重(图1-B)。12-6处理藜表现为1/2叶片有轻微青枯症状,1/4叶片边缘发黄干枯。16-8处理藜表现为植物矮小、3/4叶片青枯,1/2叶片萎蔫失绿发黄。6-3处理藜表现为植株略微矮小,叶片边缘有轻微发黄,10 d以后伤害症状没有恢复,继续加重(图1-C)

图1 3株酵母菌发酵液对多种杂草幼苗生长的抑制作用Fig.1 Inhibition effect of yeast fermentation broths on growth of weed seedlings
2.2 酵母菌菌株对主栽作物的安全性测定
由表2可知,接种酵母菌发酵液7 d后,16-8、12-6菌株对燕麦、小麦、青稞、蚕豆、豌豆、油菜和马铃薯均没有伤害,对作物鲜重与株高影响很小,表现对作物安全。6-3菌株对燕麦、小麦、青稞和油菜4种青海主栽作物无伤害,对株高与鲜重无影响,但对蚕豆及豌豆表现出对株高和鲜重有明显抑制,对蚕豆的株高和鲜重抑制率分别为12.73%和14.73%,对豌豆的株高和鲜重抑制率为10.69%和22.61%(表3)。
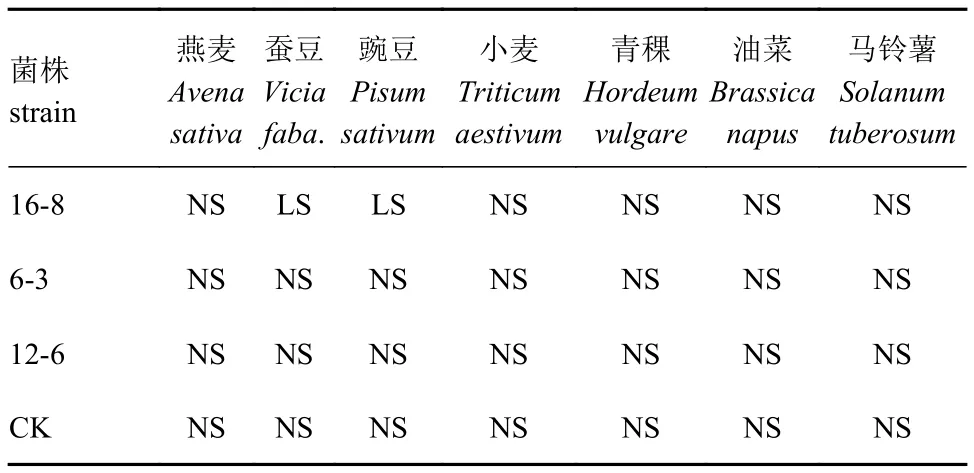
表2 3株酵母菌株发酵液对不同作物的安全性比较Table 2 Effect of yeast fermentation broths on crop safety
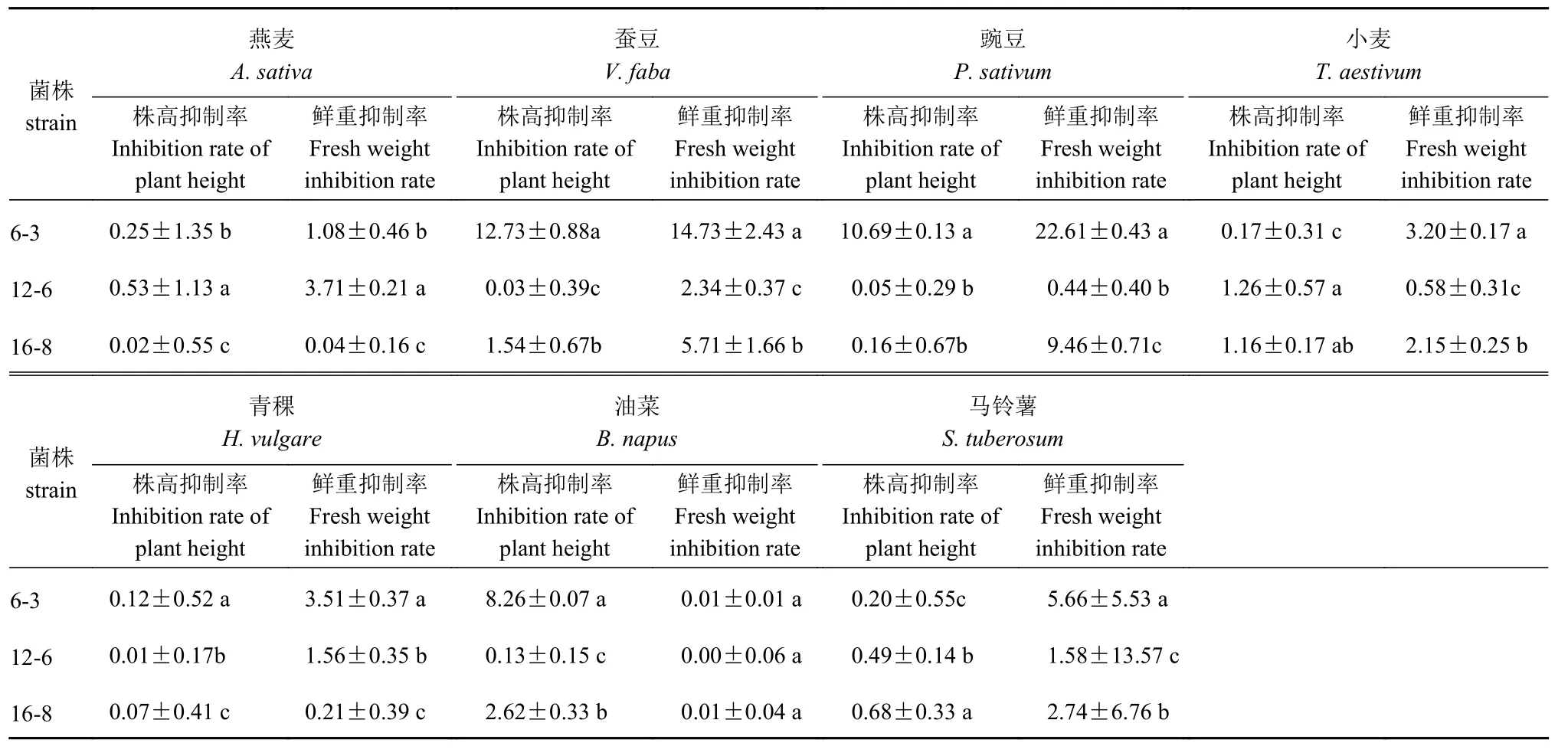
表3 3株酵母菌株发酵液对不同作物抑制作用Table 3 Inhibition effect of yeast fermentation broths on crops (单位:%)
2.3 分离菌株16-8发酵液与氯氟吡氧乙酸混用对猪殃殃的除草活性测定
16-8菌株发酵液与化学除草剂氯氟吡氧乙酸混用喷施48 h后,猪殃殃叶片出现萎蔫和部分枯死症状,72 h时植株全部枯死;单用发酵液喷施处理48 h后,猪殃殃植株开始出现萎蔫症状,60 h时部分叶片出现枯死,72 h猪殃殃植株全部枯死;如图2所示,单用化学除草剂750 mL·hm-2时,7 d时萎蔫症状明显,16-8菌株发酵液与氯氟吡氧乙酸混用处理较其化学除草剂单用处理相比,猪殃殃叶片萎蔫严重,出现死亡植株,14 d时抑制程度加重,21 d时猪殃殃已全部枯死。由此可见,16-8菌株发酵液与氯氟吡氧乙酸混用处理较其发酵液单用处理相比,猪殃殃叶片枯死症状出现早12 h,比单用化学除草剂早5 d。从鲜重抑制率来看,接种20%氯氟吡氧乙酸乳油7 d后,在其供试剂量下对猪殃殃的鲜重抑制率均在65%以下,单用16-8菌株发酵液处理,鲜重抑制率为85.19%,50%和25%推荐剂量化学除草剂+16-8菌株发酵液混用的鲜重抑制率分别为85.65%和83.05%;接种后14 d,20%氯氟吡氧乙酸乳油在推荐剂量(750 mL·hm-2)处理时对猪殃殃的鲜重抑制率仅为79.42%,而单用16-8菌株发酵液处理,鲜重抑制率为89.65%,50%和25%推荐剂量化学除草剂+16-8菌株发酵液混用的鲜重抑制率分别为91.61%和88.60%,对鲜重进行方差分析可知,单用化学除草剂与混用以及单用16-8菌株发酵液之间比较,存在显著性差异,但单用16-8菌株发酵液与混用处理之间比较,差异不显著(表4)。

表4 氯氟吡氧乙酸与16-8菌株发酵液混用对猪殃殃的防效Table 4 Efficacy of 16-8 fermentation broth per se or in combination with fluroxypyr on controlling G.aparine

图2 除草剂和16-8菌株混用后7 d的除草效果Fig.2 Efficacy of herbicide, 16-8 or herbicide+16-8 on weeds 7 d after treatment
2.4 菌株的鉴定
2.4.1 形态学鉴定 菌株16-8在YPD培养基上以单菌落出现,菌落边缘整齐,表面干燥,中间凸起,圆形,颜色为灰白色(图3-L)。镜检结果发现菌体呈现为圆形、卵圆形(图3-O)。菌株12-6在YPD培养基上以单菌落出现,菌落边缘不规则,表面凸起颜色呈现乳白色(图3-M)。显微镜下观察发现该菌呈现圆形、椭圆形初步鉴定为酵母菌(图3-P)。菌株6-3在YPD培养基上其菌落乳白色,菌落边缘规则不透明,极容易被挑起(图3-N)。镜检结果发现该菌形态为圆形、椭圆形(图3-Q)。
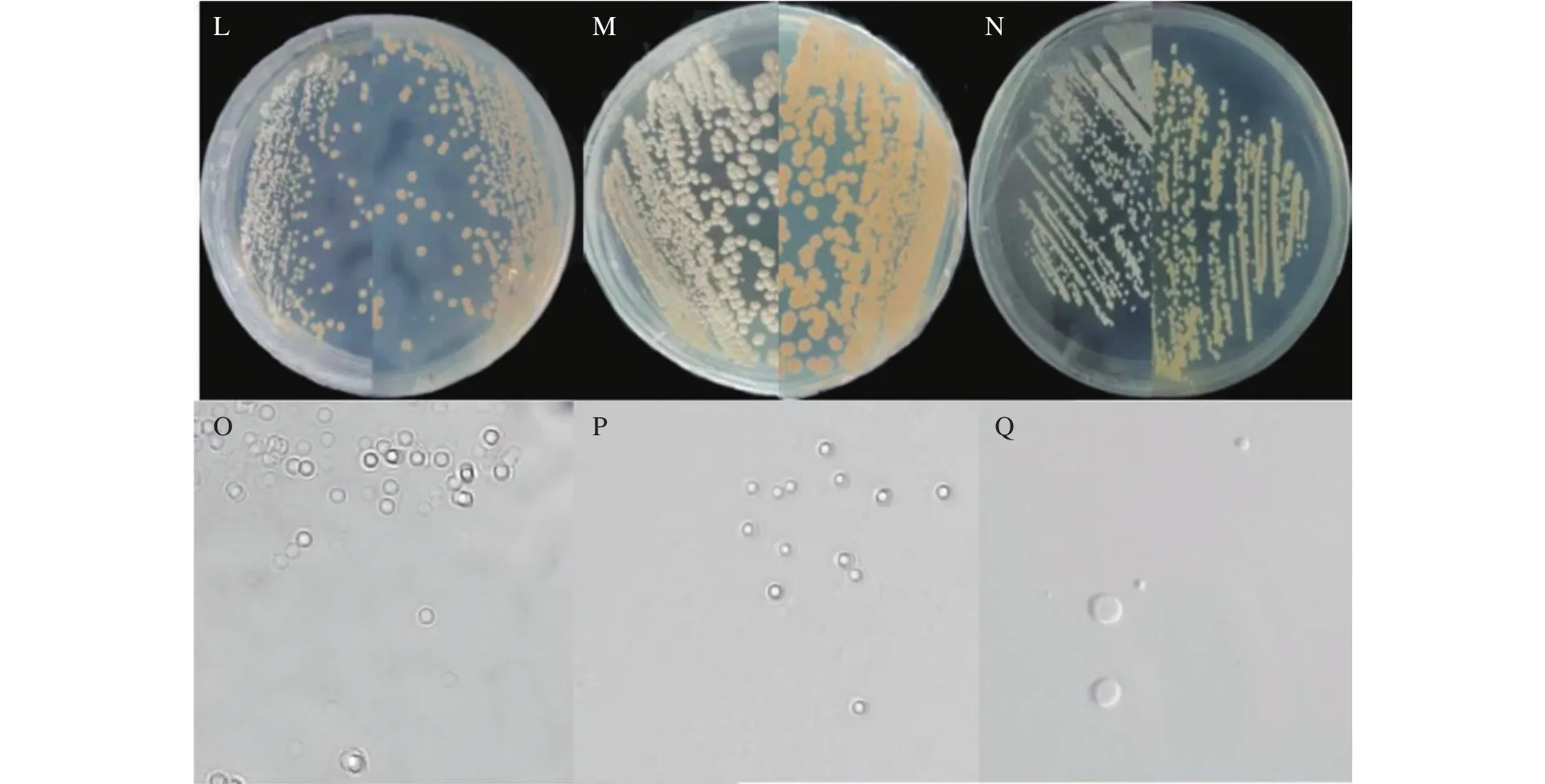
图3 分离菌株菌落形态及其孢子显微观察Fig.3 Colony morphology and microscopic images of 6-3, 12-6, and 16-8 spores
2.4.2 分子生物学鉴定 以16-8、12-6和6-3菌株基因组为模板,对分离菌株的ITS及26S rDNA基因片段进行PCR扩增与测序。进一步联合ITS、26S rDNA基因序列构建系统发育树,结果显示(图4),菌株16-8与Pichia kudriavzevii处于系统发育树的同一最小分支,菌株12-6与Kluyveromyces marxianus处于系统发育树的同一最小分支,菌株6-3与Meyerozyma guilliermondii处于系统发育树的同一最小分支。将16-8、12-6和6-3序列在NCBI上BLAST进行同源对比,并结合形态学分析结果将16-8鉴定为库德里阿兹威毕赤酵母(Pichia kudriavzevii),12-6与马克斯克鲁维酵母(Kluyveromyces marxianus)6-3与季也蒙迈耶氏酵母(Meyerozyma guilliermondii)。
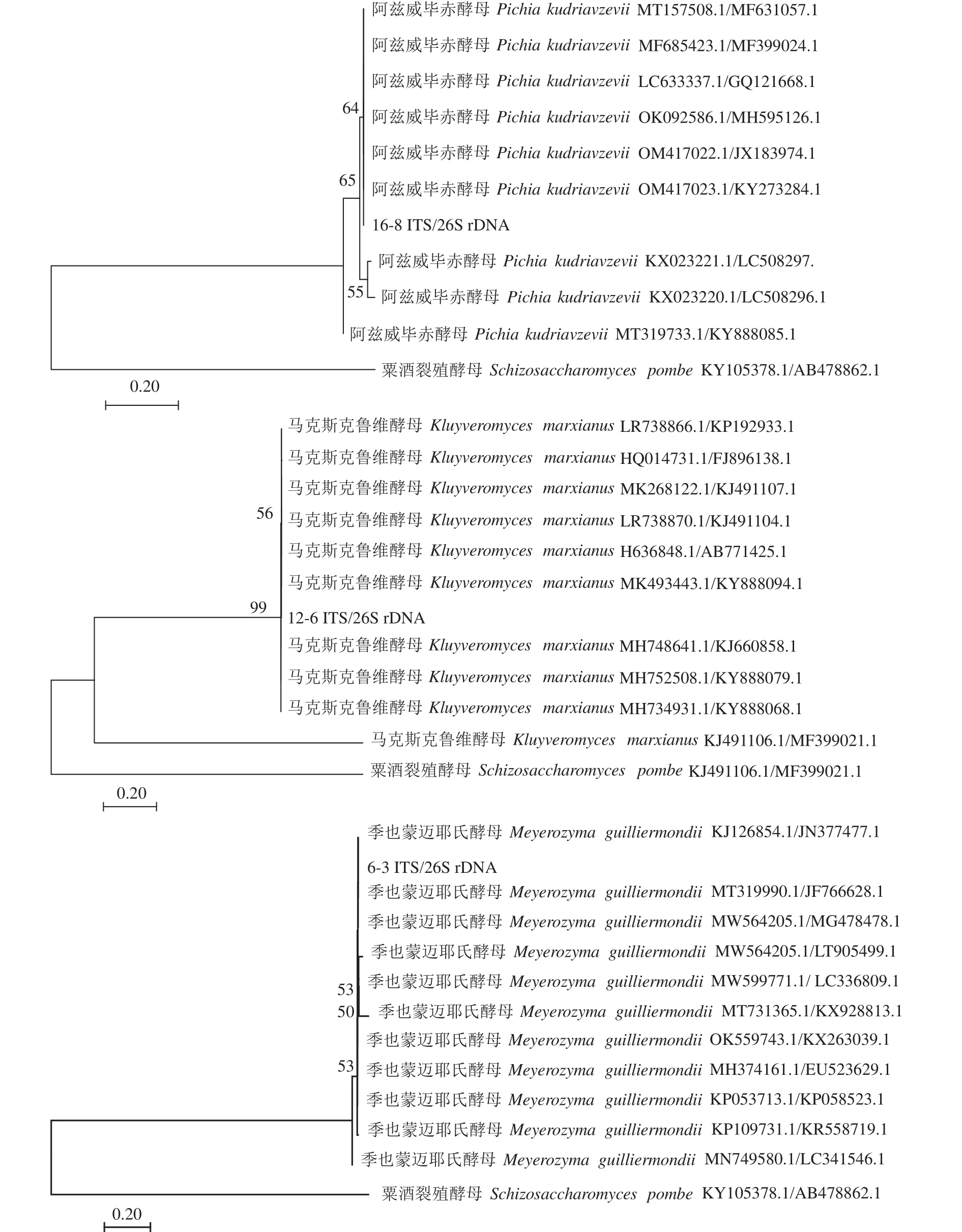
图4 3个菌株(16-8、12-6和6-3)基于ITS及26S rDNA基因构建的邻接法系统发育树Fig.4 Phylogenic NJ trees based on ITS rDNA and 26S rDNA sequences of Strains 16-8, 12-6, and 6-3
3 讨论与结论
近年来,微生物的次生代谢产物被开发为除草剂的研究广受关注,有研究表明,微生物毒素具有开发为除草剂的巨大潜力[20-22]。姜述君等[23]研究表明,来源于画眉草弯孢霉发酵液中的化合物α, βdehydrocurvularin会影响马唐叶片新陈代谢继而导致叶片坏死。Chen等[24]研究结果表明,灰黄青霉的次级代谢产物能有效抑制列当种子的萌发,从而达到防除恶性寄生性杂草列当的目的。本研究发现3株酵母菌发酵液对供试杂草的株高和鲜重有明显的抑制作用,喷雾处理7 d后,16-8菌株对猪殃殃、密花香薷和藜的伤害率分别为90.17%、66.67%和95.00%,鲜重抑制率分别为88.63%、56.90%和78.77%,因此该菌株的发酵液有较好的开发为微生物除草剂的潜力。但目前对发酵液中的具体除草活性物质尚不清楚,有待进一步研究。
在微生物除草剂的筛选过程中首要考虑就是安全性问题[25-26]。本研究结果表明,6-3和12-6菌株发酵液对测试的作物安全,无不良影响。16-8菌株发酵液除对蚕豆和豌豆株高和鲜重有轻微的影响外,对其他5种作物表现为安全。为全面评价这些菌株的安全性,还应进一步加大其他作物的安全性评价。
微生物在杂草综合治理中可以有多种不同的应用方式。由于大多数微生物菌株只针对一种杂草,所以将其与化学除草剂结合使用在理论上是可行的。微生物菌株Myrothecium verrucaria与化学除草剂共同使用可以有效地提高其活性[27]。Song等[28]采用Pyricularia setariae与1/10推荐剂量的烯禾啶混用可以更有效地防治狗尾草。同样,Phoma proboscis与亚致死剂量的2,4-D混用可以更有效地防治Comvolvulus arvensis[29]。与单独使用相比,Colletotrichum coccodes与噻苯隆混用可以提高真菌的侵染和苘麻的防除效果[30]。许多化学除草剂仅对刚刚出苗的圆叶锦葵有效,而如果Colletotrichum gloeosporioidsf.sp.malvae与除草剂结合使用,防效可持续至第4~5片真叶期。与单独使用真菌或嗪草酮或咪唑乙烟酸相比,二者混用可以极大地提高防治效果,并减少所需药量[31]。本研究发现:当16-8菌株发酵液与25%~50%推荐剂量的氯氟吡氧乙酸混用时,对猪殃殃的鲜重抑制率仍高达88.60%~91.61%,与单独使用16-8菌株发酵液的鲜重抑制率相当,表明混用能够提高单独使用除草剂或菌株发酵液的防除效果。因此,可选用微生物菌株与化学农药的复配用于杂草的防除,但在田间的防治效果有待进一步试验,包括使用剂量、使用方法及最佳使用时间等。同时通过探索与农业防治等其他措施的配合来实现持续、高效的除草目的。
通过对这3株菌株进行平板上菌落形态、显微镜下孢子形态观察,结合分子鉴定,确定这3个分离菌株均为酵母菌。近年来,关于酵母菌生物活性的报道越来越多。Pichia kudriavzeviiOT38接入土壤15 d以后提高了土壤生物炭、脱氢酶活性以及胶体多糖等含量,可以作为土壤改良剂利用[32]。Kluyveromyces marxianusHP-10菌株悬浮液通过营养和空间的竞争以及诱导抗病性相关酶的活性,较好地抑制了柑橘采后绿霉病菌,保证了果实的品质[33]。采后用Meyerozyma guilliermondiiSQUCC-33Y处理草莓果实可以显著降低由Alternaria alternata引起的果实腐烂病斑,该拮抗酵母菌可作为一种生物杀菌剂用于防治A.alternata引起的草莓采后果实腐烂病[34]。有研究发现,酵母菌的次生代谢物生物活性广泛,但目前尚未见其在除草方面的报道。本研究首次报道酵母菌发酵液具有优异除草潜力,今后可加深对菌株16-8的研究,分析其代谢产物中具有除草潜力的活性成分。本研究拓展了具有除草潜力的微生物资源,为微生物除草剂的开发利用提供菌株资源。
