氯化卡咪唑铵抑制钙调蛋白与心肌CaV1.2通道结合的作用
2022-12-04郝明杰孙伟楠苏敬阳郝丽英
郝明杰,孙伟楠,苏敬阳,郝丽英
(中国医科大学药学院药物毒理学教研室,沈阳 110122)
钙调蛋白(calmodulin,CaM)是一种钙离子(Ca2+)结合蛋白,通过与Ca2+结合调节机体的多种生物学功能,并在多种疾病中发挥作用[1-4]。CaM能够与L-型钙离子通道(L-type Ca2+channels,LTCCs)结合,调节通道的开放和关闭,影响细胞内Ca2+稳态,而细胞内Ca2+超载或浓度过低均会引发心血管系统疾病及神经精神疾病[5-6]。心肌中CaV1.2通道高表达,是Ca2+进入心肌细胞的主要途径,通道的开放和关闭受Ca2+依赖性易化(Ca2+-dependent facilitation,CDF)和Ca2+依赖性失 活(Ca2+-dependent inactivation,CDI)的反馈调节,而以上过程均需CaM参与。研究[7-8]表明,CaV1.2和CaM的结合及其介导的Ca2+依赖的调节作用在生理学和病理生理学中具有重要作用。
氯化卡咪唑铵(calmidazolium chloride,CMZ)是一种以咪唑为基础的特异性CaM拮抗剂。CMZ主要通过拮抗CaM依赖性磷酸二酯酶和CaM诱导的红细胞Ca2+转运ATP酶的活化,发挥拮抗CaM的作用[9]。本研究通过检测CMZ存在下CaM与心肌CaV1.2通道的CT1基序蛋白片段的结合情况,探讨CMZ调节细胞内Ca2+浓度的作用机制,为阐明相关疾病发生的潜在分子机制及深入理解疾病的病理生理过程、发现新的治疗靶点,提供理论依据和思路。
1 材料与方法
1.1 材料
pGEX-6P-3/CaM质粒由日本鹿儿岛大学KAMEYAMA教授惠赠;pGEX-6P-3/CT1质粒购自上海生工生物有限公司;胰蛋白胨和酵母提取物购自美国Oxid公司;氨苄西林(ampicillin,Amp)、异丙基-β-D硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)、二硫苏糖醇(dithiothreitol,DTT)、溶菌酶(lysozyme,Lys)以及N-月桂酰肌氨酸(N-lauroylsarcosine sodium,N-lau)购自美国Sigma公司;Triton X-100和磷酸盐缓冲液(phosphate bufer,PBS)粉末购自北京Solarbio公司;谷胱甘肽琼脂糖4B珠蛋白(glutathione-sepharose 4B beads,GS-4B beads)、PreScission酶购自英国GE Healthcar公司;CMZ购自中国MCE公司,溶解于二甲基亚砜中,现用现配制。
1.2 方法
1.2.1 融合蛋白的制备:将CaM的cDNA(GenBank FJ012165,人源CaM基因)和CT1(GenBank AB016287,豚鼠源CaV1.2通道基因 a.a.1509-1789)克隆入pGEX-6P-3质粒。在无菌条件下,应用42 ℃精确热休克法将CaM和CT1重组质粒转化至大肠杆菌BL21中。将菌液分别均匀涂布到含AMP的固体培养平板表面,于37 ℃培养箱中倒置培养12~16 h。挑取单克隆菌落于适量培养液中,震荡培养至对数生长期(OD600约0.6~1.0),取800 μL菌液加入50%高压灭菌过的200 μL甘油中混匀,-80℃冰箱中保留菌种。取60 μL菌种加入含有Amp的LB培养液中,37 ℃下空气摇床中(110 r/min)振荡培养10 h。次日清晨测得光密度OD600为0.8~1.2时,加入IPTG(终浓度为1 mmol/L)诱导蛋白表达4 h。采用超声破碎法从菌液中提取纯化GST-CT1和CaM蛋白。使用GS-4B beads纯化CaM,并利用PreScission酶切除其GST标签。应用BSA标准蛋白、BCA蛋白质定量试剂盒测量CaM浓度。GSTCT1蛋白离心(15 000g,10 min)后,取上清与预先用PBS清洗过的GS-4B beads过夜孵育。
1.2.2 融合蛋白的提纯验证:提取纯化的GST-CT1和CaM融合蛋白各40 μL,加入15 μL 5×SDS loading buffer,充分混匀;煮沸5 min,蛋白变性,行15%SDSPAGE凝胶电泳。考马斯亮蓝R染色,脱色,拍照。
1.2.3 Pull-down assay实验:将GST-CT1蛋白固定于用PBS清洗过的GS-4B beads上,4 ℃下缓慢旋转孵育过夜。12 h后取40 μL GST-CT1与CaM(终浓度0.35、0.7、1.4、2.1、3.5 μmol/L)在300 μL体系的Tris buffer缓冲液中孵育。实验分为2组进行,即对照组(GST-CT1+CaM)和CMZ组(GST-CT1+CaM+CMZ,CMZ终浓度为1 μmol/μL[10])。在不同 Ca2+浓度(100 nmol/L和10 μmol/L)条件下,4 ℃孵育4 h后,用相应浓度的Ca2+缓冲液清洗体系2次。然后,将样品重悬于SDSPAGE上样缓冲液中,并在15%SDS-PAGE凝胶中进行电泳分离。考马斯亮蓝R染色,Scanwizard Bio软件扫描并数字化,CS Analyzer软件定量灰度值,利用SigmaPlot软件绘制CaM与CaV1.2 CT1结合的拟合曲线。
1.3 统计学分析
结合配体(Y)用 Hills 方程拟合,单点拟合模型用 Hill 方程表示如下:Y=Bmax×[X]/(Kd+[X])。其中Bmax为最大结合,[X] 为自由配体浓度,Kd为表观离解常数。
2 结果
2.1 融合蛋白的鉴定
对超声破碎法提取的GST-CT1融合蛋白、Pre-Scission 酶切的CaM蛋白分别行15%SDS-PAGE凝胶电泳,经染色、脱色后,在表观分子量约为54×103(GST-CT1)、26×103(GST)和16.7×103(CaM)处出现蛋白条带(图1),与预期结果一致。

图1 纯化后的GST-CT1和CaM的SDS-PAGE电泳图Fig.1 SDS-PAGE of purified GST-CT1 and CaM
2.2 CMZ对CaM与GST-CT1结合的影响
10 μmol/L和100 nmol/L Ca2+浓度下,CaM与CaV1.2 CT1均具有结合作用,且结合具有CaM浓度依赖性。加入CMZ后,CaM与CaV1.2 CT1结合明显减少,且在10 μmol/L Ca2+浓度下结合减少更显著(图2、表1),表明CMZ能抑制CaM与CaV1.2 CT1的结合,且在高钙条件下抑制更显著。

图2 CMZ抑制CaM与CT1基序的结合Fig.2 CMZ inhibits the binding of CaM to CT1 motif
为了能够更加清晰直观地了解CMZ对CaM与GST-CT1结合的抑制作用,对CMZ组和对照组的CaM(0.35~3.5 μmol/L)与GST-CT1的结合值进行了具体分析。结果如图3所示,在Ca2+浓度为10 μmol/L和100 nmol/L时,CMZ显著抑制CaM与CT1基序的结合,且随着CaM浓度的增加,该抑制作用逐渐减弱,即在低CaM浓度时,抑制作用更显著。最大结合量Bmax值在Ca2+浓度为10 μmol/L时>100 nmol/L,而表观解离常数Kd值减小。表明高钙时CaM与CT1基序的结合亲和力增加,结合量增多。加入CMZ后,Kd值增加,表明CaM与CT1基序的结合亲和力降低,且在Ca2+浓度为100 nmol/L时结合亲和力降低更多(表1)。以上结果表明,CMZ在钙超载的情况下对CaM与CT1基序的结合抑制作用更佳。
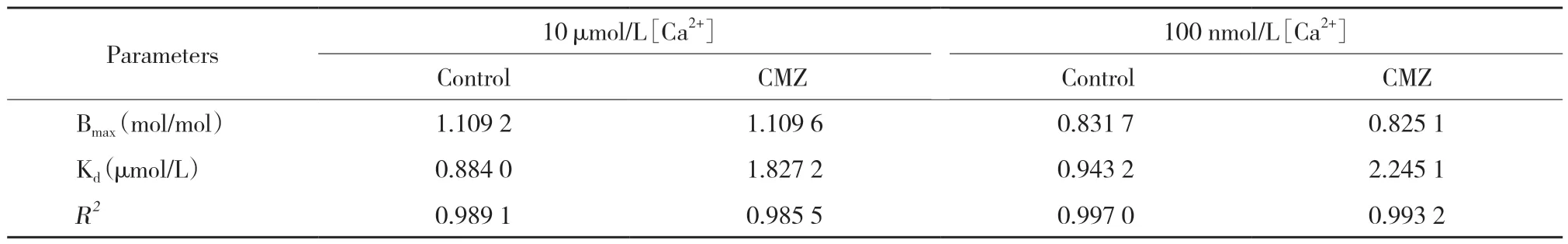
表1 CaM与GST-CT1结合的参数Tab.1 CaM and GST-CT1 binding parameters
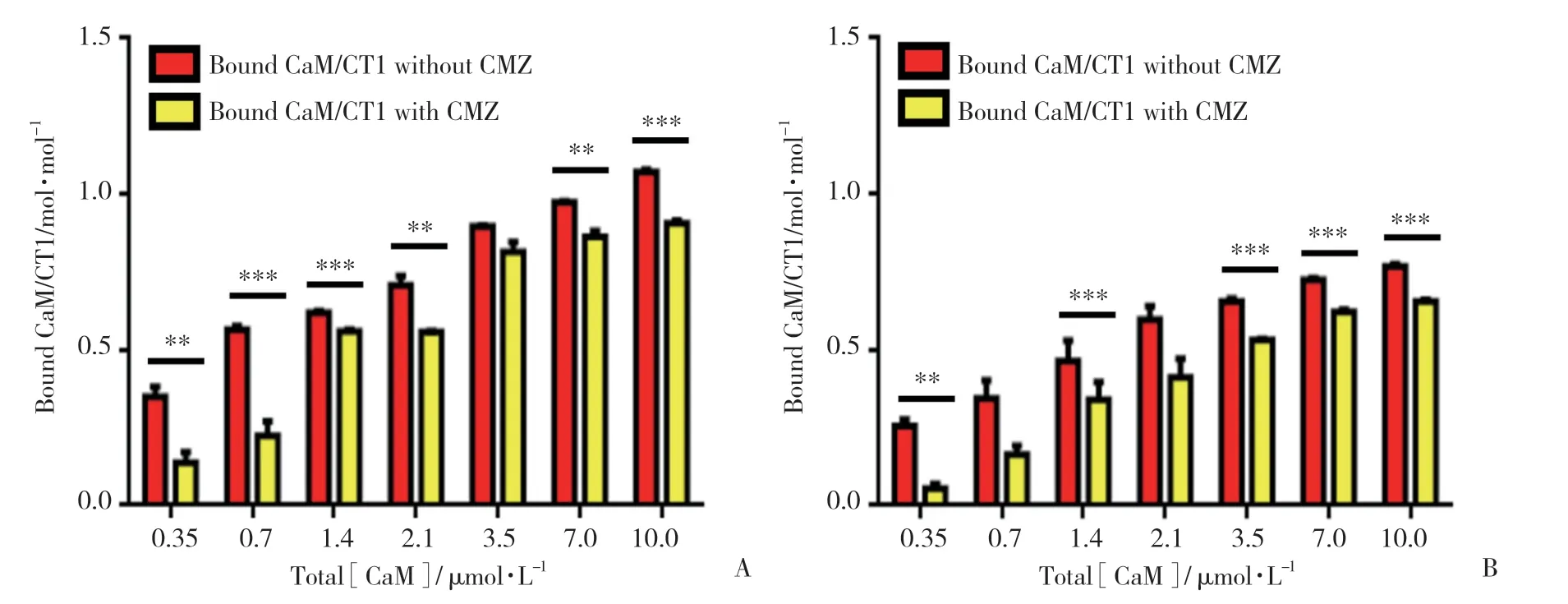
图3 CMZ存在或不存在时CaM与GST-CT1的结合情况对比Fig.3 The binding comparison of CaM and GST-CT1 with or without CMZ
3 讨论
细胞内Ca2+是作用于细胞受体并控制多种细胞功能外部信号的关键信使。细胞通过一系列调控过程,严密调控胞内Ca2+浓度水平,以调节多种生理功能。CaM是所有真核细胞中最主要的Ca2+感受器蛋白,它与Ca2+结合后构象发生变化,激活或抑制Ca2+通道,从而调控细胞内Ca2+浓度。细胞死亡、增殖异常和重大疾病等均与Ca2+稳态的失调关系密切。研究[11-12]发现,应用CMZ等CaM拮抗剂可通过刺激细胞内Ca2+的释放和进入,干扰Ca2+依赖性调节,从而使细胞内Ca2+浓度增加。本研究中讨论了Ca2+浓度为100 nmol/L(相当于生理状态下细胞内的Ca2+浓度)和10 μmol/L(相当于心血管疾病发生时的细胞内钙超载状态)时[13-15],CMZ对CaM与心肌CaV1.2通道CT1蛋白片段结合的抑制作用,结果表明,CMZ抑制了CaM与LTCCs CaV1.2 的结合,可能为应用CMZ后促使细胞内Ca2+浓度升高提供了新的理论基础,但其具体机制有待进一步研究。
自CaM被发现以来,对其抑制剂的研究一直是研究热点之一。研究表明,CaM拮抗剂有多种药理作用及广泛的临床应用前景,如诱导多种肿瘤模型的细胞凋亡[16],抑制肿瘤细胞的侵袭和转移,抑制小胶质细胞过度炎症反应等,为治疗帕金森病和阿尔茨海默病等与炎症增加和小胶质细胞增殖相关的神经退行性疾病提供了基础[17-18]。而且,一些CaM拮抗剂已被广泛用作抗癌药物、治疗造血系统疾病药物以及抗精神病药物[19]。CMZ作为CaM的一种特异性抑制剂,其临床应用具有广阔前景,但也有研究[20]发现,CMZ可导致离体成年大鼠心肌细胞舒张功能受损,从而导致心脏疲劳,还会导致H9c2细胞内Ca2+水平升高,线粒体功能障碍,氧化和亚硝化应激,产生剂量依赖性的生长抑制,这些严重的不良反应限制了其临床应用。但有也研究[21]表明,CaM拮抗剂使细胞内Ca2+浓度升高,可以通过线粒体途径诱导血小板的凋亡,不影响血小板活化,但影响其黏附和聚集,提示CMZ可作为治疗血栓的潜在有效药物,未来可将其制作为合适的剂型或靶向CaM和(或)CaM依赖的系统,以减少不良反应。
综上所述,本研究结果表明,CaM拮抗剂CMZ抑制了CaM与心肌CaV1.2通道 C末端CT1基序的结合,揭示了CMZ作为CaM拮抗剂的一种新的作用机制。为CMZ潜在作用的挖掘以及其他CaM抑制剂的新的作用机制研究提供了思路,也为将CMZ应用于临床治疗某些疾病提供了理论基础。
