脑宁糖浆的镇静催眠作用及其对睡眠剥夺小鼠神经递质的影响
2022-12-04李子恒陶正恒杨元喜汪宏章游秋云
李子恒, 陶正恒, 杨元喜, 汪宏章, 吴 威, 游秋云, 王 平*
(1.湖北中医药大学,湖北 武汉 430065,2.湖北太子药业有限公司,湖北 荆门 448000)
失眠症在情境、复发或慢性等特点的基础上影响大部分人口,并且是医疗实践中最常见的主诉之一[1]。目前,用于缓解失眠症状的西药主要是安定类药物[2-3],因易产生药物残留效应、成瘾性等影响而不适合长期服用。而中药治疗失眠可以规避西药带来的负面影响,具有一定的优越性。
脑宁糖浆主要由鲜松针、大枣、灵芝组成,具有补益气血、养心安神的功效,是治疗心神不宁所致的失眠、心烦、焦虑等症状的安全有效的中成药。经多年临床治疗证明[4],其对睡眠障碍、焦虑、植物神经功能紊乱等神经官能症有较好疗效,且毒性较小,无耐受性和成瘾性。本研究通过对脑宁糖浆的镇静催眠作用及其作用机制,以及治疗失眠的特点进行探索,以期为临床治疗失眠提供指导和思路,为脑宁糖浆的药性理论和应用提供可靠依据。
1 材料
1.1 动物 SPF级昆明小鼠260只,雌雄各半,体质量(20±2)g,购自辽宁长生生物技术股份有限公司,实验动物生产许可证号SCXK(辽)2020-0001。所有小鼠均饲养于湖北中医药大学老年医学研究所动物房,饲养环境为室温(25±1)℃,自由饮食,适应性饲养7 d,观察其一般状况。本研究获得湖北中医药大学动物伦理委员会批准(HUCMS202110001)。
1.2 试剂与药物 脑宁糖浆(批号20210301,湖北太子药业有限公司);舒乐安定购自湖北中医药大学校医院。三氯甲烷、异丙醇、无水乙醇(批号10006818、80109218、10009218,国药集团化学试剂有限公司);甲醇、乙腈(色谱纯,批号163629、161387,美国Fisher Scientific公司);甲酸(分析纯,批号FA-3116-0500,美国ACS恩科化学公司)。γ-氨基丁酸(γ-aminobutyric acid,GABA)、5-羟色胺(5-hydroxytryptamine,5-HT)对照品(批号43811、H-093,美国Sigma-Aldrich公司);戊巴比妥钠(德国默克公司);RNA提取液、逆转录试剂盒、2×SYBR Green qPCR Master Mix(批号G3013、G3330、G3322,武汉赛维尔生物科技有限公司)。引物序列见表1。

表1 引物序列
1.3 仪器 自发活动分析系统(安徽正华生物仪器设备有限公司);TP-1200C型电子天平(湘仪天平仪器设备有限公司);AL204型电子精密天平(瑞士梅特勒-托利多公司);6420 Triple Quad LC/MS三重四极杆液质联用系统(美国Agilent Technologies公司);LDZX-50KBS型立式压力蒸汽灭菌器(上海申安医疗器械厂);KDC2046型低速冷冻离心机(安徽中科中佳科学仪器有限公司);CFX96型聚合酶链式反应(PCR)扩增仪(美国Bio-Rad公司);Epoch酶标检测仪(美国BioTeK公司)。
2 方法
2.1 行为学实验
2.1.1 分组及给药 将144只小鼠随机分为4组,即正常组,舒乐安定组,脑宁糖浆低、高剂量组,每组36只。舒乐安定组小鼠灌胃给予0.26 mg/kg舒乐安定,脑宁糖浆低、高剂量组灌胃给予15.6、31.2 mL/kg脑宁糖浆(约人临床等效剂量的2、4倍),正常组灌胃给予等体积生理盐水,给药容量为0.2 mL/10 g,每天1次,连续14 d。对小鼠自主活动、阈上剂量戊巴比妥钠所致小鼠睡眠时间、阈下剂量戊巴比妥钠所致小鼠睡眠时间进行检测。
2.1.2 小鼠自主活动检测 随机取各组小鼠12只,第14天给药后30 min进行小鼠自主活动检测。实验前打开自主活动分析系统,设置好程序,实验时将小鼠放入实验箱内,让其适应2 min,随后点击分析系统,记录3 min内小鼠的活动时间及活动路程。
2.1.3 阈上剂量戊巴比妥钠所致小鼠睡眠时间检测 随机取各组小鼠12只,第14天给药后30 min,戊巴比妥钠按阈上剂量(预实验测得引起100%小鼠睡眠的最小剂量,为33 mg/kg)进行腹腔注射,记录30 min内小鼠睡眠潜伏期[腹腔注射至翻正反射消失(1 min以上)的时间]及睡眠持续时间(翻正反射消失至恢复的时间)。
2.1.4 阈下剂量戊巴比妥钠所致小鼠睡眠时间检测 随机取各组小鼠12只,第14天给药后30 min,戊巴比妥钠按阈上剂量(预实验测得引起90%~100%的小鼠翻正反射不消失的最大剂量,为28.5 mg/kg)进行腹腔注射,以小鼠翻正反射消失1 min以上者为发生睡眠,统计30 min内各组小鼠的入睡率,公式为入睡率=(各组入睡小鼠数/各组小鼠总数)×100%。
2.2 脑宁糖浆对睡眠剥夺小鼠的作用
2.2.1 造模、分组及给药 将75只小鼠随机分为5组,即正常组,模型组,舒乐安定组及脑宁糖浆低、高剂量组,每组15只,按“2.1.1”项下方法给药,模型组灌胃给予等体积生理盐水。从第15天开始,使用改良的多平台水环境法建立急性睡眠剥夺模型,除正常组外,其余各组小鼠连续睡眠剥夺72 h,其间持续给药。实验终点时取小鼠全脑,每组3只,置于福尔马林溶液中固定,进行免疫组化染色;其余分离出大脑皮层和下丘脑,用于各指标检测。
2.2.2 LC-MS法检测大脑皮层中GABA、5-HT含量 精密称取小鼠大脑皮层50 mg,采用LC-MS法检测大脑皮层中GABA、5-HT含量。
2.2.3 ELISA法检测下丘脑中orexin水平 取小鼠下丘脑适量,研碎后加入9倍量0.01 mol/L磷酸盐缓冲液(PBS),迅速匀浆,取上清液,严格按照ELISA试剂盒说明书进行操作,采用酶标仪测定吸光度,计算orexin水平。
2.2.4 免疫组化法检测大脑皮层中GABAAR表达 取经过福尔马林固定的小鼠全脑,经脱水、石蜡包埋后切片,烘烤、脱蜡后置于柠檬酸抗原修复缓冲液(pH 6.0)中,于微波炉内进行抗原修复,用3%双氧水溶液阻断内源性过氧化物酶,3%BSA室温封闭30 min,加一抗(GABAAR,1∶300)4 ℃孵育过夜,滴加二抗室温孵育50 min,滴加新鲜配制的DAB显色液,在显微镜下控制显色时间,苏木素复染细胞核,中性树胶封片,显微镜观察并拍照,采用Image-Pro Plus软件分析平均光密度值,以其表示蛋白表达程度。
2.2.5 RT-qPCR法检测大脑皮层中GABAAR、5-HT1AR和下丘脑orexinmRNA表达 取小鼠大脑皮层和下丘脑适量,研碎后提取mRNA,按逆转录试剂盒说明书进行逆转录,反应条件为42 ℃ 60 min,70 ℃ 5 min。逆转录后的cDNA按照SYBR Green qPCR Master Mix(High ROX)试剂盒说明书配置反应体系,于PCR仪中进行扩增,反应条件为 95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,共40个循环,结果以2-ΔΔCT法进行计算。

3 结果
3.1 脑宁糖浆对小鼠自主活动的影响 与正常组比较,各给药组小鼠自主活动时间、活动路程、活动速度减少(P<0.01),见表2。
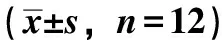
表2 脑宁糖浆对小鼠自主活动的影响
3.2 脑宁糖浆对阈上剂量戊巴比妥钠的协同作用 与正常组比较,各给药组小鼠睡眠潜伏期缩短(P<0.01),睡眠时间延长(P<0.01),见表3。

表3 脑宁糖浆对阈上剂量戊巴比妥钠的协同作用
3.3 脑宁糖浆对阈下剂量戊巴比妥钠所致小鼠入睡率的影响 与正常组比较,各给药组入睡率增加(P<0.01),见表4。
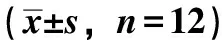
表4 脑宁糖浆对阈下剂量戊巴比妥钠所致小鼠入睡率的影响
3.4 脑宁糖浆对小鼠大脑皮层中GABA、5-HT含量的影响 与正常组比较,模型组小鼠大脑皮层中GABA、5-HT含量降低(P<0.01);与模型组比较,各给药组小鼠大脑皮层中GABA、5-HT含量升高(P<0.05,P<0.01),见表5。

表5 脑宁糖浆对小鼠大脑皮层中GABA、5-HT含量的影响
3.5 脑宁糖浆对小鼠下丘脑orexin水平的影响 与正常组比较,模型组小鼠下丘脑orexin水平升高(P<0.01);与模型组比较, 各给药组小鼠下丘脑orexin水平降低(P<0.01),见表6。
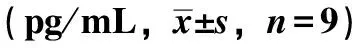
表6 脑宁糖浆对小鼠下丘脑orexin水平的影响
3.6 脑宁糖浆对小鼠大脑皮层中GABAAR蛋白表达的影响 与正常组比较,模型组GABAAR阳性表达平均光密度值降低(P<0.01);与模型组比较,各给药组GABAAR阳性表达平均光密度值升高(P<0.05,P<0.01),见表7、图1。
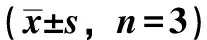
表7 脑宁糖浆对小鼠大脑皮层中GABAAR蛋白表达的影响
3.7 脑宁糖浆对小鼠大脑皮层中GABAAR、5-HT1AR和下丘脑中orexinmRNA表达的影响 与正常组比较,模型组小鼠大脑皮层中GABAAR、5-HT1ARmRNA表达降低(P<0.01),下丘脑中orexinmRNA表达升高(P<0.05);与模型组比较,各给药组小鼠大脑皮层中GABAAR、5-HT1ARmRNA表达升高(P<0.05,P<0.01),下丘脑中orexinmRNA表达降低(P<0.05,P<0.01),见表8。
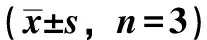
表8 脑宁糖浆对小鼠大脑皮层中GABAAR、5-HT1AR和下丘脑中orexin mRNA表达的影响
4 讨论
GABA与5-HT等神经递质及其受体与睡眠关系密切[5]。GABA主要分布在大脑皮质、下丘脑、脑干、海马、基底神经节等部位,被认为是中枢神经系统中启动和维持睡眠的重要抑制性神经递质[6-7],具有抵抗焦虑[8]、镇定神经以及治疗癫痫等功能[9]。研究应用睡眠剥夺箱、水平台、限制行动、腹腔注射对氯苯丙胺等方法复制失眠模型,并观察下丘脑和皮层内GABA水平[10-14],发现动物脑内不同部位的GABA水平均下降,GABAAR表达下调,经过中药干预后GABA水平上升,GABAAR表达回升,使失眠症状得到改善。5-HT是一种抑制性神经递质,在大脑皮层以及神经突触内含量很高[15],破坏动物的5-HT能神经元或神经末梢,会使脑内5-HT减少,导致失眠。同时多项研究表明,睡眠剥夺模型大鼠5-HT1AR水平下降,给予干预手段后,睡眠剥夺模型大鼠5-HT1AR水平升高,睡眠得到改善[16-17]。有关抑郁症研究提出的“单胺类神经递质能假说”认为,5-HT与其他中枢神经递质一起参与行为活动、情绪、食欲调节等,5-HT能神经传递机能的减退不仅导致情绪障碍如抑郁与焦虑的形成,而且还可通过影响其它递质的活动诱发抑郁症[18],因此,5-HT是抑郁症与睡眠障碍在神经递质上共性的体现所在。在抑郁症的发病过程中,GABA功能缺陷也伴随其中,并且与5-HT系统具有交互调节作用,GABA可以增强5-HT系统的功能,GABA受体拮抗剂可以影响5-HT系统表现出类似抑郁的症状[19]。
orexin是由下丘脑神经元分泌的具有兴奋性的神经肽类物质,其主要生理功能之一为调节睡眠和昼夜节律[20-21],睡眠剥夺会引起其在脑中水平的改变[22-23]。失眠症患者的orexin水平高于正常睡眠者,且与失眠的过程和严重程度有关[24]。另有研究指出[25-26],在睡眠状态下orexin神经元处于相对静息状态,在清醒状态下orexin神经元激活即刻早期基因c-fos,放电频率增加,并且脑脊液中orexin水平增多,因此,在睡眠开始时orexin水平会下降,睡眠剥夺后orexin-A分泌增加。各项研究指出,中医药治疗失眠的机制之一可能是调节orexin及其受体。张强等[27]发现,和胃安神方可下调失眠模型大鼠下丘脑中orexin-A水平以改善睡眠;全世建等[28]对睡眠剥夺大鼠使用交泰丸方灌胃,发现其镇静催眠作用可能是抑制了大鼠下丘脑促觉醒神经递质orexin-A水平。
综上所述,脑宁糖浆既可减少小鼠自主活动时间、活动路程、活动速度,也能缩短小鼠睡眠潜伏期并延长睡眠时间,且呈剂量依赖性,表明脑宁糖浆在临床建议剂量范围内具有良好的镇静安神作用,其机制可能是通过上调GABA、5-HT含量和GABAAR、5-HT1AR表达,下调orexin表达来实现的。
