基于SIRT1/NF-κB信号通路探究丹参酮ⅡA对抗结核药物致小鼠肝损伤的影响
2022-12-04王芝林于国英
王芝林, 于国英
(1.青海省第四人民医院临床药学室,青海 西宁 810000;2.青海省第四人民医院肝病科,青海 西宁 810000)
结核病是当今世界尤其是发展中国家的主要公共卫生问题之一,每年约有1 000万新发病例,是引起成年人死于传染病的主要病因[1]。临床主要通过利福平和异烟肼等抗结核药物对结核病进行治疗,利福平和异烟肼的联合使用能有效治疗结核杆菌引起的结核病,然而长期或大剂量使用会导致部分患者产生药物性肝损伤,严重者可能导致肝衰竭,威胁患者健康[2]。目前药物性肝损伤的发病机制尚不明确,沉默信息调节因子1(silent information regulator 1,SIRT1)是一种依赖烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的去乙酰化酶,可通过抑制核因子-κB(nuclear factor-κB,NF-κB)改善药物性肝损伤[3]。丹参酮ⅡA是中药丹参的主要有效成分之一,具有抗纤维化、抗癌、抗血管生成等多种作用,被用于心血管疾病、糖尿病、肝病等多种疾病的治疗[4-5]。研究表明,丹参酮ⅡA对利福平导致的小鼠肝损伤具有一定的保护作用[6]。本研究通过构建抗结核药物致小鼠肝损伤模型,探讨丹参酮ⅡA对肝损伤小鼠的保护作用及对SIRT1/NF-κB信号通路的影响,以期了解丹参酮ⅡA在抗结核药物致肝损伤中的可能作用机制。
1 材料
1.1 动物 SPF级雄性C57BL/6小鼠72只,体质量18~22 g,购于北京维通利华实验动物技术有限公司,实验动物生产许可证号SCXK(京)2019-0009,于温度22~25 ℃、相对湿度50%~70%、通风良好的实验室中饲养,自由饮水进食,适应性饲养1周后进行实验。
1.2 试剂与药物 丹参酮ⅡA(纯度≥97%,货号T4952),购自美国Sigma公司;利福平胶囊(国药准字H51020786,批号20190125),购自成都锦华药业有限责任公司;异烟肼片(国药准字H31020494,批号20190624),购自上海上药信谊药厂有限公司。SRT1720、EX527(货号S1129、S1541),购自美国Selleck公司;肿瘤坏死因子α(TNF-α)、白介素-1β(IL-1β)酶联免疫吸附(ELISA)试剂盒(货号AQ-M0183、EM0109),购自武汉菲恩生物科技有限公司;苏木素-伊红(HE)染色试剂盒、RIPA裂解液(货号G1120、R0010),购自北京索莱宝科技有限公司;二喹啉甲酸(BCA)蛋白检测试剂盒(货号P0012),购自上海碧云天生物技术有限公司;兔抗鼠SIRT1、NF-κB、β-actin一抗,山羊抗兔IgG H&L(货号ab189494、ab32360、ab5694、ab6702),购自英国Abcam公司。
1.3 仪器 CA94089酶标仪,购自美国Molecular Devices公司;BX51显微镜,购自日本Olympus公司;Gel-Doc凝胶成像系统,购自美国Bio-Rad公司。
2 方法
2.1 分组与给药 60只小鼠随机分为对照组,模型组,丹参酮ⅡA低、高剂量组,SRT1720(SIRT1激活剂)组,丹参酮ⅡA+EX527(SIRT1抑制剂)组,每组10只。除对照组外,其余各组小鼠每天灌胃给予100 mg/kg 利福平和100 mg/kg 异烟肼[7],对照组灌胃给予等体积生理盐水,每天1次,连续30 d。利福平、异烟肼灌胃后2 h,丹参酮ⅡA低、高剂量组小鼠给予10、50 mg/kg 丹参酮ⅡA灌胃[6],SRT1720组小鼠给予20 mg/kg SRT1720灌胃[8],丹参酮ⅡA+EX527组小鼠给予50 mg/kg丹参酮ⅡA和10 mg/kg EX527灌胃[9],对照组和模型组小鼠给予等量生理盐水灌胃,每天1次,连续30 d。给药期间,观察小鼠精神状态、进食饮水及活动情况,并记录体质量变化。
2.2 取材 末次给药后,小鼠禁食不禁水12 h,2%戊巴比妥钠麻醉小鼠,腹主动脉取血,4 ℃、3 000 r/min离心15 min,收集上层血清,取适量用于生化指标检测,剩余血清分装后于-80 ℃冰箱保存。处死小鼠,无菌条件下摘取肝脏,生理盐水冲洗,一部分置于10%多聚甲醛中固定,梯度乙醇脱水,石蜡包埋;另一部分保存于-80 ℃冰箱中,用于后续实验。
2.3 小鼠血清肝功能、血脂及炎症因子水平检测 全自动生化分析仪检测小鼠血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)水平。取-80 ℃冰箱中保存的血清,采用ELISA试剂盒检测TNF-α、IL-1β水平,操作严格按照试剂盒说明书进行。
2.4 HE染色观察小鼠肝组织病理学变化 取“2.2”项下石蜡包埋的肝组织,石蜡切片机切片(4 μm),脱蜡至水,HE染色,显微镜下观察小鼠肝组织病理学形态,并进行病理学损伤评分。肝组织病理学损伤评分标准主要依据肝细胞坏死、炎性细胞浸润、肝窦充血、门管区水肿4个方面进行评分(无病变或非常轻微为0分,轻度病变为2分,重度病变为3分,极重度病变为4分),各项评定分数总和为最终肝组织病理学损伤评分,每组随机选取10个视野,取平均值后进行统计学分析。
2.5 免疫组化检测小鼠肝组织SIRT1、NF-κB蛋白表达 取“2.2”项下石蜡包埋的肝组织,石蜡切片机切片(4 μm),60 ℃烤箱烘干,常规脱蜡、水化后抗原修复,加入兔抗鼠SIRT1、NF-κB一抗,4 ℃过夜,加入山羊抗兔IgG H&L二抗,室温孵育1 h,DAB显色,苏木精复染,盐酸乙醇短暂分化,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察SIRT1、NF-κB阳性表达(棕黄色)。每张切片随机选取3个区域,Image J图像分析软件测定光密度。
2.6 Western blot法检测小鼠肝组织中SIRT1、NF-κB蛋白表达 取“2.2”项下于-80 ℃冰箱中保存的小鼠肝组织,加入RIPA组织裂解液,冰上匀浆,4 ℃、15 000 r/min离心15 min,收集上清,BCA试剂盒检测蛋白浓度,在95 ℃下变性,配制10%分离胶,5%浓缩胶,取10 μL样品上样,进行SDS-PAGE凝胶电泳,蛋白分离后转膜,5%脱脂奶粉封闭,TBST洗膜3次,加入兔抗鼠SIRT1、NF-κB、β-actin一抗稀释液,在4 ℃下孵育过夜,TBST洗膜3次,加入山羊抗兔H&L IgG二抗稀释液,室温孵育,TBST洗膜3次,化学发光法显色,蛋白凝胶成像系统成像,Image J图像处理软件分析蛋白条带灰度值。

3 结果
3.1 小鼠一般情况 对照组小鼠毛发整齐干净,进食饮水、活动正常,体质量增加规律;模型组小鼠毛发稀疏蓬乱,精神萎靡,活动量减少,进食饮水量下降,体质量增加不明显或下降;丹参酮ⅡA各剂量组和SRT1720组小鼠活动、进食饮水情况较模型组有所改善;而丹参酮ⅡA+EX527组小鼠状态较丹参酮ⅡA高剂量组稍差。
3.2 丹参酮ⅡA对小鼠血清肝功能及血脂水平的影响 与对照组比较,模型组小鼠血清ALT、AST、TBIL、TC、TG、LDL-C水平升高,HDL-C水平降低(P<0.01);与模型组比较,丹参酮ⅡA各剂量组和SRT1720组小鼠血清ALT、AST、TBIL、TC、TG、LDL-C水平降低,HDL-C水平升高(P<0.01);与丹参酮ⅡA高剂量组比较,SRT1720组小鼠血清ALT、AST、TBIL、TC、TG、LDL-C、HDL-C水平无明显差异(P>0.05),丹参酮ⅡA+EX527组小鼠血清ALT、AST、TBIL、TC、TG、LDL-C水平升高,HDL-C水平降低(P<0.01),见表1。
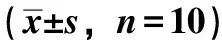
表1 各组小鼠血清肝功能及血脂水平比较
3.3 丹参酮ⅡA对小鼠肝组织病理学变化及病理学损伤评分的影响 对照组小鼠肝组织形态正常,结构完整,无病变发生,肝细胞排列均匀;模型组小鼠肝小叶受到破坏,肝索排列紊乱,伴有炎性细胞浸润,肝细胞出现大量坏死,病理损伤评分高于对照组(P<0.01);丹参酮ⅡA低剂量组小鼠肝组织损伤程度降低,炎性细胞浸润变轻,部分肝细胞出现坏死,病理损伤评分低于模型组(P<0.01);丹参酮ⅡA高剂量组和SRT1720组小鼠肝小叶结构基本完整,肝索排列较为整齐,炎性细胞浸润程度和细胞坏死减轻,病理损伤评分均低于模型组(P<0.01),且2组间比较差异无统计学意义(P>0.05);而丹参酮ⅡA+EX527组小鼠肝组织损伤程度重于丹参酮ⅡA高剂量组(P<0.01),见图1、表2。
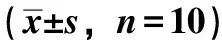
表2 各组小鼠病理损伤评分比较
3.4 丹参酮ⅡA对小鼠血清TNF-α、IL-1β水平的影响 与对照组比较,模型组小鼠血清TNF-α、IL-1β水平升高(P<0.01);与模型组比较,丹参酮ⅡA各剂量组和SRT1720组小鼠血清TNF-α、IL-1β水平降低(P<0.01);与丹参酮ⅡA高剂量组比较,SRT1720组小鼠血清TNF-α、IL-1β水平差异无统计学意义(P>0.05),丹参酮ⅡA+EX527组血清TNF-α、IL-1β水平升高(P<0.01),见表3。
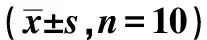
表3 各组小鼠血清TNF-α、IL-1β水平比较
3.5 丹参酮ⅡA对小鼠肝组织SIRT1、NF-κB蛋白表达的影响 小鼠肝组织SIRT1主要表达于细胞核内,NF-κB在细胞核和细胞浆内均有表达。与对照组比较,模型组小鼠肝组织SIRT1阳性表达降低(P<0.01),NF-κB阳性表达升高(P<0.01);与模型组比较,丹参酮ⅡA各剂量组和SRT1720组小鼠肝组织SIRT1阳性表达升高(P<0.01),NF-κB阳性表达降低(P<0.01);与丹参酮ⅡA高剂量组比较,SRT1720组小鼠肝组织SIRT1、NF-κB阳性表达差异无统计学意义(P>0.05),丹参酮ⅡA+EX527组小鼠肝组织SIRT1阳性表达降低,NF-κB阳性表达升高(P<0.01),见表4、图2。
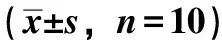
表4 各组小鼠肝组织SIRT1、NF-κB蛋白表达比较
3.6 丹参酮ⅡA对小鼠肝组织SIRT1/NF-κB通路蛋白表达的影响 与对照组比较,模型组小鼠肝组织SIRT1蛋白表达降低(P<0.01),NF-κB蛋白表达升高(P<0.01);与模型组比较,丹参酮ⅡA各剂量组和SRT1720组小鼠肝组织SIRT1蛋白表达升高(P<0.01),NF-κB蛋白表达降低(P<0.01);与丹参酮ⅡA高剂量组比较,SRT1720组小鼠肝组织SIRT1、NF-κB蛋白表达无明显差异(P>0.05),丹参酮ⅡA+EX527组小鼠肝组织SIRT1蛋白表达降低(P<0.01),NF-κB蛋白表达升高(P<0.01),见表5、图3。
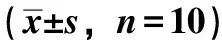
表5 各组小鼠肝组织SIRT1/NF-κB通路蛋白表达比较
4 讨论
利福平和异烟肼是临床上治疗结核病的主要药物,两者长期联合使用会引起药物性肝损伤的发生[10-11]。本研究通过利福平和异烟肼联合灌胃构建抗结核药物致肝损伤小鼠模型,探讨药物性肝损伤小鼠治疗相关机制,结果表明,模型组小鼠血清ALT、AST、TBIL水平升高,且肝组织中肝小叶受到破坏,肝索排列紊乱,伴有炎性细胞浸润,肝细胞出现大量坏死,提示造模成功,可用于后续实验研究。
丹参酮ⅡA具有抗炎、抗氧化、抗菌等多种生物学活性,可用于多种肝脏疾病的治疗[12-13]。研究表明TNF-α、IL-1β的表达与药物性肝损伤、免疫性肝损伤等肝脏疾病发生有关[14-15]。本研究结果提示,炎症与利福平和异烟肼引起的药物性肝损伤的发生有关。Huang等[16]研究表明丹参酮ⅡA能够抑制高脂饮食诱导的肝损伤大鼠的炎症反应和肝细胞凋亡,改善大鼠肝损伤。Zhang等[17]研究表明丹参酮ⅡA通过改变乙酰氨基酚及其代谢产物的药代动力学特征,防止乙酰氨基酚诱导的小鼠肝毒性。Yang等[18]研究表明丹参酮ⅡA能够减轻利福平诱导的胆汁淤积引起的大鼠肝损伤。本研究结果提示,丹参酮ⅡA对药物性肝损伤可能有一定的治疗效果。进一步研究表明,丹参酮ⅡA可能通过抑制利福平联合异烟肼引起的炎症反应,减轻小鼠肝损伤,具体机制有待进一步研究。
SIRT1参与炎症反应、物质代谢、氧化应激等多种生物学途径[19]。NF-κB是炎症反应的主要调节因子,参与炎症性疾病的发生发展[20]。SIRT1通过抑制NF-κB信号通路,从而发挥抗炎作用[21]。Niu等[22]研究表明SIRT1的上调通过抑制NF-κB信号通路防止高脂饮食诱导的小鼠肝损伤。本研究结果表明,SIRT1/NF-κB信号通路可能与抗结核药物引起的肝损伤有关。研究发现激活SIRT1/NF-κB信号通路有助于改善利福平联合异烟肼导致的小鼠肝损伤。Quan等[23]认为丹参酮ⅡA可能通过调节SIRT1/NF-κB信号通路保护脂多糖诱导的小鼠肺损伤。本研究结果提示,丹参酮ⅡA可能促进SIRT1/NF-κB信号通路的激活。本研究还发现,与丹参酮ⅡA高剂量组比较,丹参酮ⅡA+EX527组小鼠肝组织SIRT1蛋白表达降低,NF-κB蛋白表达升高,且小鼠血清炎症因子水平升高,肝损伤程度加重,进一步说明丹参酮ⅡA通过激活SIRT1/NF-κB信号通路,减轻抗结核药物导致小鼠肝损伤。
综上所述,丹参酮ⅡA可能通过激活SIRT1/NF-κB信号通路,抑制利福平和异烟肼联合导致的小鼠炎症反应,减轻小鼠肝损伤,这可能是丹参酮ⅡA在治疗药物性肝损伤中的相关机制。本研究为临床使用丹参酮ⅡA防治抗结核药物引起的肝损伤提供了理论依据。
