适用于乳房组织工程的支架材料及制备工艺
2022-12-03祝旭龙刘鑫淼吴姝涵李建辉
祝旭龙 刘鑫淼 吴姝涵 李建辉
【提要】 乳房组织工程被认为是乳房重建的终极方案。乳房是特殊的软组织,支架材料作为组织工程的三大要素之一,在乳房组织工程当中显得尤为重要。理想的支架材料应具备与目标组织相似的物理和生化特性,适宜的生物化学和物理环境,能够调节种子细胞对特定组织工程要求的响应。生物材料的特性(例如机械和化学功能性)影响细胞黏附、增殖和分化等行为,所以理想的支架应具有良好的生物相容性,从而防止长期免疫反应的发生。此外,良好的生物支架应具备适宜的多孔结构,以利于血管生成并为细胞的增殖分化提供营养物质。以上与支架的材料选择及制备工艺都有直接的关系,本文列举了可用于乳房组织工程研究的支架材料,并根据乳房组织特性选择相关制备工艺进行介绍。
乳腺癌是全球女性发病率最高的癌症之一,且呈逐年升高的趋势[1]。乳腺癌导致的乳房缺失或畸形,极大地影响了患者的身心健康和生活质量。此外,乳腺叶状肿瘤、肉芽肿性乳腺炎等良性乳腺病,也会造成患侧乳房的较大缺损或畸形。以重建为目的的乳房组织工程,基于以上医源性因素及较高的发生率,获得了较高的关注度。由于人体对生物材料的各种反应相当复杂,所以对材料的设计、选择、改性、复合和制造等环节均是十分关键的,最终应形成乳房组织相似甚至相同的三维结构、理化性质和功能。天然高分子材料普遍生物特性好但机械性能低;人工合成高分子材料支架最主要的优势在于精确的可操控性,包括可以人为控制分子量、形状、孔隙率、微细结构、机械弹力强度等。然而,人工合成支架的降解产物可能导致局部环境的pH 值变化进而产生炎症。同时,人工合成材料的质地相对坚硬,与正常乳房组织存在差异,导致乳房重建术后愈合延迟和许多并发症的发生[2]。来源于脂肪组织的脱细胞支架(Decellularization of adipose tissues,DAT)具有天然的优势,具备低免疫原性、良好的生物学性能及机械性能,可模拟天然细胞外基质结构,为种子细胞的黏附、生长、增殖提供了三维环境,具有促脂肪生长和促血管新生作用。目前的支架材料普遍难以生产较大体积的脂肪组织,难以同时实现脂肪组织结构的正确模拟和血管通道网的系统集成[3]。
1 天然高分子材料
1.1 透明质酸
1934 年,首次从牛眼玻璃体液中分离出一种新的糖胺聚糖[4],即透明质酸(Hyaluronic acid,HA),具有优异的生物特性。目前,HA 基支架以水凝胶、网片和海绵等形式被广泛应用于组织工程研究中[5-7]。有研究通过直接注射,将主要含有非动物源性的稳定性透明质酸(Non-animal stabilized hyaluronic acid,NASHA)医用材料Macrolane 植入患者乳房进行安全性研究。结果表明,植入后虽能取得良好的美容效果,但受区发生红肿、疼痛等不良反应[8]。此外,直接注射HA进行乳房重建时,部分患者会产生乳房肿块和皮下结节,不仅会降低美容效果,而且将干扰对影像结果的判断而妨碍乳腺肿瘤的早诊早治[9]。因此,单纯可直接注射的HA 材料应用于乳房重建的安全性及适用范围亟待考究。目前最为常见的是利用HA 与理想的天然或人工材料复合改性,以达到取长补短的目的。Chang 等[10]制备的HA-明胶冷冻凝胶复合支架,具有高延展性、柔韧性佳的力学性质,也具有高孔隙率、孔径大、高溶胀比及亲水性等理化性质。体内和体外试验均表明该支架促进脂肪干细胞等成脂肪细胞黏附、增殖、分化,有利于脂肪组织的新生并促进血管化。虽然HA 来源的材料应用于乳房重建并没有较为成熟的研究及策略,但其具有高度生物相容性、黏附性、保水性及力学稳定性,同时其来源丰富、价格低廉、易于加工,这些特性有利于工程化脂肪的构建,有待于进一步的研究及改良。
1.2 壳聚糖
壳聚糖是通过甲壳素的脱乙酰化获得的,甲壳素是甲壳类动物、软体动物和昆虫的外骨骼以及真菌的细胞壁上发现的一种聚合物,医用壳聚糖(Medical chitosan,MC)作为一种抗粘连剂,被用来降低乳房重建术后包膜挛缩的发生率[11]。Li 等[12]的动物研究发现,MC 可通过抑制组织金属蛋白酶(TIMPs)的表达和破坏ECM 的形成来减少包膜的厚度,证明了MC 有可能降低乳房重建手术后早期发生包膜挛缩的风险。研究表明,壳聚糖/胶原、壳聚糖/PLGA 等复合多孔支架,具有良好的生物相容性,其在体内、体外试验中对脂肪干细胞(Adipose-derived stem cells,ADSCs)的增殖分化有促进作用,并能在小鼠体内形成新的脂肪组织,有望成为脂肪组织工程的生物支架材料[13-14]。由于壳聚糖具有良好的组织相容性、降解速率可调节、易于加工制作,且具有抗菌、抗氧化等生物特性,也常用作皮肤、软组织、骨组织再生的支架材料或辅料[15-16]。
1.3 胶原
胶原蛋白是细胞外基质的一种结构蛋白。除软骨组织外,所有组织都含有人体内最丰富的Ⅰ型胶原纤维,皮肤、软组织中还含有较多的Ⅲ型及Ⅵ型胶原[17]。胶原是天然ECM 中含量最丰富的蛋白质,作为组织工程学支架材料具有非常高的仿生潜力[18]。同样的,在乳房组织工程方面,Ⅰ型胶原支架能够支持长达24 周的脂肪生成[19]。Davidenko 等[20]采用冷冻干燥技术制备了3D 多孔胶原-透明质酸支架,这些支架能够支持3T3-L1 前脂肪细胞的增殖和分化,增强了功能基因表达,不仅能生成脂肪组织,还增强了乳腺脂肪组织的体外发育能力。为了适应临床需求,尤其是乳腺癌术后乳房重建等较为复杂的内部环境,Baldwin 等[21]研制出一种单宁酸/胶原珠状注射材料,利用单宁酸具有抗癌和抗菌的特性,联合胶原复合成支架。结果表明,不仅脂肪组织及新生血管能随着植入材料的降解而逐渐形成,实验动物也未出现植入排斥、细菌感染、死亡等现象。与其他材料支架相比,胶原蛋白支架的优点是抗原性低、生物相容性好、生物可降解。然而,由于纯胶原支架的机械强度较低、降解速率较快,很难将其单独用作支架材料,所以胶原通常与其他天然或人工合成材料复合制作组织工程支架。
1.4 其他天然材料
丝素蛋白是蚕丝的主要组成部分,具有两性荷电的特殊性能和良好的生物相容性及生物降解性,易于塑形,是一种理想的医用材料。Hanken 等[22]的研究显示,丝素蛋白支架对人体脂肪前体细胞具有优异的细胞相容性且可促进脂肪分化;在丝素蛋白纤维上表达的生长因子VEGF 和FGF-2 可能对前脂肪细胞产生潜在的积极影响,在脂肪组织工程和再生医学中拥有应用潜力。
明胶是胶原部分水解而得到的一类大分子蛋白质,因其良好的生物相容性、低免疫原性,已被广泛加工成支架材料,且其与脂肪软组织相似的固体机械性能是脂肪组织重建所必需的。Sutrisno 等[23]设计研究了一种黑磷纳米片(BPNSs)和明胶的双功能复合支架,以杀死乳腺癌细胞并诱导脂肪组织重建。实验结果显示,BP-明胶复合支架和明胶对照支架均能够使脂肪细胞黏附、存活及增殖,而复合支架具有良好的生物相容性,降解产物无毒,且能够促进hMSCs 的成脂分化,有望成为杀伤乳腺癌细胞和促进脂肪组织重建的新平台。
海藻酸盐是一种可自然生物降解的聚合物,可以将种子细胞封装其内以形成可注射的水凝胶或预成型的支架。Yang等[24]利用层粘连蛋白修饰海藻酸盐,将ADSC、人参皂苷Rg1与材料混合,通过生物电喷雾制备成为可注射纳米微球凝胶(ADSC-G-LAMS)。将复合材料注射至乳房缺损模型,通过模拟脂肪形成的胚胎环境,促进了大鼠脂肪组织再生,同时Rg1 的释放诱导了血管的形成,提高了ADSC 及脂肪细胞的存活率。ADSC-G-LAMS 微球可以较好地负载干细胞和血管生成因子,有望用于肿瘤切除术后的乳房重建。
2 人工合成高分子材料
2.1 聚乳酸-羟基乳酸共聚物
聚乳酸-羟基乙酸共聚物(Poly lactic-co-glycolic acid,PLGA)由两种单体——乳酸和羟基乙酸按比例聚合而成,具有完全可生物降解性,其体内降解的最终代谢产物为水和CO2,不在体内蓄积,几乎没有毒副作用,是FDA 批准用于临床的少数合成聚合物之一。PLGA 及其组成部分PLA 应用均较广泛[25]。当ADSCs 在含有成脂因子的PLA 支架上培养时,脂肪生成转录水平显著上调,且有大量脂质积聚[26]。Chhaya等[27]利用PLA 乳房支架进行了裸鼠模拟试验,结果显示PLA支架凭借良好的机械性能承受了组织收缩力而不损失任何质量,24 周后移植区域生成了大量来源于宿主的脂肪细胞,移植区域炎症反应较轻,脂肪组织间纤维化组织相对较少。Kim 等[28]制备了PLGA/氢氧化镁复合支架,移植后显示出较好的抗炎及促血管生成作用,在此基础上自体脂肪组织移植,明显降低了移植脂肪的吸收率。另有研究表明,以PLGA支架为基础的工程脂肪组织可成功再生硬膜外脂肪,减少椎板切除术后硬膜外瘢痕的形成[29]。PLA、PLGA 具有绝佳的生物相容性,应用范围广泛,但也存在降解速度慢、疏水性和柔韧性差等缺点[30-31]。
2.2 聚己内酯
聚己内酯(Polycaprolactone,PCL)相较于PLGA 具有更好的柔韧性,降解更加缓慢,被广泛用于医用生物降解材料及药物控制释放体系。Lee 等[32]将脂肪基质细胞分别接种至天然纤维蛋白支架与PCL 支架表面,发现PCL 支架上的脂肪组织再生良好,脂肪生成基因的表达显著增加。然而,未经修饰的PCL 通常是疏水性的,不利于种子细胞黏附,且其缓慢和不稳定的降解阻碍了组织的替换。因此,为了满足不同组织构建的需要,PCL 需与其他材料复合来控制支架的性能,从而使支架的降解与新发生的组织发育相一致,满足乳房重建时脂肪生成与血管生长两大关键因素。Sawadkar 等[33]利用不同比例的天然材料与PCL 复合制造支架以研究其生物活性,通过研究成脂关键基因PPARγ 的表达,指出PCL 基复合材料有利于脂肪生成,且筛选出PCL-胶原-纤维蛋白复合材料是促血管生成能力最强的材料。总之,PCL 材料与其他材料复合,可使其兼具合适的机械强度和良好的生物相容性,有利于乳房组织的工程化构建。
2.3 其他合成材料
聚乙二醇(Polyethylene glycol,PEG)水凝胶由于良好的生物相容性、可溶性及降解产物无毒等,被广泛应用于组织工程领域。Brandl 等[34]证明了PEG 水凝胶在移植后可促进前脂肪细胞增殖和分化,具有作为脂肪组织工程支架材料的潜能。
聚氨酯(Polyurethane,PU)材料以其原料来源丰富、分子结构多样化、可修饰的性质,被制备为性能各异的多用途组织工程支架。Wittmann 等[35]将可生物降解的聚己内酯基PU支架与稳定的纤维蛋白凝胶相结合,用于生成体积稳定的脂肪组织结构。研究发现,该材料在体内、外均可以促进脂肪组织发育,并具有良好的促血管生成作用。Wiggenhauser 等[36]也证实了PU 在脂肪组织工程领域的潜力,发现PU 泡沫支架上纤维组织生成和脂肪再生较PCL 支架更加明显。
医用聚丙烯(Polypropylene,PP)因结构多样化及良好的理化,被广泛用于外科领域。Cheng 等[37]制备了一种ADSCs 复合聚丙烯网状支架,将其植入雌兔腹壁并进行评估,结果表明复合支架诱导产生的慢性炎症反应较单一支架更轻,表明了复合支架优异的细胞相容性,并可降低早期炎症反应及纤维化程度。由于传统的单一PP 支架较易引起免疫排斥及局部炎症,目前已有研究倾向于用其他物质(如聚多巴胺等)来改善支架本身的生物相容性[38]。
3 脱细胞脂肪组织基质
3.1 DAT 的诱导成脂作用
经过脱细胞处理后,脂肪脱细胞组织基质(DAT)常被用作生物支架,如可注射凝胶、干燥粉末、多孔泡沫、生物墨水等[39]。DAT 在皮下植入后形成脂肪组织的能力已在不同的动物模型中得到证实,现有研究表明天然DAT 及其衍生物均具有诱导脂肪生成的作用[40]。作为脂肪组织工程中最重要的种子细胞——人脂肪源性干细胞(HASC),能够在DAT 支架中良好地生长分化并促进脂肪的生成。DAT 本身具有招募宿主基质/干细胞促进脂肪生成的潜能,含HASC 的DAT 植入小鼠体内后更加能够诱导脂肪组织的形成[41-43]。由于DAT 天然的机械强度较差,联合其他材料可以改变DAT 的机械强度、弹性等力学性能,从而能够加强DAT 的成脂诱导能力[44-45]。另外,通过表面改性也能促进DAT 的应用。Cheung 等[46]用甲基丙烯酸酷硫酸软骨素(Methacrylated chondroitin sulphate,MCS)交联DAT,发现交联后的DAT 诱导成脂能力得到加强。Lu 等[47]用碳化二亚胺(1-ethyl-3-carbodiimide,EDC)和经基唬拍酞亚胺(N-hydroxysuccinimide)交联碱性成纤维细胞生长因子(Basic fibroblast growth factor,bFGF),发现交联bFGF 的小鼠DAT 血管化更好,表达更高的成脂相关蛋白。Adam 等[48]发现,交联谷氨酰胺转氨酶的DAT 其成脂能力与种植ASCs 的DAT 类似,均优于单纯DAT 支架植入。对于乳房组织工程而言,DAT 支架由于来源于脂肪而具有先天的优势,其良好的生物相容性及适宜的分子构成均是其他材料无法比拟的[49]。
3.2 DAT 的来源选择
Haddad 等[50]对比研究了不同脂肪组织库来源的DAT,并用MRI 评估效果,发现来源于乳房和腹部的DAT 的填充效果均优于单纯乳房脂肪组织填充。由于从人体直接获取相应的组织来进行相关的医学实验存在伦理问题,所以从动物体内获取脂肪组织是目前较为常用的手段,因为猪等哺乳动物与人类有着相似的解剖学和生理特性[51]。此外,不同部位的脂肪也存在一定的差异。Lin 等[52]通过实验比较了来自猪皮下组织(SDAT)和内脏脂肪组织(VDAT)的DAT 的成脂能力,结果显示VDAT 支架在体内的脂肪生成效果优于SDAT 支架。培养人脂肪源性干细胞(ADSCs)的体内试验结果显示,VDAT组的脂肪再生率高于SDAT 组,说明猪内脏脂肪组织是制备DAT 的优秀候选组织。但目前脱细胞技术尚在研究发展阶段,经各种技术处理产生的DAT 的质量及产量较低,且目前尚无任何一种方法能够在完全去除免疫源性物质的同时保留完整的细胞外基质结构,这仍需进一步探索研究。

表1 天然材料的优缺点
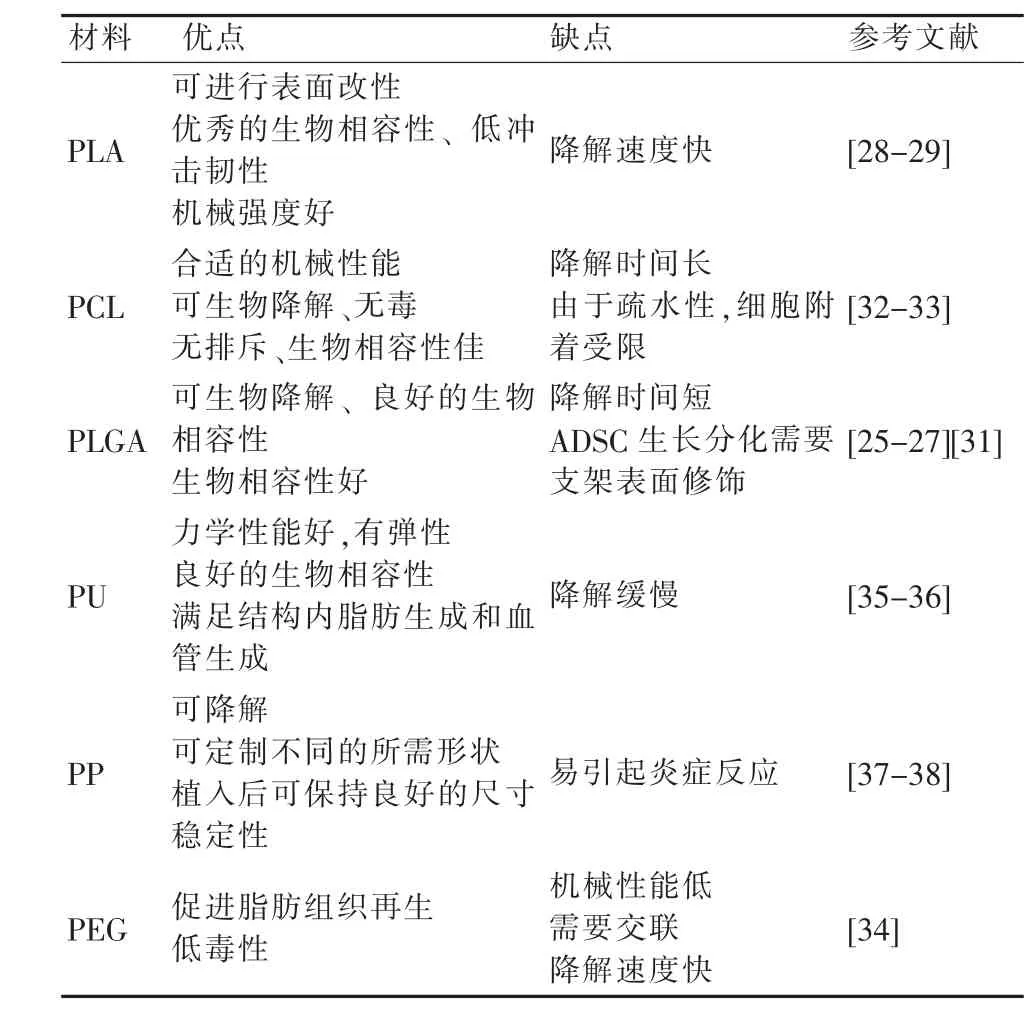
表2 人工合成材料的优缺点
4 乳房组织工程支架的制备工艺
4.1 3D 打印
3D 打印技术是一种通过计算机辅助,并以多次逐层沉积的方式将生物材料、生长及分化因子和种子细胞等功能组件,按照需求精确定位并加工制造的一种增材制备工艺[53]。在乳房重建术前评估方面,有研究使用MRI 并通过3D 打印对乳房植入物进行更精确的体积分析,从而用于术前触觉反馈及手术指导[54]。MRI 与3D 打印技术结合也被应用于术前建模,以更好地预估乳腺癌保乳手术的切除范围。3D 打印可以制备体积形状适宜、孔径均匀的支架材料。Tytgat 等[55]将甲基丙烯酰胺明胶(Gel-MA)和甲基丙烯化κ-角叉菜胶(Car-MA)合成为混合凝胶,通过3D 打印技术将其制备成为乳房支架,研究显示其力学性能接近于天然乳腺组织。Luo等[56]使用3D 打印技术制作了海藻酸盐-聚多巴胺(Alg-PDA)支架并植入乳腺癌小鼠体内。实验表明,Alg-PDA 支架的弹性模量和柔韧性与正常乳腺组织相似;具有良好的光热效应,可有效杀死癌细胞;支持乳腺上皮细胞的增殖。如果这种支架可用于乳房重建,将降低局部乳腺癌复发的风险,提升整形美容效果。张聚良等[57]首次利用3D 打印技术实施保乳手术。通过MRI 模拟乳腺肿瘤切除术后缺损数据并构建三维图像,利用3D 打印技术制备PCL 支架,将支架直接填充乳房创腔,术后未出现感染、血肿等并发症。填充物在2 年时间内逐渐降解,并有肉芽组织逐渐向填充物内部生长,填充物周围血供丰富,组织相容性及美容效果良好[58]。
但是,3D 打印制备的乳房支架严重受制于打印机精度和“墨水材料”,目前适用于3D 打印的材料并不广泛,其理化性质的设置,对所种植的种子细胞影响巨大,也将间接影响脂肪组织再生和血供的形成[59]。临床中,不同年龄、不同个体层次的乳腺组织力学模量不同,3D 打印的精度直接影响支架材料的柔性,也是未来亟待解决的难题。
4.2 静电纺丝
静电纺丝技术主要依靠纳米纤维堆积,是制造柔性材料的常用技术[60]。其技术原理是在电纺喷嘴尖端和接地收集器之间施加电场,液滴在喷嘴的末端形成微球。随着电场强度的增加,尖端的微球伸长,形成称为泰勒锥的锥形形状,并从尖端延伸得到纤维丝[61]。Unnithan 等[62]开发了一种基于静电斥力电纺原理并复合了CMMA(羧贝甜菜碱-甲基丙烯酸甲酯)共聚物的新型3D 静电纺丝支架(CMMA 3NF),发现该支架可以促进前脂肪细胞的附着、增殖及分化,证实了其在乳房组织工程和美容整形外科领域的适用性。静电纺丝支架拥有较好的力学性能,但支架孔隙率不易调节、产品产量较低,且单一技术较难直接实现三维立体结构。
4.3 冷冻干燥
冷冻干燥又称升华干燥。将材料溶液的温度降至冰点,再通过固体溶液升华制备成所需支架。Frydrych 等[63]通过冷冻干燥法制备得到了大而灵活的三维多孔PLLA 支架,具有高度互联的开孔结构、91%~92%的高孔隙率及109~141 μm的孔径。实验证明,利用冷冻干燥法制作的PGS/PLLA 共混支架具有与天然脂肪组织相似的力学性能、理想的多孔结构及亲水性能。冻干法的优点在于有利于创建大体积多孔的材料支架;缺点在于需要模具来限定材料形状,且处理过程中无法保证样品的原有生物活性。
5 总结与展望
以脂肪组织工程为基础的乳房组织工程,旨在能够恢复并长期保持与正常乳房组织相似的三维结构与生理功能,减少重建术后的并发症,提升乳房的整形美容效果。支架材料及其制备工艺是乳房组织工程的关键环节。为了克服单组份材料的局限性,目前人体组织再生设计较为依赖于两种或两种以上材料的组合,如天然与合成材料结合。合成材料主要提供机械强度和可纺性,而支架组分中的天然材料提供细胞识别信号,对细胞存活和增殖至关重要。作为脂肪组织工程的理想种子细胞,对ADSCs 分化能力、免疫调节能力及缺损修复机制的研究也是乳房组织工程研究的关键。ADSCs 联合DAT 具有良好的促进成脂和血管化能力,值得更加深入的研究与改良[41]。相信在临床医学、分子生物学、材料科学、理工科学等交叉学科的不断合作中,组织工程必将成为乳房重建最为理想的修复方式。
