不同密度下凡纳滨对虾工厂化养殖水体微生物多样性动态变化
2022-12-03何立彬于志文高佳朋韩佳乐
何立彬,郭 冉,于志文,高佳朋,韩佳乐
(河北农业大学海洋学院,河北秦皇岛 066000)
凡纳滨对虾(Litopenaeusvannamei)别名南美白对虾,是世界上产量最高、养殖最为广泛的三大对虾品种之一[1-3]。近年来,工厂化养殖发展迅速,高密度集约化养殖方式也给中国对虾养殖业带来了诸多问题。其中,养殖水体中的大量残余饵料和粪便致使水质恶化,进而导致了各种水产类疾病频发,严重危及对虾养殖安全[4]。作为凡纳滨对虾赖以生存的环境,养殖水体的安全是健康养殖的关键,水体中的微生物群落多样性发挥着重要作用[5]。一些有益菌,如芽孢杆菌、光合细菌、乳酸菌、酵母菌等对改善养殖水体环境、增强对虾抗病能力、促进对虾生长等方面效果显著[6]。因此,了解养殖水体微生物菌群结构及多样性变化至关重要[7]。高通量测序技术对研究宏基因组学(Metagenomics)有重要意义,是一种不需要对细菌进行分离培养和纯化,便可直接研究自然环境条件下微生物群落多样性的重要手段和方法[8]。该实验利用基于PacBio测序平台的16S rRNA高通量测序技术,比较两种密度下不同时期凡纳滨对虾养殖水体菌群结构变化情况,旨在为养殖水体微生物多样性的研究提供数据支持。
1 材料与方法
1.1 水样采集与预处理
放苗前将养殖池(6m×6m×1m)消毒处理,然后注入砂滤后的海水。整个养殖过程分两种密度养殖,即100尾/m2为低密度组,200尾/m2为高密度组,每种密度下3个平行养殖池,养殖周期均为90d。各个养殖池的水样采集分为4个时间点,即第20天、40天、60天和80天,分别用字母A、B、C、D来表示。1、2、3号池为低密度组,分别用字母编号O1、O2、O3表示,4、5、6号池为高密度组,分别用字母编号T1、T2、T3表示。按照采集时间点和养殖密度将水样分为8组,共24个样品,即AO(AO1、AO2、AO3)、AT(AT1、AT2、AT3)、BO(BO1、BO2、BO3)、BT(BT1、BT2、BT3)、CO(CO1、CO2、CO3)、CT(CT1、CT2、CT3)、DO(DO1、DO2、DO3)、DT(DT1、DT2、DT3)。根据陈琼[6]、吴欢欢[9]等人的取样方法,水样采集前所有的仪器和器皿都要采取灭菌处理,每个养殖池取2L水放入灭菌的三角瓶内,采取隔膜真空泵抽滤的方法,并使用醋酸纤维素滤膜(0.22μm孔径)过滤水样,收集水中的微生物。抽滤完毕后,将滤膜放入灭菌的密封袋中,及时转移至-20℃冰箱保存备用,用于微生物多样性分析。
1.2 高通量测序处理方法
样品采集完毕后,送至百迈客生物科技有限公司进行高通量测序,利用 PacBio 测序平台,采用单分子实时测序(SMRT Cell)的方法得出原始数据,在原始数据中导出CSS序列,进行Barcode识别,去除嵌合体,得出Effective CCS,通过聚类,划分OTUs(分类操作单元),得出物种分类。
1.3 生物统计分析
使用Usearch软件[10]对相似度为97%水平下的Reads聚类,得到OTUs并注释,得出物种信息。根据物种信息,选取样品在门、纲、目、科、属、种6个级别中丰度水平前十的物种,通过物种分布柱状图及物种差异分析,统计所有样品中的OTU,找出养殖水体中的优势或核心菌群[11],并进一步对OTUs进行丰度、序列特征、α-多样性和β-多样性分析等,得出物种的数量和均匀程度等信息。在β-多样性分析中,通过基于系统发生树的微生物菌群结构Unifrac[12]非加权主坐标分析作图展示,选出贡献率最大的主成分组合,进而得出存在组间差异显著性的物种。然后再通过对各物种功能基因预测分析,得出养殖水体中的微生物群落结构变化情况。
1.4 数据统计分析
本实验所得数据使用SPSS 22.0统计软件进行单因素方差分析(one-way ANOVA),实验结果用平均值±标准差(mean±SD)表示,并用Tukey法进行组间多重比较分析,差异显著性水平为P<0.05。
2 实验结果
2.1 高通量测序数据
该实验检测的24个样品通过Barcode识别后共获得373471条CCS序列,每个样品至少产生9002条CCS序列,平均产生15561条CCS序列。使用Usearch软件对CCS序列在97.0%的相似度水平下进行聚类、获得OTU,8个样品组AO、AT、BO、BT、CO、CT、DO、DT的平均OUT数量如表1所示。
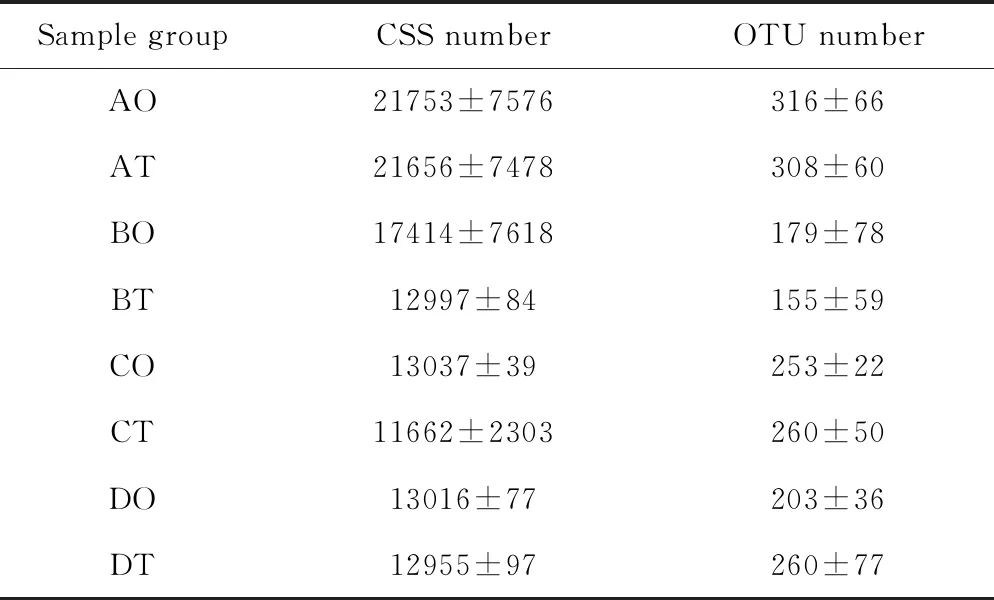
表1 各样品组CSS和OUT数量统计表
根据表1可知,各样品组OUT数量无显著性差异(P>0.05)。
2.2 基于门、属水平下的菌群结构和组间差异分析
根据物种注释,得出各样品微生物菌群可划分为24个门、43个纲、114个目、180个科和328个属。
如图1所示,在门水平上,细菌数量排名前十的菌门为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)、髌骨细菌门(Patescibacteria)、扁平菌门(Planctomycetes)、依附菌门(Dependentiae)、氯曲菌门(Chloroflexi)和硝基螺旋菌门(Nitrospirae)。在低密度组(AO、BO、CO、DO)养殖水体中,优势菌门中变形菌门、拟杆菌门、放线菌门和厚壁菌门的平均相对丰度分别为49.93%、37.36%、5.12%和2.63%;在高密度组(AT、BT、CT、DT)养殖水体中,优势菌门中变形菌门、拟杆菌门、放线菌门和厚壁菌门的平均相对丰度分别为70.28%、21.09%、3.06%和1.21%。在属水平上,细菌丰度排名前十的菌属为海命菌属(Marivita)、uncultured_bacterium_c_Alphaproteobacteria、褐指藻菌属(Phaeodactylibacter)、uncultured_bacterium_f_Saprospiaceae、Cobetia、亚硫酸杆菌属(Sulfitobacter)、九龙杆菌属(Jiulongibacter)、极化杆菌属(Polaribacter)、冷杆菌属(Psychrobacter)和uncultured_bacterium_f_Rhodobacteraceae。在低密度组养殖水体中,优势菌属中海命菌属、uncultured_bacterium_c_Alphaproteobacteria、褐指藻菌属、uncultured_bacterium_f_Saprospiaceae的平均相对丰度分别为12.59%、11.74%、11.05%和5.54%;在高密度组养殖水体中,优势菌属中海命菌属、uncultured_bacterium_c_Alphaproteobacteria、褐指藻菌属、uncultured_bacterium_f_Saprospiace ae的平均相对丰度分别为16.72%、2.90%、1.63%和2.80%。综上,低密度组和高密度组养殖水体中优势菌门均是变形菌门,其次是拟杆菌门,优势菌属是海命菌属。

图1 门水平(左)和属水平(右)物种分布柱状图
如图2所示,在门水平下,高密度组变形菌门细菌丰度均高于低密度组,而拟杆菌门细菌丰度均低于低密度组,并且BT、CT、DT组显著性低于BO组(P<0.05)。CO组获得最高的疣微菌门细菌丰度并且显著高于DO组(P<0.05)。各组放线菌门,厚壁菌门,髌骨细菌门细菌丰度没有显著性差异(P>0.05)。

图2 门水平物种差异柱状图
图3展示了在属水平上相对丰度较高的六个属,BO组褐指藻菌属细菌丰度显著高于其余各组(P<0.05),其他菌属细菌丰度在各组中无显著性差异(P>0.05)。

图3 属水平物种差异柱状图
2.3 α-多样性指数分析
使用QIIME2软件对各样品α-多样性指数进行计算评估,得出各个指数数值,并通过SPSS22.0软件进行方差分析,比较各样品组的显著性关系。
由表2可知,AO组获得最高的Chao1指数和Ace指数,分别为435.06±56.17和449.2±56.98;AT组获得最高Shannon指数和Simpson指数,分别为5.32±0.37和0.95±0.02;BT组获得最低Chao1指数、Shannon指数和Simpson指数,分别为239.3±30.95、2.99±0.62和0.68±0.1;BO组获得最低Ace指数,为263.78±88.3。AO组Chao1指数显著高于BT组(P<0.05),且Ace指数显著高于BO组和DO组(P<0.05);AO、AT、CO、CT、DT组Shannon指数显著高于BT组(P<0.05),且BT组Simpson指数显著低于其他各样品组(P<0.05);另外,各组间的Coverage指数和PD_whole_tree指数并无显著性差异(P>0.05)。

表2 各样品组α-多样性指数统计Table 2 Each sample group α-diversity index statistics
2.4 β-多样性分析
使用QIIME软件对各样品进行β-多样性分析,采用基于系统发生树的非加权(Unweighted Unifrac)的计算方法,并结合主成分分析[13](Principal Component Analysis,PCA)和主坐标分析法[14](Principal Coordinates Analysis,PCoA),来比较物种的有无和组间差异。如图4所示,基于Unifrac 非加权主坐标分析的第一主成分贡献值为19.05%,第二主成分的贡献值为11.46%。根据非加权主坐标分析图可以看出,同时期不同密度的对虾养殖池水样存在一定交叠现象(AO和AT),部分样品呈现出明显的聚类现象(BO和BT、CO和CT),不同时期(A、B、C、D四个时间点)水样微生物构成总体上可以分开。

图4 基于系统发生树的微生物菌群结构Unifrac非加权主坐标分析
2.5 功能基因预测分析
如图5所示,基于16S rRNA基因测序,使用BugBase工具[15]预测了潜在的好氧(Aerobic),厌氧(Anaerobic),移动元件含量(contains_mobile_elements),兼性厌氧(facultatively anaerobic),生物膜形成(Forms_Biofilms),革兰氏阴性(Gram Negative),革兰氏阳性(Gram Positive),致病潜力(Potential_Pathogenic),胁迫耐受(Stress_Tolerant)9种微生物表型。其中与好氧、移动元件含量、生物膜形成、革兰氏阴性、致病潜力、胁迫耐受等表型相关的细菌主要由变形菌门细菌构成;与厌氧表型相关的细菌主要由拟杆菌门细菌构成;革兰氏阳性和兼性厌氧表型中的细菌则主要由放线菌门细菌构成。此外,与低密度组相比,高密度组好氧细菌、移动元件细菌、革兰氏阴性细菌、致病性细菌和胁迫耐受细菌丰度较高,且高密度组有较多的生物膜形成,而厌氧细菌、兼性厌氧细菌和革兰氏阳性细菌丰度较低。随着养殖时间的增加,在低密度组下,好氧细菌、移动元件细菌、革兰氏阴性细菌丰度降低,兼性厌氧细菌和革兰氏阳性细菌丰度升高,厌氧细菌、生物膜形成、致病性细菌和胁迫耐受细菌丰度呈现出先降低后升高的趋势;在高密度组下,好氧细菌、移动元件细菌、兼性厌氧细菌、生物膜形成、革兰氏阳性菌细菌丰度呈现出先升高后降低的趋势,厌氧细菌、革兰氏阴性细菌丰度呈现出先降低后升高的趋势,致病性细菌、胁迫耐受细菌丰度降低。

图5 BugBase物种柱状图
3 讨论
3.1 基于门、属水平下的菌群结构和组间差异分析
根据门水平(左)的物种分布柱状图(图1)和物种差异柱状图(图2)可知,在整个养殖过程中,变形菌门和拟杆菌门为养殖水体中的优势菌,平均相对丰度占比90%以上。可能由于对虾数量的增多,产生更多的代谢产物促进了变形菌门细菌的滋生,从而导致高密度组的变形菌门细菌丰度高于低密度组;而高密度组拟杆菌门细菌丰度低于低密度组,可能由于低密度组养殖水体中有较多的饵料残留,致使拟杆菌门细菌滋生。Ramon Rosselló-Mora等[16]经研究发现,养殖环境中未被及时分解的残留饵料会导致拟杆菌门细菌含量增加,然而具体实际情况还有待进一步研究。变形菌门是海洋水体和沉积物中的主要类群[17],其中的α-变形菌和β-变形菌能降解一部分对水体生物有害的烃类有机物[18]。拟杆菌门是海洋水体中重要的微生物类群,是溶解性有机物的主要消费者[19]。这些大量存在的有机物降解菌群能促进养殖水体中有机物降解,从而改善水生动物的生长环境。疣微菌门细菌大多都是不可培养的微生物,目前功能尚不明确[20]。
根据属水平(右)的物种分布柱状图(图1)和物种差异柱状图(图3)可知,与门水平相比,优势菌发生了明显变化。在低密度组和高密度组不同时期养殖水体中的优势菌为海命菌属、uncultured_bacterium_c_Alphaproteobacteria、褐指藻菌属、uncultured_bacterium_f_Saprospiac eae。uncultured_bacterium_c_Alphaproteobacteria和uncultured_bacterium_f_Saprospiaceae尚无准确命名。海命菌属下的细菌在海洋环境中大量存在,但大部分均用作微生物分类用途。褐指藻菌属是色素的一个属分类,隶属于硅藻门,其属下的三角褐指藻是许多水生生物的天然饵料。
3.2 α-多样性指数分析
α-多样性表明了每个样品组的物种丰度(richness)和物种多样性(diversity),涵盖了多个指数数据,具体包括Chao1、Ace、Shannon、Simpson、Coverage和PD_whole_tree指数,来分析养殖水体中的微生物群落的物种类型和丰富程度[21]。Chao1和Ace指数表示物种丰度(物种数量的多少),Shannon和Simpson指数表示微生物种类的多少。在物种数量相同的情况下,菌群各个物种存在越高的均匀程度,则表明菌群的种类越多,物种丰富程度越高。Chao1和Ace数值越高,说明物种的数量越多,Shannon和Simpson数值越大,则说明物种种类越多,越丰富[22]。Coverage表示检测物种的覆盖率,它的数值越大,说明样本中物种被检出的概率越大,而没被检出的概率就越小。根据表2中的统计数据分析可知,在养殖过程中,AO组的物种丰度最高(低密度下第20天养殖水体中物种数量最多),AT组的物种类型丰富程度最高(高密度下第20天养殖水体中物种种类最多),BT组的物种数量和物种丰富程度最低(高密度下第40天养殖水体中的物种数量和物种种类最少)。通过Coverage指数反映的数据可知,各样品组检测物种覆盖率均高于99%,充分反映了养殖水体中菌群种类和数量的实际状况。
3.3 β-多样性分析
β-多样性分析用来对比不同样品组之间的物种多样性是否有相同特征,主要分为两大类算法:加权(Bray-Curtis和Weighted Unifrac)与非加权(Jaccard和Unweightde Unifrac)。加权方法需要同时分析物种是否存在以及物种的数量这两个因素,而非加权方法主要分析比对物种是否存在,如果两个不同样品菌群的β-多样性越小,则表明物种类型越相似。微生物在环境中复杂多样,呈现动态变化的趋势,各物种的组成差异更为显著,因此,在微生物多样性分析中通常使用非加权方法分析。根据该实验的研究内容,选择采用基于系统发生树的非加权方法。由非加权主坐标分析图(图4)可知,在养殖过程中,同一时期的养殖水体中物种类型相似度高,不同时期养殖水体中物种类型差异较大。
3.4 功能基因预测分析
BugBase是一种预测复杂微生物组内功能途径的生物水平覆盖以及生物可解释表型的方法[23-24]。该实验通过BugBase表型预测来揭示养殖水体中各个菌群的功能性状对微生物多样性及群落结构变化的影响,结果表明,在养殖过程中,高密度组与低密度组相比,好氧细菌、移动元件细菌、细菌生物膜形成、革兰氏阴性细菌、致病性细菌和胁迫耐受细菌丰度较高,而厌氧细菌、兼性厌氧细菌和革兰氏阳性细菌丰度较低,究其原因可能是在高密度组养殖水体中的变形菌门一类细菌丰度高于低密度组,而拟杆菌门细菌和放线菌门细菌丰度低于低密度组。随着养殖时间的增加,低密度组部分变形菌门细菌丰度降低,放线菌门细菌丰度升高,拟杆菌门和部分变形菌门细菌丰度先降低,到养殖中期(养殖第40天后)细菌丰度升高,原因可能是在养殖初期,水体中对虾代谢产物和残留饵料较少,拟杆菌门和部分变形菌门细菌滋生较少,到了养殖中后期,随着代谢产物和残留饵料的增加,致使拟杆菌门和部分变形菌门滋生加快,厌氧和兼性厌氧型细菌丰度升高,致病性和胁迫耐受细菌丰度升高。在高密度下,部分变形菌门细菌丰度升高,到养殖中期(养殖第40天后)细菌丰度降低,好氧型和兼性厌氧型细菌丰度降低;部分放线菌门细菌丰度降低,到养殖中期(养殖第40天后)细菌丰度升高,厌氧型细菌丰度升高。另外,在高密度组下,致病性和胁迫耐受程度降低,原因可能是养殖水体中的有益菌含量增加,分解有机物和改善水质的能力有所提高。
4 结论
该实验利用高通量测序技术,对养殖水体中微生物菌群进行多样性分析,揭示了养殖环境中微生物群落多样性以及变化情况,为凡纳滨对虾养殖过程中的水质改善、疾病预防以及开发新的微生物物种资源提供理论依据。
