一株代尔福特菌的分离及其对Cd吸附机制研究
2022-12-02石阳阳徐敏万勤谢黛敏肖笑伍钧
石阳阳,徐敏,万勤,谢黛敏,肖笑,伍钧*
(1.四川农业大学环境学院,成都 611130;2.湖北省丹江口市烟草专卖局,湖北 丹江口 442700)
重金属镉(Cd)具有移动性强,毒性大,污染范围广的特点,其毒性是铅(Pb)的5倍以上,被称为“五毒之首”[1-2]。矿山开采、金属冶炼、污水排放和灌溉等是环境Cd 污染的主要来源。据统计,Cd 污染已经涉及我国11个省(市)的25个地区,Cd污染事件多达60多起[3]。因此,发展高效、环保、经济的Cd污染修复技术势在必行。
微生物具有代谢旺盛、种类丰富、比表面积大等特点,参与重金属的生物地球化学循环过程,在重金属元素的溶解释放、迁移转化和富集沉淀过程中起重要作用。微生物可以通过细胞表面丰富的活性基团吸附Cd2+或分泌大量胞外聚合物,利用聚合物中的羧基、羟基、巯基、氨基、酰胺基和磷酸基等活性基团中的 N、O、P 和 S 等提供的孤对电子与 Cd2+结合,使Cd2+被吸附或形成微沉淀[4-6]。一些微生物还能够通过内流的方式吸收Cd2+,并与胞内的氨基酸或者蛋白质等物质形成低毒络合物富集在细胞内[7-9],或者通过生物矿化作用将Cd2+转化为沉淀物,实现重金属解毒[10-11]。与传统的物理化学修复技术相比,微生物修复技术具有经济、无二次污染的优点,具有良好的生态效益和应用前景,近年来受到了广泛关注[6]。
微生物对Cd的固持效果和稳定性取决于其作用机制,不同微生物与Cd 之间的相互作用具有复杂性和差异性。开展Cd 耐受微生物资源的挖掘,并明确其Cd固持机制非常必要。本研究从冶炼厂废弃地土壤中分离筛选出一株耐Cd 细菌菌株,初步鉴定为Delftia菌。Delftia菌属 1999 年由 WEN 等[12]发现,目前主要应用于降解有机污染物和修复重金属污染。刘玉 玲等[1,13]和 LIU 等[14]研究 发现Delftiasp. B9 能 促使土壤中的Cd由弱酸可溶态转化为可还原态和残渣态,接种10 mL 菌悬液后土壤中弱酸可溶态Cd 含量降低25.1%[1]。Delftiasp. B9 可降低水稻幼苗根、茎、叶中的Cd 含量[13],接种其活体菌株以及灭活菌体均能有效降低水稻籽粒的Cd 含量[14]。AMER 等[15]筛选分离出的Delftia acidovoransPb11 可利用Pb2+并将其还原为 Pb。BISWAS 等[16]报道了Delftiaspp.BAs29 对As(Ⅲ)的生物转化,其可通过氧化酶将As(Ⅲ)氧化为较稳定的As(Ⅴ),并利用氧化反应释放的能量维持生存。LI等[17]发现胞外蛋白在Au3+解毒过程中发挥重要作用,纳米金颗粒可能是Delftia tsuruhatensissp.GX-3的胞外溶质结合蛋白或孔蛋白将电子转运给Au3+形成。
然而目前关于Delftia对Cd 的解毒机制鲜有报道,基于此,本研究通过分析其对Cd最佳吸附条件及细胞内外的Cd 分布,利用扫描电镜、傅里叶变换-红外光谱分析以及X射线光电子能谱分析,观察细胞形态,分析Cd 处理后细胞表面官能团的变化以及Cd 在菌体表面存在形态,以期为微生物修复Cd 污染技术提供理论支撑。
1 材料与方法
1.1 供试材料
土壤采自四川西部某铅锌冶炼厂废弃地,采集深度为0~20 cm。采集样点5个,分别标记为S1~S5。采集的土样装入无菌自封袋,并置于冰箱4 ℃保存备用。土壤pH及重金属含量如表1所示。

表1 土壤pH和重金属含量Table 1 pH and heavy metals content of soils
采用LB 培养基培养细菌。LB 液体培养基:胰蛋白胨 10.00 g·L-1、NaCl 10.00 g·L-1、酵母粉5.00 g·L-1,pH 7.0~7.2,高压蒸汽灭菌121 ℃,30 min。LB 固体培养基则加入1.5%琼脂粉,其他操作同液体培养基。试验药品CdCl2·2H2O、HNO3、HClO4均为优级纯,试验用水均为高纯水。
1.2 耐镉菌株的分离与筛选
用CdCl2·2H2O 和高纯水配制浓度为1 000 mg·L-1的Cd母液,取适量Cd母液加入液体LB 培养基,使Cd 浓度达到预设浓度。取Cd 浓度为10 mg·L-1的液体培养基45 mL 置于装有玻璃珠的150 mL 锥形瓶中,灭菌后分别加入 S1~S5 土样 5 g,在 30 ℃、120 r·min-1振荡培养3 d 后,移取5 mL 转接入Cd 浓度为50 mg·L-1液体培养基中,在30 ℃、120 r·min-1振荡培养3 d,并继续转接3 次,直至液体培养基中Cd 浓度为200 mg·L-1。取最后一次转接的培养液0.3 mL,以10倍比稀释法稀释后涂布于LB 固体培养基平板上,并在30 ℃的恒温培养箱中倒置培养96 h。观察菌落生长状况和特点,挑选不同形态的单菌落提纯,将得到的纯菌种进行保存。
将50 mL 无Cd 液体培养基置于150 mL 锥形瓶中,接种上述分离出的纯菌株,30 ℃、120 r·min-1培养1 d 后在3 500 r·min-1下离心 10 min,收集菌体,用无菌水洗涤两次后制成菌悬液(OD600=1.5)。按照2%接种比例将菌悬液接入初始Cd 浓度为10、50 mg·L-1的液体培养基中,不接菌的处理作为空白对照,30 ℃、120 r·min-1振荡培养 2 d 后于 4 ℃、8 000 r·min-1离心10 min,收集上清液,上清液经0.22µm 滤膜过滤后用HNO3消解,ICP-MS(Agilent 7700s,美国安捷伦科技公司)测定Cd含量,筛选出Cd吸附效果最好的菌株。
1.3 菌株鉴定
将筛选得到的菌株划线接种于固体培养基平板上,置于恒温恒湿培养箱,30 ℃倒置培养3 d,观察菌落形态。菌液送至成都擎科生物技术有限公司测序。获得的序列用NCBI-Blast 比对,利用软件MEGA7.0构建系统发育树。
1.4 培养条件对菌株Cd吸附效果的影响
1.4.1 菌株生长曲线
将菌株接种至无Cd 液体LB 培养基,于30 ℃、120 r·min-1培养 1 d 后,3 500 r·min-1离心 10 min 收集菌体,用无菌水洗涤两次后制成菌悬液,按照2%接种比例将菌悬液接入初始Cd浓度为0、10、100 mg·L-1的液体LB 培养基中,30 ℃、120 r·min-1振荡培养,每个处理设置3 个重复。在0~54 h 周期中,每隔3 h 取样测定OD600,绘制不同Cd浓度下的生长曲线。
1.4.2 pH对菌株Cd吸附效果的影响
将50 mL Cd浓度为10 mg·L-1的LB液体培养基置于150 mL 锥形瓶中,调节pH 值分别为5、6、7、8、9,灭菌后按照2%接种比例接入菌悬液,30 ℃、120 r·min-1振荡培养2 d后测定OD600并收集上清液,上清液收集及Cd含量测定方法同1.2。每个处理设置3个重复。
1.4.3 温度对菌株Cd吸附效果的影响
将 50 mL 初始 Cd 浓度为 10 mg·L-1、pH 为 7 的液体培养基灭菌后按照2%比例接入菌悬液,分别在10、20、30、35、40 ℃,120 r·min-1下振荡培养2 d 后测定OD600并收集上清液,上清液收集及Cd 含量测定方法同上。
1.4.4 初始Cd浓度对菌株Cd吸附效果的影响
按照2%比例接入菌悬液至Cd 浓度分别为10、50、100 mg·L-1,pH 为 7 的液体 LB 培养基中,30 ℃、120 r·min-1振荡培养。在培养的第18、24、36、48、72小时取样,上清液收集及Cd含量测定方法同上。
1.5 菌株对Cd吸附机理研究
1.5.1 Cd在胞外与胞内分布
30 ℃下将菌悬液按照2%比例接种于Cd 浓度为10、100 mg·L-1的50 mL 液体培养基中,120 r·min-1振荡培养,分别于培养第1、3、5 天取样。样品于4 ℃、8 000 r·min-1离心 10 min 后收集菌体。胞外 Cd 吸附量的测定参考喻涌泉等[18]和HAN等[19]的方法,将菌体用无菌水清洗 2~3 次,随后用 10 mmol·L-1的 EDTA 洗涤液洗涤3 次。合并全部洗涤液,测定洗涤液中Cd含量,即胞外Cd吸附量。收集沉淀菌体,真空冷冻干燥后称质量,用HNO3和HClO(43∶1)高温消解后测定Cd含量,计算菌体胞内Cd积累量。
1.5.2 扫描电镜分析
将菌悬液按照2%比例分别接种到Cd 浓度为0、100 mg·L-1的液体培养基中。30 ℃、120 r·min-1振荡培养3 d后收集菌体沉淀,方法同上。菌体用2.5%戊二醛固定,经过乙醇梯度脱水、临界点干燥以及喷金等操作后用场发射扫描电镜(SU8010,日本HITACHI公司)观察Cd处理前后菌体形态特征。
1.5.3 傅里叶变换-红外光谱分析
按照2%比例接种菌悬液于Cd 浓度为0、10、100 mg·L-1液体培养基中,细菌培养及菌体收集方法同上,将收集到的菌体沉淀置于-80 ℃冰箱冷冻过夜后真空冷冻干燥。取干燥的菌粉与溴化钾按照1∶50 质量比在红外灯下研磨压片后用傅里叶红外光谱分析仪(TENSOR 27,德国BRUKER 光谱仪器公司)分析菌体表面官能团的变化。
1.5.4 X射线光电子能谱分析
按照2%比例将菌悬液接入Cd 浓度为100 mg·L-1的LB 液体培养基,细菌培养及菌体收集方法同上。将真空冷冻干燥后的菌体沉淀用X 射线光电子能谱仪[Thermo Fisher Scientific K-Alpha,赛默飞世尔科技(中国)有限公司]进行分析。
1.6 数据处理
使用Excel 2016 进行数据分析和处理,采用SPSS 19.0 进行显著性分析,XPSPEAK41 软件拟合XPS光谱,Origin 9.0制图。
2 结果与分析
2.1 菌株的分离筛选与鉴定
通过富集培养、分离纯化后得到14 株细菌,编号为M1~M14。培养结束后测定液体培养基中Cd 剩余量发现,Cd浓度为10 mg·L-1时,菌株M6对Cd吸附效果最好,吸附率为70.5%,其次为M9,吸附率为57.6%,其他菌株对Cd吸附率较低,在13.4%~37.3%之间。当提高Cd浓度至50 mg·L-1时,菌株Cd吸附率均下降,但M6 的Cd 吸附率依旧最高。根据Cd 吸附结果筛选出对Cd吸附效果最好的菌株M6进行下一步实验。
由图1a和图1b可知,菌株M6的菌落在固体培养基平板上呈乳白色,表面光滑湿润,边缘整齐,扫描电镜图中菌体呈杆状。16S rRNA 序列对比结果如图1c所示,M6 与菌株Delftiasp.12(KJ191561.1)的同源性达到100%,初步确定M6为Delftia菌。

图1 菌株M6形态特征(a)、扫描电镜图(b)和16S rRNA基因序列的系统发育树(c)Figure 1 Morphological characteristic of strain M6(a),scanning electron microscopy image(b),and phylogenetic tree of 16S rRNA(c)
2.2 培养条件对菌株Cd吸附效果影响
2.2.1 菌株生长曲线
生长曲线能够在一定程度上反映微生物生长数量和生长状况。图2 是菌株M6 在Cd 浓度分别为0、10、100 mg·L-1的液体培养基中的生长曲线。随着Cd浓度提高,菌株在进入生长稳定期后的细胞密度均出现不同程度的降低,且高浓度Cd 使菌株生长出现延滞。当Cd 浓度为10 mg·L-1时,对M6 的生长抑制作用较小。当Cd 浓度为100 mg·L-1时,菌株进入对数生长期时间比CK延长9 h,稳定期菌株生长量降低。

图2 菌株生长曲线Figure 2 Growth curve of strain
2.2.2 培养pH、温度、Cd浓度对Cd吸附效果的影响
培养pH、温度、初始Cd 浓度对菌株M6 生长及其Cd 吸附效果的影响分别如图3a~图3c 所示。由图3a可知,pH 的变化显著影响M6 对Cd 的吸附效果及其生长状况。在培养温度为30 ℃、Cd 浓度为10 mg·L-1时,随着pH 增加,菌株Cd 吸附量和细胞密度均表现为先增加后减少。pH小于7时,菌株M6对Cd的吸附量、吸附率和细胞密度随pH 增高而增加,pH 大于7时,其随pH 增加而下降,当pH 为7 时吸附效果最佳,最大吸附率为68.4%。
培养温度对菌株Cd 吸附效果影响如图3b 所示。Cd 浓度为 10 mg·L-1、pH 为 7 时,菌株细胞密度及 Cd吸附量随着温度升高呈现先增高后降低的趋势。在10~35 ℃范围内,菌株细胞密度及Cd吸附量随着温度升高而增高;温度继续升高时,细胞密度和Cd吸附量均下降。温度范围为30~35 ℃时菌株细胞密度较大,对Cd吸附效果较佳,最高吸附率为71.8%。

图3 pH值、温度和Cd浓度对菌株Cd吸附效果的影响Figure 3 Effects of pH,temperature and Cd concentration on strain growth and its Cd adsorption capacities
初始Cd 浓度对菌株Cd 吸附效果影响如图3c 所示。培养温度为 30 ℃、pH 为 7、初始 Cd 浓度由 10 mg·L-1升高至100 mg·L-1时,吸附达到稳定所用时间由 36 h 延长至 48 h。初始 Cd 浓度为 10 mg·L-1时,稳定后的Cd吸附率最高,为71.3%。初始Cd浓度升高,Cd 吸附率降低,当 Cd 浓度升高至 50 mg·L-1时,吸附率下降至32.8%。Cd 浓度由10 mg·L-1增加至100 mg·L-1的过程中,菌株 M6 对 Cd 的吸附量由 7.04 mg·L-1增加至36.73 mg·L-1。
2.3 菌株Cd吸附机制研究
2.3.1 菌株对Cd的胞外吸附与胞内积累
为了探究菌株M6 对Cd 的固持机制,测定了Cd浓度为10 mg·L-1和100 mg·L-1培养下1、3、5 d时菌株胞外吸附量和胞内积累量。由图4 可知,相同培养时间下,随着Cd 浓度提高,菌株Cd 吸附总量显著增加。随着时间的增加,胞内Cd 积累量呈现先增加后降低的趋势,培养至第5 天时,胞外吸附量均显著高于胞内积累量。Cd浓度为100 mg·L-1时,胞外吸附量随着时间的延长不断增加,而总积累量却呈现先增加后降低的趋势。

图4 菌体胞内Cd积累和胞外吸附情况Figure 4 Extracellular adsorption and intracellular accumulation of Cd in strain
2.3.2 扫描电镜分析
图5 为Cd 处理前后菌体电镜扫描图,Cd 处理前后M6 菌体形态有明显变化。无Cd 处理组菌体形状为杆状,表面光滑;Cd 处理后,菌体表面变得粗糙。与无Cd 处理相比,Cd 处理后菌体表面出现颗粒状沉淀物质。

图5 菌株在空白组(a)和100 mg·L-1 Cd处理组(b)的扫描电镜图Figure 5 SEM images of strain without(a)and with(b)100 mg·L-1 Cd treatment
2.3.3 傅里叶-红外光谱分析
Cd 处理浓度为 0、10、100 mg·L-1的 FTIR 谱图如图6 所示。菌体表面具有丰富的官能团,位于3 305 cm-1处较宽的吸收峰代表的振动;2 960 cm-1和2 926 cm-1处吸收峰代表细胞膜磷脂脂肪酸中的伸缩振动;1 655 cm-1和 1 543 cm-1处吸收峰代表酰胺Ⅰ带和细胞蛋白质酰胺Ⅱ带的弯曲振动与伸展);1 453 cm-1处吸收峰为肽链中面内弯曲振动;1 402 cm-1处吸收峰是蛋白质酰胺Ⅲ带或肽链末端羧基对称伸缩振动;1 239 cm-1处的吸收峰是脂质和多糖的伸缩振动峰;1 088 cm-1处吸收峰是磷酸基团以及胺基中的等引起;659 cm-1处吸收峰代表蛋白质酰胺带;548 cm-1处吸收峰是和的振动吸收峰。
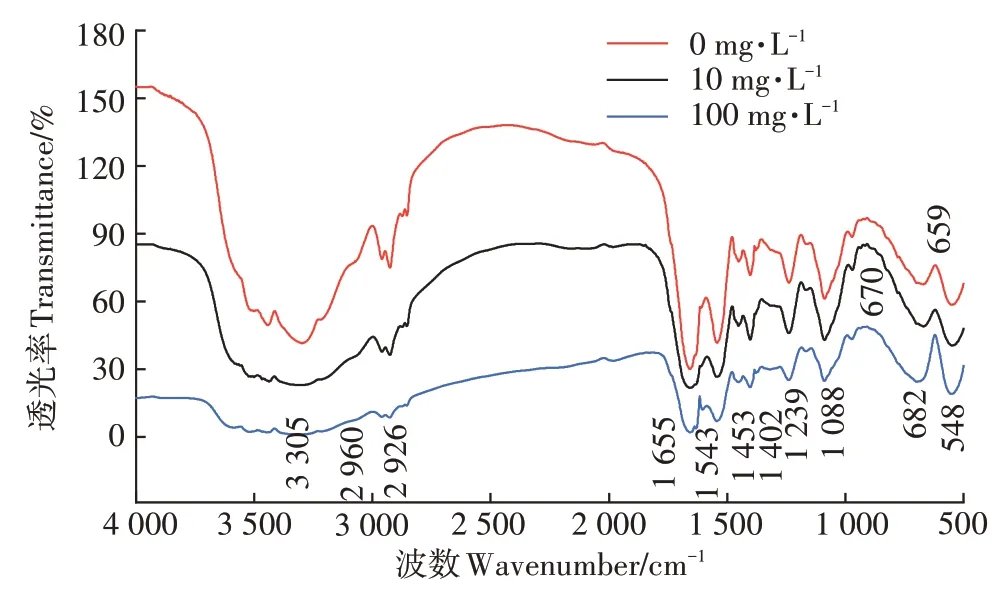
图6 菌株吸附Cd前后的傅里叶-红外光谱图Figure 6 The FTIR spectrograms of strain before and after adsorption of Cd
由图6 可知,与无Cd 处理相比,接触Cd 后位于659 cm-1处吸收峰增强变宽并逐渐向高波数偏移,Cd处理浓度为100 mg·L-1时峰位偏移至682 cm-1处,表明菌体中的蛋白质酰胺带可能参与了Cd 的吸附固定。另外,随着Cd 浓度升高,位于548 cm-1处吸收峰变强,说明Cd 处理使和基团增加在结合Cd过程中发挥了重要作用。其他吸收峰的变化体现在峰强逐渐减弱,高浓度Cd 处理后这些吸收峰的峰强明显比无Cd 处理弱,说明这些官能团活跃地参与了Cd络合作用。
2.3.4 X射线光电子能谱分析
为确定吸附Cd2+后菌体表面Cd形态,对菌体进行扫描分析,M6吸附Cd2+后的XPS谱图如图7所示。
对O1s 峰进行拟合,由图7 可知,O1s 峰可分为2个亚峰,结合能为531.23 eV 处的谱峰代表532.67 eV 处的谱峰代表C1s 峰拟合后分成 3 个亚峰,分别位于 284.8、286.3 eV 和 287.8 eV处,284.8 eV 和 287.8 eV 处的谱峰代表长链或可能与结合[22-23],286.23 eV 处谱峰可能是化合物[24]。Cd3d5/2 谱峰包括位于404.8eV和405.6eV的2个亚峰,分别代表Cd(OH)2和说明菌体表面可能存在Cd(OH)2和CdCO3沉淀。
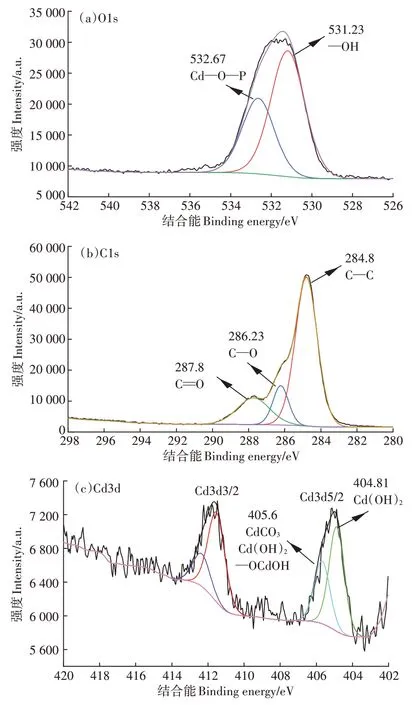
图7 菌株吸附Cd后的XPS谱图Figure 7 XPS spectra of strain after Cd adsorption
3 讨论
3.1 培养条件对菌株Cd吸附效果的影响
微生物对重金属的吸附效果受其种类、生长状况和培养环境的影响较大。为了探求菌株M6 最佳Cd吸附条件,本研究分析了pH、温度、初始Cd浓度对Cd吸附效果的影响。环境pH 可以影响菌株的生长、吸附电位的性质以及重金属在溶液中的存在形态,进而影响菌株Cd 吸附效果[18]。pH 较低时,液体培养基中过多的H+会与Cd2+竞争菌体表面吸附位点;pH 较高时,液体培养基中的Cd2+会以氢氧化物形式存在,附着在菌体表面,覆盖部分吸附位点,从而降低菌体对Cd 的吸附量[1]。有研究表明,Delftiasp.最适生长的pH 为7.0,pH 过低会降低菌株生长量和Cd 吸附位点数量,使Cd 吸附量下降[26]。本研究中pH 低于7 和高于7 均不利于菌体生长和Cd 吸附,当pH 为7 时菌株生长状况最佳,Cd 吸附量显著高于其他pH 处理,说明最适宜M6 生长和吸附Cd 的环境pH 为7。温度不仅影响细胞表面官能团的电离活性,而且影响官能团与重金属离子形成络合物的稳定性[18]。温度过高和过低不仅不利于菌株生长,而且会降低其表面官能团与Cd2+的亲和性以及吸附Cd2+过程中需要的活化能,进而降低菌株的Cd吸附量[1,18]。本研究中M6在35 ℃时Cd吸附量最大,与刘玉玲等[1]的研究结果一致。
本研究发现,随着Cd 浓度的提高,M6 的生长出现迟滞,进入稳定期的时间延长,且稳定期细胞密度下降,说明高浓度Cd 对M6 的生长有明显抑制作用。整体而言,M6 的生长及其对Cd 的吸附量仍较高,表明M6 对Cd 具有较强的耐受性。微生物吸附重金属的能力与菌株表面吸附位点的饱和程度密切相关[27]。低浓度Cd对M6生长的抑制作用较小,吸附位点数量较多且未达饱和状态,能与液体培养基中的Cd2+充分结合,增加吸附量。当Cd 浓度逐渐增加时,M6 对Cd的吸附量增加,但是吸附率却下降,这可能是因为菌体表面吸附位点被大量的Cd2+占据,同时高浓度Cd抑制了M6的生长,所提供的吸附位点数量减少。
3.2 菌株对Cd吸附机理
通过研究Cd 在菌体胞内胞外的分布发现,在培养过程中,胞内Cd积累量呈现先增加后降低的趋势,最终以胞外吸附为主。胞内Cd积累量的变化趋势与活细胞能将过多的金属离子排出细胞质的观点相吻合,这可能是一种细胞解毒方式[18]。而通过主动运输方式吸收Cd2+,将Cd2+转化为无毒的沉淀或隔离在胞内特定区域以降低环境中Cd2+浓度,提高抗性则是胞内解毒的重要途径[9]。当Cd 浓度为10 mg·L-1时,菌体Cd 积累总量随着吸附时间的延长逐渐降低,这可能是由于菌株生长较快,消耗了培养液中的营养物质使其生物量快速趋于稳定,部分菌体出现了Cd2+解吸的现象,或者是其生长代谢产物及Cd对M6产生了毒害作用,降低了吸附量[28]。而高浓度Cd处理下,Cd积累总量却表现为先增加后降低,这可能是由于Cd浓度较高时菌株生长较慢,在菌株生物量逐渐增加至稳定的过程中菌体Cd积累总量逐渐增加。随着时间延长,高Cd处理下部分细胞破裂,胞内积累的Cd释放到培养液中,而其中只有一部分Cd被暴露的吸附位点或菌体表面吸附,从而导致后期菌体Cd积累总量降低。含Cd培养下M6菌体表面的不规则颗粒沉淀物可能是Cd对菌体造成的胁迫作用促使其产生了分泌物将Cd2+沉淀在细胞表面以降低其毒性[19,29]。这说明胞外沉淀很可能是菌体对Cd固定的机制,也是其吸附Cd的重要原因。
傅里叶-红外光谱分析官能团变化发现,与无Cd处理相比,吸附Cd 后659 cm-1处吸收峰变宽变强、548 cm-1处吸收峰变强,这可能是因为高浓度Cd毒性较强且造成胞内外渗透压差异过大,破坏了细胞结构,使细胞暴露出更多活性基团[30]。随着Cd 浓度提高、细胞膜磷脂脂肪酸中的蛋白质酰胺Ⅱ带、肽链中、蛋白质酰胺Ⅲ带或肽链末端羧基、脂质和多糖的、磷酸基团以及胺基中的的作用增强,使代表这些基团的吸收峰强度逐渐减弱,说明Cd浓度的提高增强了多种官能团对Cd 的吸附作用,这与前人研究结果一致[29-32]。
目前微生物对Cd 固持机制主要有胞外吸附、胞内富集、沉淀、诱导矿化等[18,29,33]。与胞外吸附和胞内富集作用相比,沉淀和诱导矿化作用形成的化合物较稳定[34]。部分微生物利用其表面的一些特殊的蛋白质、官能团或其代谢过程产生的分泌物对重金属离子产生螯合作用或诱导产生固相矿物、沉淀,以降低其生物毒性[19,35-36]。前人研究表明,微生物对重金属的固持可能是一种复杂的、多种反应共同作用的过程[37]。菌株分泌物以及细胞表面官能团在降低重金属迁移性方面发挥着重要的作用。GUPTA 等[38]研究表明枯草芽孢杆菌螯合的Pb 中有8.5%通过物理作用固定在细胞壁,9.7%与细胞表面的官能团络合或在细胞表面沉淀。杨礴东[36]研究表明,菌Ⅰ对Cd固定部位以胞外为主,胞内和细胞膜部位仅占22.09%和2.01%。菌体表面参与Cd 吸附固定的有OH、COOH、仲酰胺等基团,X 射线光电子能谱分析发现菌体表面存在Cd(OH)2沉淀。目前关于Delftia对Cd 固持机制的研究较少,李杨等[4]研究表明,Delftia菌体表面的羧基和氨基参与Cd 和As 的络合反应。本研究发现,分离出的菌株M6 对Cd 具有较好的吸附效果,其对Cd 的固持以胞外固定为主,固持机制包括胞内积累、胞外吸附和胞外沉淀,菌体表面可能存在Cd(OH)2和CdCO3沉淀。
4 结论
(1)从重度Cd 污染土壤中分离筛选出1 株对液体培养基中Cd 吸附效果最佳的菌株,命名为M6,经鉴定为Delftiasp.。其最佳吸附条件为温度35 ℃、pH=7、培养时间 48 h,初始Cd 浓度为 10 mg·L-1时吸附率最高,为71.8%。
