早产儿维生素D 营养状况及活性维生素D 补充对骨代谢的影响
2022-12-02何云霞黄久浪
何云霞, 黄久浪
(四川省遂宁市中心医院新生儿科, 四川遂宁 629000)
早产儿是指胎龄<37 w 的新生儿。 近年来, 随着围生期医学的发展、 新生儿诊疗技术的提高, 早产儿存活率越来越高, 而同时伴随的营养不良和发育问题也得到越来越突出, 其中, 维生素D 缺乏对于早产儿来说极为普遍[1]。 维生素D 缺乏与早产儿代谢性骨病密切相关, 严重影响着早产儿的体格发育, 临床应对代谢性骨病主要依靠维生素D 和钙磷制剂的补充。 本研究收集在本院分娩的早产儿为研究对象, 旨在探索早产儿维生素D 营养状况, 以及活性维生素D 补充治疗对早产儿骨代谢指标的影响。
1 材料与方法
1.1 一般资料
研究对象选自我院2020年7月—2021年12月出生的80例28~37 w 早产儿和80例同期出生的足月儿。 纳入标准为产妇孕前和孕期无疾病, 新生儿无先天性畸形; 产妇孕前无吸烟、 饮酒和药物滥用; 产妇孕期无干扰维生素D 吸收及代谢药物使用史。 排除标准为早产儿患有新生儿窒息、 遗传代谢性疾病、 严重感染性疾病、糖尿病母亲婴儿、 新生儿呼吸窘迫综合征等严重疾病。经纳入和排除后, 共纳入80例早产儿为研究组, 同期出生的80例足月儿为对照组。 本研究已经过本院伦理委员审核批准, 所有研究对象家属均已签署知情同意书。
1.2 方法
取得所有参与者同意, 留取脐带血4 ~5 mL, 放入4℃冰箱保存, 24 h 内离心取血清, -20℃保存。 采用ELISA 测定技术测定血清骨钙素(OC) 、 25-羟维生素D3[25 (OH) D3]及碱性磷酸酶(ALP) 水平; 采用全自动生化分析仪测定血清钙、 磷水平。 根据维生素D 缺乏标准, 将血清25 (OH) D3水平<20 μg/L 定义为维生素D 缺乏组, 血清25 (OH) D3水平≥20 μg/L 定义为非维生素D 缺乏组。 80例早产儿于能经口喂养时, 添加维生素D 800 U/d (维生素D 滴剂), 平均添加时间为(10.03±1.23) d, 于出生28 d 后复查血清25 (OH) D3、OC、 ALP、 钙和磷水平。 营养管理按照新生儿营养支持应用指南[2], 出院后随访喂养情况, 并予以适当营养指导。分析早产儿维生素D 营养状况, 比较28 d 后早产儿血清维生素D 水平变化和骨代谢指标变化情况。
1.3 统计分析
应用SPSS 20.0 软件对数据进行统计学处理。 计量资料采用均数±标准差表示, 采用研究组与对照组数据比较采用两样本独立t检验进行分析, 维生素D 干预28 d后与干预前数据比较采用配对t检验; 计数资料用率表示, 采用χ2检验进行统计分析,P<0.05 为差异有统计学意义。
2 结果与分析
2.1 两组新生儿一般情况描述
如表1 所示, 早产儿胎龄更短, 剖宫产比例更高,且婴儿体重、 身高、 头围更小, 差异均有统计学意义(P<0.05)。
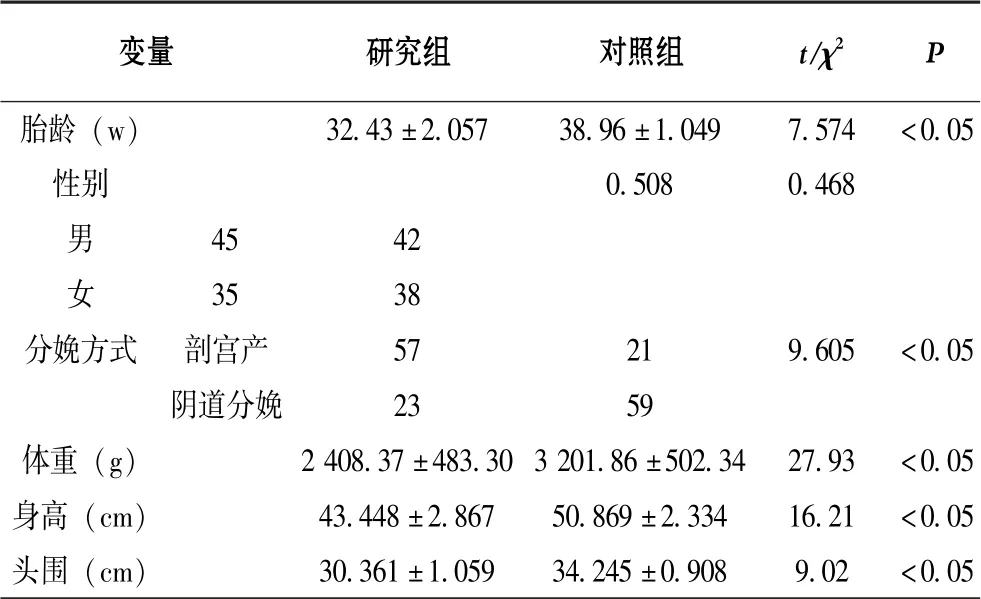
表1 2 组新生儿一般情况比较
2.2 早产儿维生素D 营养状况
由表2 可知, 早产儿血清25 (OH) D3平均水平为(22.03±2.48) μg/L, 显著低于对照组的(26.43 ±2.59) μg /L, 差异有统计学意义(P<0.05)。 且早产儿维生素D 缺乏率也显著高于正常新生儿(32/80 vs 12/80,P<0.05)。
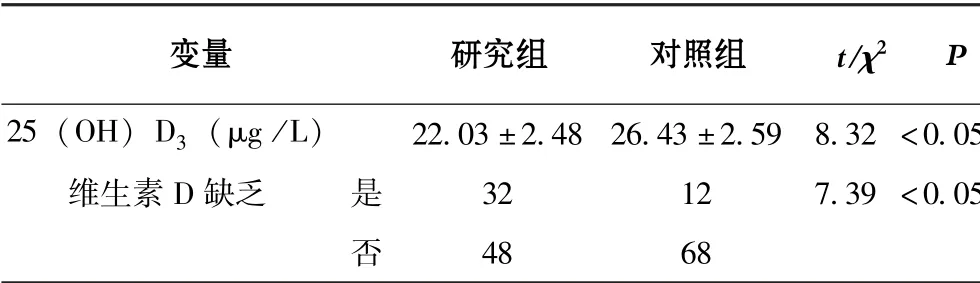
表2 2 组新生儿血清维生素D 水平比较
2.3 活性维生素D 补充对早产儿骨代谢的影响
早产儿经28 d 的活性维生素D 补充, 结果发现,血清25 (OH) D3[ (24.32±3.01) vs (22.03±2.48)]μg /L、 OC [ (78.32±28.92) vs (70.25±32.02)]μg/L 及ALP [ (526.38 ±32.29) vs (483.92 ±38.83)]IU/L 均显著增高(P<0.05), 而血清钙及磷水平无差异(P>0.05) (表3)。
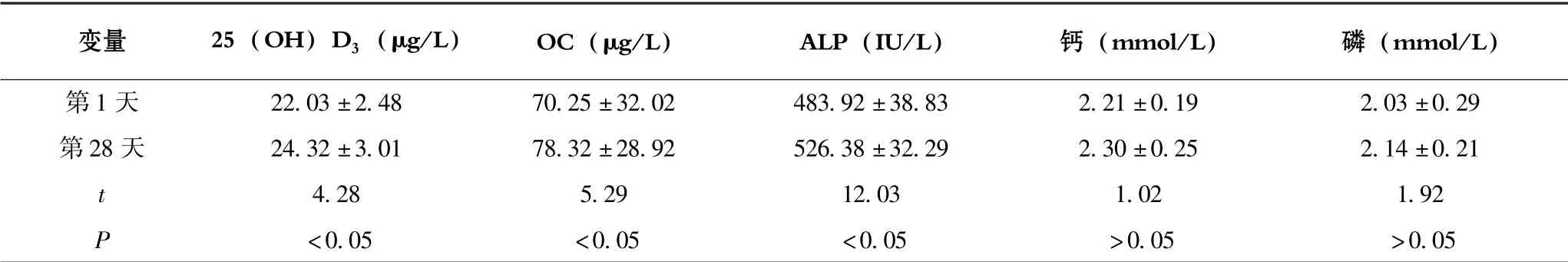
表3 活性维生素D 补充对早产儿骨代谢的影响
3 讨论
婴幼儿时期 维生素D 缺乏广泛存在, 研究显示,即使是健康的儿童也普遍存在维生素D 缺乏[3], 而早产儿维生素D 缺乏率则显著高于健康新生儿[4], 原因可能是早产儿胃肠道结构和功能不成熟, 肾脏发育不成熟,钙磷经尿液排出增加相关, 另外, 早产儿出生后一般会长时间进行肠内外营养支持, 限制全面营养的摄入, 如钙磷、 维生素等骨矿物质, 而出生后追赶性增长对钙磷需求量较高, 但身体不能及时自行合成维生素D, 进而导致早产儿维生素D 缺乏率显著增高[5]。 维生素D 的缺乏会导致早产儿代谢性骨病发病率增高, 即生后骨矿化落后于适于胎龄的宫内骨密度, 此种疾病在出生胎龄越小的早产儿中更为常见[6], 研究显示, 胎龄<28w 的早产儿, 代谢性骨病发病率可高达30%, 严重影响了早产儿的骨骼健康发育, 也与成年期骨病密切相关[7]。 因此维生素D 补充对早产儿骨发育至关重要。
维生素D 在体内的活性形式为1, 25-二羟维生素D3[1, 25 (OH)2D3], 在体内发挥者促进小肠黏膜对钙、 磷的吸收及肾小管对钙、 磷的重吸收, 是影响钙在体内代谢的重要因素。 维生素D 对骨的作用表现为, 既可促进骨骼生长与钙化, 又可促进骨吸收, 以维持血清钙、 磷的正常水平。 25 (OH) D3是维生素D 代谢的中间产物, 也是合成活性1, 25 (OH)2D3的前体, 是反映体内维生素D 营养状况的最佳指标[8]。 刘颖等[9]研究结果表明, 早产儿血清25 (OH) D3平均水平为(17.0 ±7.0) μg/L, 处于缺乏水平, 本研究纳入的80例早产儿血清25 (OH) D3平均水平为(22.03 ±2.48) μg/L,显著低于对照组的(26.43 ±2.59) μg/L, 且缺乏率也显著高于正常新生儿[ (32/80) vs (12/80)]。 早产儿维生素D 状况除了受自身发育影响, 研究还表明与母亲孕期维生素D 营养状况相关, 孕期维生素D 补充不足是早产儿发生维生素D 缺乏的危险因素[9], 故应关注女性孕期维生素D 营养状况, 以及维生素D 的充足补充。
骨代谢标志物是检测骨质形成及成骨破骨状态的重要指标, 能有效评估骨骼生长发育状态, 为临床疾病诊治提供有效依据。 OC 是调节钙磷代谢的重要激素之一,由成熟的成骨细胞分泌的骨非胶原蛋白, 其生理功能尚不明确, 但普遍认为与骨形成及转化有关, 被认为是一种特异且敏感的骨形成标志物。 近年来研究显示, 维生素D 对OC 的分泌及功能发挥起着重要作用, 可能是维生素D 活性形式1, 25 (OH)2D3在原始的人类成骨细胞的分化过程中具有刺激OC 分泌和mRNA 表达的作用相关[10]。 本研究结果显示, 对早产儿进行28 天的活性维生素D 补充, 即可使血清OC 水平显著增高, 表明维生素D 可是成骨细胞活跃, 进而促进骨骼发育。 ALP 是成骨细胞活性的标志, 是临床诊断佝偻病的重要指标。ALP 活力随着年龄呈现波动变化, 从年龄分组来看,ALP 在婴儿期和青春期前显著高于其他年龄段, 这与婴儿期和青春期体格快速发育相关[11]。 而对于早产儿,本研究发现, 补充活性维生素D 可显著提高血清OC 水平, 进而促进早产儿骨骼发育, 满足追赶性生长的物质需求。 另外, 血清磷水平是早期诊断代谢性骨病的重要指标[12], 且磷对矿物质代谢及佝偻病的诊断具有特异性, 当早产儿血清磷水平<2 mmol/L 时, 表明矿物质不足, 当<1.8 mmol/L 时, 常存在明显的佝偻病影响学改变[13]。 但血钙水平对骨代谢无特异性, 当血钙水平发生异常时, 身体会牺牲一部分骨钙以维持血钙水平的正常, 且即使身体处于低磷状态, 仍可表现为正常血钙水平。 本研究结果表明, 虽然活性维生素D 补充未使血清磷水平显著增高(P>0.05), 但处于上升趋势, 表明骨代谢处于活跃状态。
综上所述, 早产儿维生素D 营养状况不佳, 缺乏率高达40%。 活性维生素D 补充可显著改善骨代谢指标,包括血清OC、 ALP 水平的增高, 改善钙磷代谢, 以促进早产儿骨骼发育。 故对于存在早产风险的新生儿, 一方面在产妇孕期即要关注维生素D 营养状况, 充足补充维生素D 及钙磷制剂, 另一方面, 要密切关注早产儿维生素D 营养状况, 及时补充, 纠正不足, 以满足骨骼发育的物质需求, 实现追赶性生长。
