基于网络药理学探讨杜仲叶的营养价值与作用机制
2022-12-02张宝军王健英
张宝军, 张 磊, 王健英
(上海中医健康服务协同创新中心/上海中医药大学, 上海 201203)
杜仲叶为杜仲科植物杜仲(Eucommia ulmoides) 的干燥叶, 性温, 味微辛, 具有补肝肾、 强筋骨的功效,可用于治疗肝肾不足、 头晕目眩、 腰膝酸痛、 筋骨痿软等症状[1]。 现代药理研究表明, 杜仲叶富含黄酮类、 环烯醚萜类、 苯丙素类、 木脂素类、 酚类、 杜仲胶、 多糖类等化学成分[2], 具有免疫调节、 降脂降糖、 抗衰老、抗氧化、 抗炎、 抗骨质疏松等多种保健作用[3]。 2019年国家卫生健康委同国家市场监管总局将杜仲叶列入党参等9 种试点按照传统既是食品又是中药材的物质名单[4], 作为一种药食同源物质, 历年来杜仲叶已广泛应用于功能性健康食品领域, 相关产品种类繁多, 诸如杜仲叶复合保健饮料[5]、 发酵醋[6]、 保健牙膏[7]、 超微粉馒头[8]、 茶饮[9]等。 目前, 杜仲叶的研究主要集中在某一类成分的提取分离、 质量控制、 含量测定、 动物实验等方面, 杜仲叶相关健康产品的研究更偏向于制备工艺方面, 然而从分子水平系统阐述杜仲叶整体营养功能及评价的研究鲜有报道, 在一定程度上限制了其新型食品资源的开发与利用。 网络药理学作为一种有效预测药物靶点和分子机制的分析手段, 因其整体性、 系统性和综合性的属性特征与中药多成分、 多靶点、 整体性的特点具有高度的相似性[10], 目前已广泛应用于食品、 药品领域。 本研究运用网络药理学研究方法, 对杜仲叶潜在关键靶点及信号通路进行挖掘分析, 探讨杜仲叶营养价值与作用机制, 以期为杜仲叶药食同源类健康产品的开发提供理论依据和科学依据。
1 材料与方法
1.1 杜仲叶化合物信息及潜在靶点的获取
基于中药系统药理学数据库与分析平台TCMSP(https: / /www.tcmsp-e.com/) 检索, 以“杜仲叶” 为关键词, 获取杜仲叶化合物成分信息及对应的潜在靶点, 结合Uniport 数据库(https: / /www.uniprot.org/),将靶点名称转化为对应的基因名, 形成化合物-基因对应关系, 以便后续分析。
1.2 蛋白质作用网络(PPI) 的构建与分析
通过在线STRING 数据库平台(https: / /cn.stringdb.org/, 版本号11.5), 以物种设置为“Homo sapiens”, 最高置信度蛋白交互参数评分值0.9 作为初始条件, 导入243 个靶点, 去掉网络中离散的节点构建PPI网络图。 将PPI 数据导入Cytoscape 3.8.2 软件中, 通过“Network Analyzer” 功能进行靶点拓扑属性分析。
1.3 基因功能富集分析
利用DAVID 数据库(https: / /david.ncifcrf.gov/)及KEGG 数据库(https: / /www.kegg.jp/kegg/) 进行GO 富集和KEGG 通路富集分析243 个基因靶点信息。
1.4 “化合物-靶点-通路” 网络的构建与分析
运用Cytoscape 可视化网络绘图软件, 绘制杜仲叶化合物-靶点-通路网络, 并获取相关网络参数进行分析。
2 结果与分析
2.1 杜仲叶化合物信息数据库的构建
通过TCMSP 数据库检索到78 个化合物成分及289个对应潜在靶点, 去除数据库中无靶点及非人源靶点对应化合物信息, 经uniport 数据库转化为基因名去重后,共得53 个化合物信息对应243 个基因靶点, 杜仲叶关键化合物信息见附表。
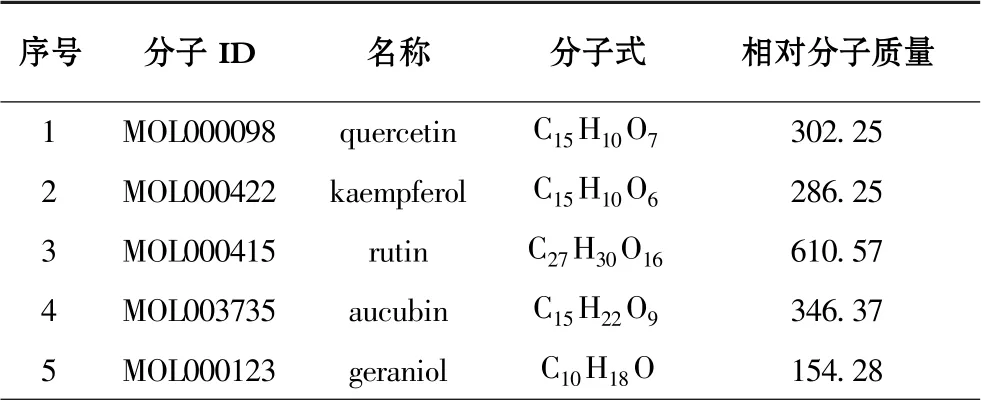
附表 杜仲叶关键化合物信息
2.2 杜仲叶化合物作用靶点相互作用网络分析
通过在线STRING 数据库, 导入243 个靶点构建PPI 网络图, 拓扑属性分析结果显示, 网络中包含186个节点, 731 条边。 以连接度(degree) 值为参考, 排名前10 的靶点分别为SRC (degree =39)、 TP53 (degree =37)、 AKT1 (degree =36)、 MAPK1 (degree =35)、 MAPK3 (degree =35)、 RELA (degree =35)、 TNF(degree =27)、 FOS (degree =25)、 RXRA (degree =24)、 IL6 (degree =24), 其中度值最高的SRC 能与39个蛋白发生相互作用, 预示着这些靶点可能是杜仲叶作为药食两用物质, 发挥营养价值和保健功效的潜在关键蛋白, 蛋白-蛋白相互作用(PPI) 网络见图1。

图1 蛋白-蛋白相互作用(PPI) 网络
2.3 基因功能GO 富集分析
以P<0.05、FDR<0.05 为筛选条件, 物种设置为“Homo sapiens”, 在“Gene Ontology” 项下, 在DAVID数据库中GO 富集分析243 个作用靶点, 结果显示, GO条目包含424 个生物过程(biological process, BP), 主要涉及基因表达的正调控、 药物反应、 细胞增殖的正调控、 对外源刺激的反应、 衰老、 对脂多糖的反应、 对缺氧的反应、 丝裂原活化蛋白激酶级联反应的正调控、 对乙醇的反应、 细胞对镉离子的响应等过程。 94 个细胞组成(cellular component, CC) 主要富集在细胞外间隙、 质膜、 细胞小凹、 突触后膜、 质膜的整体成分、 胞外区、 膜筏、 大分子复合物、 细胞表面等区域。 94 个分子功能(molecular function, MF) 条目, 主要富集在酶结合、 相同的蛋白质结合、 蛋白质同源二聚体化活性、递质门控离子通道活性参与突触后膜电位的调节、 兴奋性细胞外配体门控离子通道活动、 神经递质受体活性、RNA 聚合酶II 转录因子活性, 配体激活序列特异性DNA 结合、 蛋白结合、 胞外配体门控离子通道活性、 蛋白激酶活性等功能。 根据P值, 分别选取BP、 CC、 MF排名前10 的条目(图2)。

图2 GO 功能富集分析柱状图
2.4 KEGG 通路富集分析
以P<0.05、FDR<0.05 为筛选条件, 对上述243个作用靶点进行KEGG 通路富集分析, 共得到186 个条目, 主要涉及肿瘤通路、 脂质与动脉粥样硬化、 人类巨细胞病毒感染、 卡波西肉瘤相关疱疹病毒感染、 流体剪切应力与动脉粥样硬化、 乙型肝炎、 糖尿病并发症中的AGE-RAGE 信号通路、 前列腺癌、 胰腺癌、 膀胱癌信号通路等。 选取排名前20 的通路进行KEGG 通路富集分析气泡图绘制(图3), 圆点越大表示富集的基因数越多; P 值越小, 圆点颜色越蓝; P 值越大, 圆点颜色越黄。 以富集基因数最多的肿瘤通路为例, 结合KEGG Pathway 数据库, 标注66 个涉及靶点在通路上的相关调控过程, 相关靶点调控过程用蓝色标识, 其中排名前10靶点涉及调控过程用红色标识, 杜仲叶营养成分对肿瘤通路的作用靶点标注图见图4。

图3 KEGG 通路富集分析气泡图

图4 杜仲叶营养成分对肿瘤通路的作用靶点标注图
2.5 杜仲叶“化合物-靶点-通路” 网络的构建及分析
KEGG 通路富集分析排名前10 通路及其涉及的96个靶点和靶点对应的34 个成分导入Cytoscape 软件中,构建杜仲叶“化合物-靶点-通路” 网络(图5)。 根据拓扑分析, 网络中化合物连接度值越大意味着其对应的靶点越多, 以连接度(degree) 值为参考, 排名前5 的化合 物 依 次 为 MOL000098 槲 皮 素 (degree =80)、MOL000422 山 奈 酚 (degree =25)、 MOL000415 芦 丁(degree =9)、 MOL003735 桃叶珊瑚苷(degree =8)、MOL000123 牻牛儿醇(degree =6), 在网络中具有较高的连接度表明, 这些成分可能是杜仲叶发挥药效的潜在活性物质; 以≥2 倍中位数的degree 值(degree 中位数值为5) 进行筛选, 排名前10 的靶点分别为PTGS2(degree =32)、 RELA (degree =13)、 F2R (degree =12)、 TNF (degree =11)、 AKT1 (degree =11)、 TP53(degree =10)、 MAPK3 (degree =10)、 MAPK1 (degree=10)、 BCL2 (degree =10)、 BAX (degree =10), 预示着这些靶点在相关通路上发挥着重要的作用。
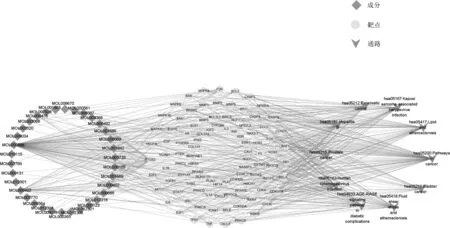
图5 杜仲叶“化合物-靶点-通路” 网络
3 讨论
近年来, 网络药理学已广泛应用于食品科学领域分析, 为营养成分的功能定位提供了科学依据。 现代药理学研究表明, 应剑等[11]利用网络药理学方法通过建立“成分-靶标-疾病” 的关联网络, 阐述了蜂胶成分改善代谢性疾病的“多成分、 多靶点” 特征, 分析了核心作用通路。 黄旭龙等[12]通过网络药理学的方法, 筛选了8个西瓜皮活性营养成分, 并对糖尿病防治潜在作用靶点和通路进行了预测分析, 为西瓜皮药用价值的研究和资源开发提供了参考。 安莉等[13]基于生物信息学探讨了山药的营养药理功能及作用机制, 分析挖掘了其潜在关键靶点及关键代谢途径。 为了更好地明确杜仲叶营养价值的功能定位, 探讨其对人体作用机制的重要意义, 本文通过网络药理学, 探讨了杜仲叶的营养价值功能与作用机制。
通过杜仲叶靶点蛋白PPI 网络图分析, 筛选出degree 值≥35 的潜在关键靶点, 具体包括SRC、 TP53、AKT1、 MAPK1、 MAPK3、 RELA。 SRC 作为一类重要的非受体酪氨酸蛋白激酶, 在胰腺癌、 肺癌、 前列腺癌和乳腺癌等多种肿瘤的发生、 发展中发挥着重要作用, 如参与细胞增殖、 凋亡、 转移、 影响细胞连接和粘附、 血管生成、 细胞周期和信号通路等多个方面[14-15]。 TP53作为一种重要的抑癌基因, 基因状态的改变可诱导肿瘤的发生, 在基因网络调控中发挥重要的作用, 其编码的多功能的转录调节因子可参与调节细胞周期、 修复DNA损伤及促进细胞的程序性凋亡[16-17], 此外TP53 的基因状态也是判断淋巴瘤和血液病预后的重要指标[18], 可通过其突变情况, 指导临床用药和治疗方案的选择。 丝氨酸/苏氨酸蛋白激酶AKT 为磷脂酰肌醇3 激酶(PI3K) 下游的重要靶点, 其参与PI3K/Akt 信号通路在抑郁 症[19]、 糖 尿 病[20]、 心 血 管 疾 病[21]、 脑 神 经 疾病[22]、 高血压[23]防治过程中扮演着重要角色。
杜仲叶“化合物-靶点-通路” 网络分析显示, 黄酮类(槲皮素、 山奈酚、 芦丁)、 环烯醚萜类(桃叶珊瑚苷)、 单萜类(牻牛儿醇) 可能是其发挥营养功能的重要化合物。 研究表明, 槲皮素作为一种具有广阔应用前景的天然膳食化合物, 在疾病预防及治疗方面具有广泛的药理作用, 近年来因其在抗糖尿病、 抗氧化、 抗高血压病、 抗炎、 抗菌、 抗衰老及心血管保护方面的重要药用价值而备受关注[24-25]。 山奈酚具有丰富多样的生物学活性, 其功能涉及癌症、 糖尿病、 骨质疏松、 动脉粥样硬化、 保护神经以及抑制蛋白激酶等多个方面, 还可作为食品加工中的防腐保鲜剂及抗氧剂[26]。 研究表明,芦丁是一种天然抗氧化剂, 具有心血管保护、 神经保护、 抗炎、 抗菌、 抗肿瘤等生物活性, 其多种药理作用的发挥与其抗氧化性和抗炎活性有着密切的关系[27-29],此外芦丁还是一种具有显著护肝生物活性的重要药膳两用功能成分[30]。 桃叶珊瑚苷可通过调节Nrf2、 NF-κB、AMPK、 NO、 JNK 等多条信号通路, 发挥神经和生殖系统保护、 降低血糖水平、 抗骨关节炎、 抗骨质疏松、 抗肿瘤以及抗老化等药理作用[31], 此外桃叶珊瑚苷经人肠道菌群代谢后, 其苷元是起解毒保肝作用的主要活性形式[32], 具有显著的抗菌作用, 且活性优于桃叶珊瑚苷[33]。 牻牛儿醇又名香叶醇, 具有改善糖脂代谢异常及血管内皮功能障碍、 抑制细胞氧化应激反应、 抗炎、调节血胆固醇等药理作用, 在心血管疾病防治方面具有广阔的应用前景[34-35]。 由此可见, 杜仲叶中富集靶点较多的这些化合物在抗炎、 抗肿瘤、 抗氧化、 心血管保护等方面发挥着重要的营养保健功能。
4 结论
本研究通过网络药理学方法探讨了杜仲叶营养价值功能及生物学机制, 通过构建“化合物-靶点-通路” 网络, 分析挖掘了具备营养功能重要化合物的潜在靶点及作用通路, 结果显示出杜仲叶具有抗炎、 抗肿瘤、 抗氧化、 心血管保护等功效, 揭示了其多成分、 多靶点、 多途径协同作用的特点, 为后续杜仲叶产业化开发奠定了理论基础, 对其药食同源类功能产品的开发提供了良好的基础和科学指导。
