溶磷内生菌的筛选鉴定及其对薏苡生长发育的影响
2022-12-02普凤雅谷书杰何永宏陈崧林杨志清
普凤雅,谷书杰,何永宏,陈崧林,杨志清,3,4*
(1.云南农业大学农学与生物技术学院,云南 昆明 650201;2.云南农业大学植物保护学院,云南 昆明650201;3.云南农业大学云南省药用植物生物学重点实验室,云南 昆明 650201;4.云南农业大学西南中药材种质创新与利用国家地方联合工程研究中心,云南 昆明 650201)
0 引言
【研究意义】薏苡(Coix lacryma- jobiL.)属于禾本科(Gramineae),玉蜀黍族(Maydeae)薏苡属 (CoixL.)植物,是中国传统的药食兼用作物[1]。薏苡长期以传统的种植方式栽培,管理较为粗放,化肥农药投入量大,土壤环境遭到破坏,导致磷素利用率严重下降,不符合绿色生产[2]。微生物对土壤磷的转化和有效性影响很大[3],解磷微生物能够将植物难以吸收利用的磷转化为可吸收利用的形态,提高磷元素利用率,从而促进植物生长发育[4-5]。【前人研究进展】20世纪50年代我国逐渐对解磷菌的应用开始进行研究,先后从东北黑土和灰化土中筛选出解磷能力较强的芽孢杆菌、极毛杆菌等[6]。近年来,通过筛选具有解磷功能的菌株来提高作物栽培过程中磷元素的利用率,促进作物生长已成为目前研究的热点。陆蓝翔等[7]从樟树组织中分离筛选到4株菌具有解无机磷能力,2株菌具有解有机磷能力;卢志红等[8]研究表明内生细菌SRW具有较强的增磷能力,能够促进鸭跖草生长发育;蔡红丹等[9]研究表明解磷菌P2的使用能够提高水稻种子的萌发,促进根系生长。【本研究切入点】目前对薏苡内生菌的研究鲜见报道,尤其是薏苡溶磷内生细菌。因此,有必要筛选薏苡溶磷内生菌并探究内生菌对薏苡生长的影响,以便深入了解薏苡生长发育过程中内生菌的作用。【拟解决的关键问题】通过分离文薏2号根、茎、叶内生细菌,筛选薏苡溶磷内生菌,并分别以植酸钙和Ca3(PO4)2作为唯一有机磷源和无机磷源,初步探究其溶解有机磷和无机磷能力,通过盆栽试验探究溶磷内生菌对薏苡的促生长作用,为薏苡溶磷内生菌的开发应用提供理论依据和优良菌株。
1 材料与方法
1.1 试验材料
文薏2号(2015年通过国家小宗粮豆作物品种鉴定委员会鉴定[10])由云南省文山州农业科学院提供。2020年7月,盆栽试验在云南农业大学后山标本园大棚内进行,播种25 d后,进行内生菌分离。
1.2 培养基
LB 培养基:10 g·L-1胰蛋白胨,5 g·L-1酵母提取物,10 g·L-1氯化钠,蒸馏水 1 000 mL,pH值7.0;固体培养基在液体LB培养基的基础上加入20 g·L-1琼脂粉。
无机磷培养基:10 g·L-1葡萄糖,5 g·L-1Ca3(PO4)2,0.1 g·L-1(NH4)2SO4,5 g·L-1MgCl2•6H2O,0.25 g·L-1MgSO4•7H2O,0.2 g·L-1KCl ,蒸馏水 1 000 mL,pH值为7.0~7.5,固体培养基在液体培养基的基础上加入 15.0~18.0 g·L-1琼脂粉。
有机磷培养基:10 g·L-1葡萄糖,0.3 g·L-1NaCl,0.03 g·L-1FeSO4, 0.03 g·L-1MnSO4•H2O, 0.5 g·L-1(NH4)2SO4, 0.3 g·L-1KCl, 0.3 g·L-1MgSO4•7H2O,2 g·L-1植酸钙,蒸馏水 1 000 mL,pH 值为 7.0~7.5,固体培养基在液体培养基的基础上加入15~18 g·L-1琼脂粉。
1.3 薏苡内生细菌分离和纯化
内生菌的分离纯化参考Cardoso等[11]的方法略有修改。播种25 d后,从薏苡植株上剪取健康的根、茎及叶组织各1 g,随后使用自来水冲洗3 min去除表面多余的杂质,滤纸吸干表面水分。然后用75 %乙醇浸泡2 min;再用1 %次氯酸钠消毒根组织5 min,茎、叶组织3 min;最后用无菌水漂洗6次,除去残留消毒剂并用无菌滤纸将其吸干。将消毒好的植物组织样品放入无菌研钵中并向其内加入9 mL无菌水,研磨至呈匀浆状,静置5 min,取上清液稀释10-2倍,涂布在LB平板上,置于35 ℃下培养2 d。挑取长出的菌株进行纯化,直至板上菌落颜色和形态基本一致,纯化的菌株用40 %甘油保存至-20 ℃冰箱备用。同时吸取最后一次漂洗的无菌水100 μL涂布于LB平板,同等条件下培养,检验表面消毒是否彻底。
1.4 溶磷内生细菌的筛选
定性测定:从冰箱中取出保存的内生细菌,室温下让其呈熔融状态。在超净台上用接种环蘸取少许菌液,参照郭艺鹏等[12]的方法分别点接于有机磷和无机磷固体平板上,每个菌株重复3次。30 ℃培养5 d,观察有无溶磷圈生成,测定溶磷圈直径(D)、菌落直径(d)。根据可溶性指数(D/d)大小初步确定菌株的溶磷能力。定量测定:采用钼锑抗比色法[13]测定其磷含量。
1.5 溶磷菌分泌磷酸酶活性测定
磷酸酶活性测定参照赵为容等[14]的方法。分别将菌株R24、L21接种于100 mL有机磷和无机磷培养基中,于 30 °C,160 r·min-1震荡培养,以相应的不接菌的培养基为空白对照,试验重复3次,每隔24 h取1 mL进行磷酸酶活性测定。
1.6 溶磷细菌对薏苡生长发育的影响
菌悬液制备:将菌体于35 ℃下培养28 h,然后8 000 r·min-1离心收集菌体,无菌水重悬,调节菌悬液浓度为107cfu·mL-1用于后续试验。
试验采用随机区组设计,设置4个处理,分别为 T1、T2、T3、T4(CK),每个处理 5次重复,共20盆。T1:浇L21重悬菌液;T2:浇R24重悬菌液;T3:浇R24和L21等比例混合重悬菌液;T4:浇无菌水(CK)。
挑选籽粒外观饱满无病虫危害的健康薏苡种子,表面消毒处理后播种于育苗盘内,10 d后选择长势一致的苗移栽至高17 cm、外口径25 cm的花盆里。采用灌根法,每盆灌入400 mL上述菌悬液,置于温室大棚中培养,对照用无菌水。在薏苡的生长过程中,于灌根菌液后,每隔15 d测量薏苡株高、茎粗、叶面积、分蘖数、叶片数,并用叶绿素测定仪测定叶绿素含量。
1.7 菌株生理生化测定和16S rDNA序列分析
将筛选获得的菌株划线接种在LB固体培养基上,35 °C 培养24 h后,根据《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》对菌株进行形态学和生理生化测定。用生工生物工程(上海)有限公司研制的试剂盒提取细菌DNA,采用通用引物27 F(5′-3′:AGTTTGATCMTGGCTCAG)和1492 R(5′-3′:GG TTACCTTGTTACGACTT)进行PCR扩增。送至生工生物工程(上海)有限公司测序,获得菌株的16S rDNA序列。将所测序列在GenBank中进行blast同源性搜索,然后将菌相似性较高的序列用MAGE-X软件中的邻接法(Neighbor-joining method)构建系统发育树。
1.8 数据分析与处理
采用 Excel 2010 和SPSS 25.0对数据进行记录、整理、统计和分析。
2 结果与分析
2.1 不同菌株降解有机磷能力测定
2.1.1 定性测定 将菌株点接于有机磷固体培养基中,培养5 d后,观察有无透明圈,结果如表1所示,在固体平板上,菌株R24的溶磷圈直径(D)与菌落直径(d)之比最大,为(2.15 ± 0.13),显著大于其余菌株(P<0.05)。
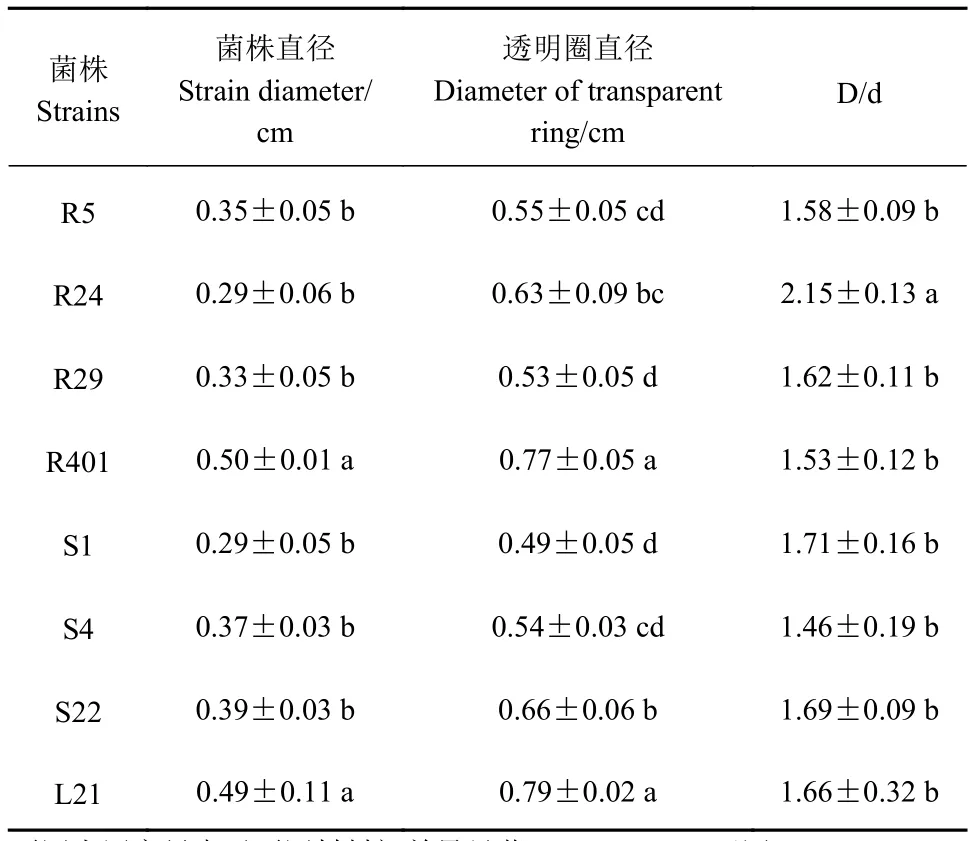
表1 菌株降解有机磷能力的比较Table 1 Organic phosphate degrading ability of strains
2.1.2 定量测定 菌株在液体培养基中培养5 d后,测定上清液可溶性磷的含量,结果(图1)发现不同菌株间存在显著差异(P<0.05)。其中,R24菌株可溶性磷含量最大,为37.20 mg·L-1,显著大于除R29以外的其他供试菌株(P<0.05),分离自根部的R29菌株可溶性磷含量次之,为30.03 mg·L-1。
2.2 不同菌株降解无机磷能力的测定
2.2.1 定性测定 将菌株点接至无机磷固体培养基中,培养5 d后观察有无透明圈。各供试菌株的溶无机磷能力存在一定差异,分离自叶片的L21菌株的溶磷圈最大,溶磷圈直径(D)与菌落直径(d)之比为(2.01 ± 0.25),显著大于其余菌株(P<0.05)(表2)。
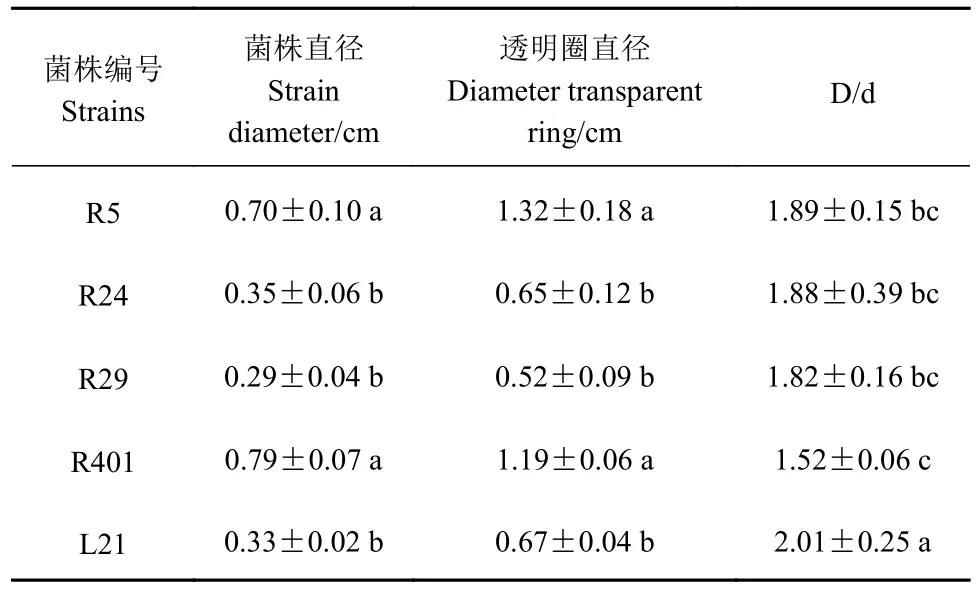
表2 菌株降解无机磷的能力比较Table 2 Inorganic phosphate degrading ability of strains
2.2.2 定量测定 菌株在液体培养基中培养5 d后,测定上清液可溶性磷含量。测定结果如图2所示。L21菌株可溶性磷含量最大,为62.93 mg·L-1,显著大于其余供试菌株(P<0.05),分离自根部的R5菌株可溶性磷含量最小,为1.99 mg·L-1。
2.3 在有机磷培养基中溶磷菌株分泌磷酸酶的动态变化
在有机磷培养基中,2株解磷细菌培养6 d后,发酵液酸性磷酸酶和碱性磷酸酶的活性分别如图3-a、b所示,随着培养时间的增加,菌株分泌磷酸酶活性呈现先上升后降低的趋势。培养4 d后,菌株R24的酸性磷酸酶活性达到最大值;培养5 d后,菌株L21的酸性磷酸酶活性达到最大值。两菌株相比,R24分泌酸性磷酸酶活性的峰值比L21高出10.37%。R24和L21分泌碱性磷酸酶的能力均在培养第5天时达到最大值,其中R24比L21高出72.58%。测定发酵液每天的pH值发现,两菌株培养后,其发酵液的pH值均低于空白处理,R24的pH低于L21(图3-c)。说明在有机磷培养基中,菌株R24分泌酸性磷酸酶和碱性磷酸酶活性均高于L21,有利于其分解难溶性有机磷,此结果与2.1中该菌株溶解有机磷能力最高一致。
2.4 在无机磷培养基中溶磷菌株分泌磷酸酶的动态变化
在无机磷培养基中,2株解磷菌培养6 d后,发酵液酸性磷酸酶和碱性磷酸酶的活性如图4-a、b所示,随着培养时间的增加,菌株分泌磷酸酶活性呈现的趋势为先上升后下降。R24分泌酸性磷酸酶活性在培养第4天时达到最大值,而L21在培养5 d时达到最大值,L21的酸性磷酸酶活性最大值比R24高出27.30%;R24分泌碱性磷酸酶活性在培养第5天达到最大值,而L21在培养4 d达到最大值,L21碱性磷酸酶活性最大值比R24高出116.84%。测定发酵液每天的pH可知,两菌株培养后,发酵液的pH均低于空白处理,L21发酵液的pH低于R24(图4-c)。说明在无机磷培养基中,L21分泌的酸性磷酸酶和碱性磷酸酶活性高于R24,有利于该菌株分解难溶性无机磷,此结果与2.2中的该菌株溶解无机磷能力相同。
2.5 不同溶磷菌株处理对薏苡农艺性状的影响
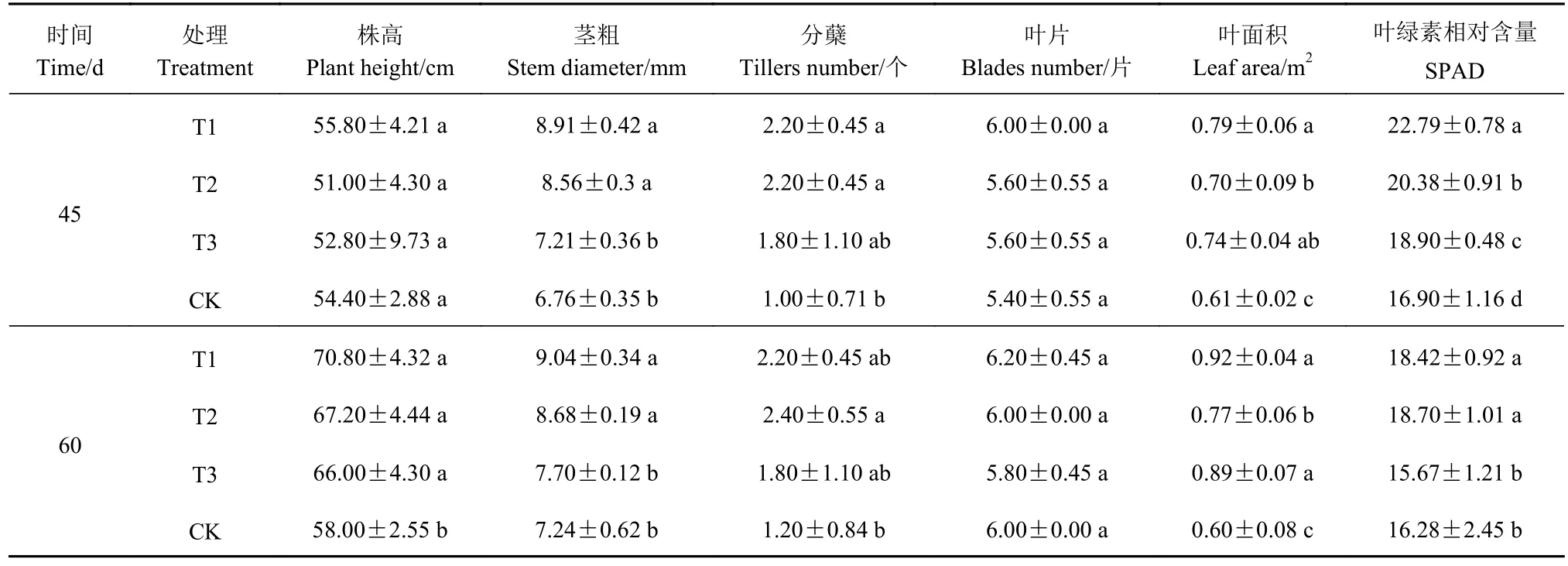
由表3可知,在培养60 d后,T1、T2和T3处理下的薏苡株高、茎粗、分蘖数和叶面积均大于对照CK。其中,株高和分蘖数与CK达到显著水平(P<0.05)。T1、T2和T3处理对薏苡的叶片生长影响较小,与CK相比未达到显著水平(P>0.05)。在培养30 d后,薏苡叶片叶绿素相对含量达到最大值,T1、T2和T3处理分别比CK增加19.74%、12.85%、7.98%。总之在培养60 d后,T1、T2和T3处理对薏苡的生长发育均有一定的促进作用(图5)。

表3 不同处理下盆栽薏苡农艺性状Table 3 Agronomic traits of potted plants after treatments
2.6 溶磷菌株生理生化与16S rDNA鉴定
2.6.1 细菌的生理生化鉴定 如图6所示,R24菌落圆形,凸起明显,白色,表面粗糙湿润;L21菌落圆形,凸起不明显,白色,表面粗糙干燥,R24和L21革兰氏染色均为阳性。菌株R24、L21的生理生化测定结果见表4,在所测定的生理生化指标中,菌株R24的甲基红试验、淀粉水解、硝酸盐试验为阴性,其余为阳性;菌株L21的柠檬酸试验为阴性,其余为阳性。
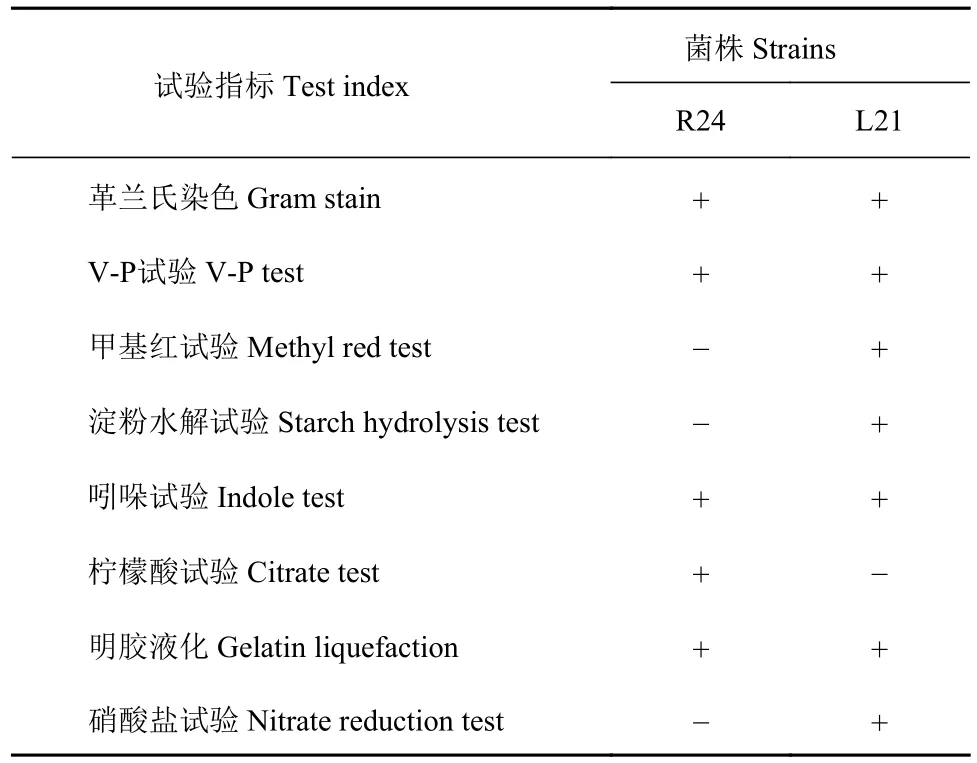
表4 菌株的生理生化特性Table 4 Physiological and biochemical characteristics of strains
2.6.2 细菌分子鉴定 对菌株进行16S rDNA基因片段扩增,将PCR产物测序结果提交GenBank与序列相似性较高的菌株进行比对,构建系统发育树(图7)。结果显示:2株细菌均为芽孢杆菌属(Bacillus.)。其中,菌株R24与Bacillus pumilus(登录号:NBRC 12092)处于系统发育树的同一分支,同源性99%,鉴定为短小芽孢杆菌;菌株L21与Bacillus velezensis(登录号:MK092676.1)处于系统发育树的同一分支,同源性100%,鉴定为贝莱斯芽孢杆菌。
续上表
3 讨论与结论
解磷菌是一类能够将土壤中的难溶性磷转化为可以被植物吸收利用的可溶性磷的有益微生物,在玉米[15]、小麦[16]等作物上已进行广泛研究。目前国内很少有对薏苡进行内生菌的分离鉴定及功能的探究。本研究通过平板接菌试验筛选得到溶解有机磷细菌8株,分别为分离自薏苡根系的R5、R24、R29、R401,分离自薏苡茎秆的S1、S4、S22,分离自薏苡叶片的L21,而R5、R24、R29、R401和L21同时具有溶解无机磷的能力。这与马骢毓等[17]从黄芪根际中分离得到溶解无机磷菌株42株和溶解有机磷菌株33株在数量上有所差距,究其原因可能是不同的植物、分离的材料数所导致。
本研究中,分离自薏苡根系的R24对有机磷的溶解能力最强,为37.20 mg·L-1,分离自薏苡叶片的L21对无机磷的溶解能力最强,为62.93 mg·L-1;狄义宁等[18]在甘蔗中分离得到的溶磷菌D5的溶磷量。此外,R24在有机磷培养基中分泌磷酸酶的能力最强,酸性磷酸酶活性和碱性磷酸酶活性分别达9.64 μg·(mL·h)-1和 9.63 μg·(mL·h)-1;L21 在无机磷培养基中分泌磷酸酶的能力最强,酸性磷酸酶活性和碱性磷酸酶活性分别达到 11.47 μg·(mL·h)-1、10.69 μg·(mL·h)-1。溶磷内生细菌的溶无机磷和有机磷的能力各不相同,这可能是因为菌株分泌的磷酸酶、植酸酶等能力不同[19],同时菌株溶磷能力的高低也与菌株自身的遗传因素有关[20-21],有待进一步深入研究。
溶磷菌对植物的生长发育具有显著的促进作用,在本研究中,浇灌L21菌液后,与对照相比,薏苡的株高较CK增加22.07%,茎粗增加24.86%,叶面积增加53.33%,分蘖数增加83.33%。经L21和R24处理后,薏苡根系活力与CK达到显著水平(P<0.05),分别较CK增加89.52%、63.76%。L21和R24的等比例混合菌液与CK相比,在株高、叶面积方面促进效果显著,但是低于L21和R24单独处理的效果,可能的原因是两株菌在营养物质和生态位等方面有所竞争,这与Li等[22]研究的溶磷菌增加了玉米芽长、生物量的结果一致。总的来说L21、R24和混合菌剂处理对薏苡的生长发育均有一定的促进作用,促生长能力从大到小为:L21>R24>(L21+R24),可作为开发薏苡微生物肥料的优质菌种资源。
