基于网络药理学和动物实验探讨桂药生精胶囊治疗不育症的作用机制
2022-12-02梁景辉胡恩宜买鹏宇张泽朝叶沛仁
梁景辉, 胡恩宜, 朱 闽, 买鹏宇, 张泽朝, 叶 斌, 时 雪, 彭 杰,叶沛仁
(1.钦州市中医医院,广西 钦州 535000;2.广西中医药大学,广西 南宁 530200;3.广西中医药大学附属瑞康医院,广西 南宁 530011)
不育症是指育龄夫妇同居1年以上,性生活规律,没有采取任何避孕措施,由于男方原因导致女方未能受孕[1]。世界卫生组织统计育龄夫妇中不孕不育占比为15%,其中约有50%是因男性因素造成的[2]。相关研究表明少精子症及弱精子症是导致不育症的常见致病因素,两者可单独或者合并出现[3]。现代医学对不育症的发病机制尚未完全明确,临床治疗没有特异性的药物,主要以绒毛膜促性腺激素、抗氧化制剂、抗生素等治疗为主,虽然取得一定的临床疗效,但长期使用会伴随诸多不良反应发生[4]。
男性不育属于中医学“无子”“艰嗣”等范畴,中医认为该病以本虚标实为病证特点,既有脏腑虚损之本,又有湿热瘀滞为标,治疗上以补肾益精为基础[5]。桂药生精胶囊是广西中医药大学附属瑞康医院院内制剂,由淫羊藿、菟丝子、覆盆子、金樱子、车前子、天冬、麦冬、女贞子、枸杞子、桑椹子、黄芪、党参、红参、红花、甘草15味中药组成,具有温肾益气、滋肾生精的功效。临床研究表明,桂药生精胶囊治疗不育症的总有效率为87.50%,能有效提高精子活力、活率及顶体酶活性等[6-7],但对其具体的作用机理尚需要进一步的探讨。
网络药理学是通过研究药物活性成分及其相关靶点,并在系统生物学理论的基础上,探讨药物-作用靶点、疾病-治疗靶点之间联系的方法[8]。本文通过网络药理学方法首次对桂药生精胶囊治疗不育症的分子机制进行全面的解析,并根据结论采用动物实验加以验证,旨为后续不育症的临床治疗及实验研究提供参考。
1 材料与方法
1.1 网络药理学
1.1.1 有效成分及靶点筛选 采用中药系统药理学数据库与分析平台TCMSP(https://tcmspw.com/tcmsp.php),以口服利用度(OB)≥30%、类药性(DL)≥0.18为筛选标准,检索桂药生精胶囊组方药材(淫羊藿、菟丝子、覆盆子、金樱子、车前子、天冬、麦冬、女贞子、枸杞子、桑椹子、黄芪、党参、红参、红花、甘草)有效成分,并在TCMSP数据库中获取有效成分的对应靶点,通过Uniprot数据库(https://www.uniprot.org/)对靶点信息进行人源基因转换。
1.1.2 疾病靶点筛选 以“male infertility”为关键词,检索Genecards数据库(https://www.genecards.org/)、人类孟德尔遗传数据库OMIM(https://omim.org/search/advanced/geneMap)中不育症靶点,删除重复靶点基因,将所有靶点基因导入Uniprot数据库(https://www.uniprot.org/)进行人源基因转换。
1.1.3 药物疾病共同靶点基因的筛选及韦恩图构建 将药物、疾病靶点基因导入Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/),筛选出药物、疾病共同含有的靶点取交集,绘制韦恩图。
1.1.4 蛋白互作网络构建和核心靶点筛选 将药物-疾病的共同靶点基因数据导入String(https://string-db.org)在线数据库,设定物种为“Homosapiens”,筛选置信度>0.90,获取所有蛋白-蛋白相互作用(PPI)关系构建网络可视化,并导入Cytoscape 3.8.0进行数据分析,通过拓扑结构分析得出核心的药物靶点,筛选度值(Degree)、介数中心性(Betweenness centrality)、节点紧密度(Closeness)同时大于中位数。
1.1.5 基因功能和生物通路富集分析 采用R语言软件包,应用Bioconductor(www.bioconductor.org/)对潜在作用靶点进行基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析,设定阈值P<0.05。GO分析包括生物过程(biological process,BP)、细胞组成(cellular component,CC)、分子功能(molecular function,MF),KEGG分析侧重于桂药生精胶囊干预不育症的信号通路。
1.2 动物实验
1.2.1 动物 SPF级8周龄雄性SD大鼠42只,体质量(180±20)g,购于湖南斯莱克景达实验动物有限公司,实验动物使用许可证号SYXK(桂)2019-0004。大鼠饲养于广西中医药大学壮医药学院重点实验动物房,温度(25±2)℃,相对湿度50%~60%,分笼架式喂养,清洁饮水,自由摄食,1周更换2次垫料。
1.2.2 试剂、药物与仪器 桂药生精胶囊(批号Z01060147,广西中医药大学附属瑞康医院)。注射用环磷酰胺(批号H32020857)购自江苏恒瑞医药股份有限公司;缬沙坦胶囊(批号H20040217)购自北京诺华制药有限公司。兔抗人Bcl-2(批号26593-1-AP)、Bax(批号50599-2-Ig)、caspase-9(批号10380-1-AP)、caspase-3多克隆抗体(批号19677-1-AP)购自武汉三鹰生物技术有限公司;酶标山羊抗小鼠/兔IgG聚合物(批号PV-6000)购自北京中杉金桥生物技术有限公司。自动组织脱水机(型号ASP300S)、一体式石蜡包埋机(型号EG1160)、转轮切片机(型号RM2235)购自德国Leica公司;光学显微镜(型号BX53F)购自日本Olympus公司。
1.2.3 分组与模型制备 大鼠适应性喂养7 d后,随机抽取7只作为空白组,其余35只作为造模组,空白组腹腔注射生理盐水,造模组腹腔注射环磷酰胺(40 mg/kg),连续5 d[9-10]。造模成功后,将造模大鼠随机分为模型组、阳性组及桂药生精胶囊低、中、高剂量组,每组7只。
1.2.4 干预治疗 大鼠造模结束后第1天开始干预给药,阳性组给予缬沙坦胶囊灌胃,剂量为1.44 mg/mL(相当于人临床用药剂量);桂药生精胶囊各剂量组给予桂药生精胶囊灌胃,低、中、高剂量分别为28.5、57、114 mg/mL(分别相当于人临床每天推荐用量的0.5、1、2倍),每天1次,每次1 mL,连续4周,每周对大鼠体质量进行复测,以此调整药物剂量;空白组、模型组灌胃给予等量生理盐水。
1.2.5 精子参数检测 末次给药24 h后处死大鼠,采用扩散法对附睾内精子进行检测[11],无菌条件下摘取左侧附睾,置于5 mL(37 ℃预热)PBS缓冲液中,剪碎后在37 ℃恒温水浴箱中孵育2 min让精子充分游离出来,滴加到血球计数板上,在光学显微镜下进行观察。参照世界卫生组织人类精液检查与处理实验室手册(第五版)[12],从精子密度、运动精子百分率(PR+NP)、前向运动精子百分率(PR)3个方面进行数据记录。
1.2.6 睾丸组织病理检测 大鼠睾丸组织于中性甲醛固定24 h后脱水,石蜡包埋、切片,脱蜡水洗,苏木精-伊红(HE)染色,分化,脱水透明,封片,在光镜下观察,每组随机选取10个视野拍照(×200)。
1.2.7 免疫组织化学(IHC)染色法检测核心靶点表达 大鼠睾丸组织切片脱蜡至水,阻断修复,一抗孵育稀释Bcl-2(1∶400)、Bax(1∶1 200)、caspase-9(1∶200)、caspase-3(1∶300)抗体,二抗孵育,DAB显色,苏木精复染,封片,光镜下观察,每组随机选取10个视野拍照(×400)。镜下可观察到阳性表达呈深褐色沉积,对阳性细胞进行计数,阳性表达率=(阳性细胞数/总细胞数)×100%。

2 结果
2.1 桂药生精胶囊有效成分及靶点筛选 共得到264种有效成分,其中淫羊藿23种,菟丝子10种,覆盆子6种,金樱子6种,车前子7种,天冬7种,麦冬20种,女贞子8种,枸杞子36种,桑椹子4种,黄芪17种,党参17种,红参3种,红花17种,甘草83种,见表1。再搜集上述有效成分对应的靶点,使用Uniprot数据库对靶点进行人源基因转换,去重合并后得到509个靶点。
2.2 药物-疾病共同靶点 经去重合并后,得到疾病靶点4 171个,利用Venny 2.1对药物靶点与疾病靶点进行映射,得到交集靶点261个,见图1。

表1 桂药生精胶囊有效成分(OB值前20位)
2.3 PPI网络与核心靶点 利用String数据库对261个药物-疾病交集靶点进行PPI网络构建,见图2,采用拓扑结构分析得到核心靶点97个,包括AKT1、Bcl-2、IL-6、VEGFA、MAPK3、TNF、caspase-3、EGFR、ESR1、PTGS2、STAT3、Bax、Fos、MAPK1、CXCL8、MMP-9、IL-17A、IGF1、NOS3、caspase-9、IL-1B、STAT1、CRP、LEP、CYCS、CCL2、CD44、caspase-8、HIF-1ɑ、Fas等。
2.4 GO功能富集分析 将261个药物-疾病交集靶点经R语言处理后进行GO功能富集分析,选取生物过程(BP)、细胞组成(CC)、分子功能(MF)显著性排名前10位者构成GO富集条形图,见图3。由此可知,BP富集涉及细胞对化学应激的反应(cellular response to chemical stress)、氧化应激反应(response to oxidative stress)、对营养水平的反应(response to nutrient levels)等;CC富集涉及膜筏(membrane raft)、膜微结构域(membrane microdomaini)、膜区(membrane region)等;MF富集涉及四吡咯结合(tetrapyrrole binding)、黄素腺嘌呤二核苷酸结合(flavin adenine dinucleotide binding)、血红素结合(heme binding)等。
2.5 KEGG通路富集分析 将药物-疾病交集靶点进行KEGG通路富集分析,共得到186条信号通路,选取显著性前30位者构成KEGG富集图,见图4,相关通路包括糖尿病并发症AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、细胞凋亡(apoptosis)、IL-17信号通路(IL-17 signaling pathway)、乙型肝炎(hepatitis B)、细胞衰老(cellular senescence)、FoxO信号通路(FoxO signaling pathway)、卡波西氏肉瘤相关疱疹病毒感染(Kaposi sarcoma-associated herpesvirus infection)、内分泌抵抗(endocrine resistance)、癌症中的蛋白多糖(proteoglycans in cancer)、肿瘤坏死因子信号通路(proteoglycans in cancer)等。
2.6 细胞凋亡通路 图4显示,细胞凋亡是桂药生精胶囊治疗不育症显著性最高的通路之一,从中获取相关富集靶点作用机制图,见图5,发现可击中24个靶点,包括Bcl-2、BIRC5、PARP1、caspase-3、RAF1、MAPK1、MCL1、Bax、FOS、caspase-9、caspase-8、TNF、FAS、CYCS、CHUK等。另外,桂药生精胶囊对不育症的治疗作用可能是通过细胞凋亡途径实现的,而Bcl-2、Bax、caspase-9、caspase-3也是拓扑结构分析得到的核心靶点,故采用动物实验对该凋亡靶点进行验证。
2.7 桂药生精胶囊对大鼠睾丸组织Bcl-2、Bax、caspase-9、caspase-3表达的影响 图6、表2显示,与空白组比较,模型组Bcl-2阳性表达率降低(P<0.05),Bax、caspase-9、caspase-3阳性表达率升高(P<0.05);与模型组比较,阳性组和桂药生精胶囊各剂量组Bcl-2阳性表达率升高(P<0.05),Bax、caspase-9、caspase-3阳性表达率降低(P<0.05),且呈剂量依赖性;与阳性组比较,桂药生精胶囊中、高剂量组Bcl-2阳性表达率升高(P<0.05),Bax、caspase-9、caspase-3阳性表达率降低(P<0.05)。桂药生精胶囊高剂量组Bcl-2阳性表达率与空白组比较,差异无统计学意义(P>0.05)。
2.8 桂药生精胶囊对大鼠睾丸组织形态的影响 图7显示,桂药生精胶囊各剂量组大鼠睾丸组织结构较模型组与阳性组有明显改善,生精小管形态趋向规则,基底膜增厚,纤维肌细胞与支持细胞数量分布均匀,精原细胞与精母细胞排列趋于整齐、层数增多,细胞外膜破损可见修复,精子细胞与精子数量增多,微血管供血改善,炎性细胞浸润减少;桂药生精胶囊高剂量组大鼠睾丸组织形态结构未见明显病理改变,改善程度最明显,与空白组比较无明显变化。
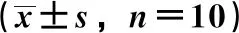
表2 各组大鼠睾丸组织Bcl-2、Bax、caspase-9、caspase-3阳性表达率比较
2.9 桂药生精胶囊对大鼠精子参数的影响 表3显示,与空白组比较,模型组精子密度、精子活力降低(P<0.05);与模型组比较,阳性组和桂药生精胶囊各剂量组精子密度、精子活力升高(P<0.05),且呈剂量依赖性;桂药生精胶囊各剂量组精子密度及中、高剂量组精子活力高于阳性组(P<0.05);桂药生精胶囊高剂量组精子密度与精子活力及桂药生精胶囊中剂量组PR与空白组比较,差异无统计学意义(P>0.05)。

表3 各组大鼠精子参数水平比较
3 讨论
本研究从桂药生精胶囊中获得异黄烷酮、酸浆苦素A、甘草醇等264种有效成分,大多为黄酮类、多糖类、生物碱类等化合物。有研究表明,黄酮类化合物能调控精子细胞内的Ca2+浓度,提高性激素水平,改善机体氧化应激反应,促进精子细胞获能,提高精子活力[13]。多糖类化合物能增强体内激素合成蛋白的水平,调节线粒体功能,改善睾丸微环境与炎症细胞因子水平,提高精子的质量[14-15]。拓扑结构分析得到核心靶点97个,其中部分核心靶点已有研究证实对不育症有调控作用。杨晶等[16]发现调治天癸方能上调不育症大鼠生精细胞Bcl-2表达,下调Bax表达,减少细胞凋亡。樊卫民等[17]发现不育症患者精浆中TNF-ɑ与IL-6水平升高,可引起精子形态和功能的改变。Zhang等[18]发现麒麟丸可通过抑制caspase-9、caspase-3蛋白的表达,减少不育症大鼠睾丸组织凋亡,从而改善大鼠精子质量和睾丸损伤。Wu等[19]研究发现白桦酸可通过降低STAT3、JAK2、Bax表达,上调Bcl-2表达,修复T-毒素所致的睾丸氧化损伤。Xiao等[20]采用束缚应激诱导不育症小鼠模型,结果发现小鼠生精细胞Fas、FasL表达升高。
GO功能富集涉及的生物学过程均体现在药物有效成分的发挥及靶点所涉及的通路中,而KEGG富集得到信号通路186条,主要涉及糖尿病并发症AGE-RAGE信号通路、细胞凋亡、IL-17信号通路等。AGE-RAGE信号通路可引起大量促炎细胞因子、黏附分子、生长因子的表达和释放,降低细胞增殖活性与血管通透性,最终引起慢性细胞活化和微血管病变,这可能是造成睾丸组织损伤的重要原因之一[21]。细胞凋亡是由多因子或蛋白参与的复杂的生理性死亡过程,其过度凋亡可导致线粒体外膜通透性改变,最终影响精子的发育与成熟[22]。IL-17信号通路可诱导多种促炎细胞因子的产生,募集、活化中性粒细胞,从而造成精子DNA损伤及断裂,影响男性的生育能力[23]。
研究表明,细胞凋亡程序在不育症发生和进展中起重要作用,其中Bcl-2家族与caspase家族是细胞凋亡最重要的基因家族[24-25]。Bcl-2家族中Bcl-2蛋白具有抑制多种凋亡蛋白激活、阻断氧化破坏、抑制细胞色素表达等作用,Bax蛋白具有激活凋亡蛋白、促进线粒体裂解等作用[26]。caspase-3蛋白是caspase级联反应的最终执行因子,caspase-9蛋白可激活caspase-3引起细胞核酸断裂,最终导致细胞凋亡[27]。在病理状态下,Bcl-2和Bax的失衡会激活caspase-9及caspase-3蛋白,最终导致过度凋亡,睾丸组织毒性增强,导致精子数量减少、精子活动力下降[28]。Salama等[29]发现缬沙坦能介导不育症大鼠睾丸组织的氧化应激反应,降低对线粒体膜电位的破坏,有效改善大鼠的精子质量、性激素水平,提高Bcl-2表达,降低Bax、caspase-3表达,通过抑制凋亡信号通路减少睾丸组织凋亡,逆转环磷酰胺造成的睾丸毒性。缬沙坦属于血管紧张素Ⅱ受体拮抗剂,对男性生育能力有正面影响[30],因此本实验中采用缬沙坦胶囊作为阳性对照,结果证实桂药生精胶囊可参与细胞凋亡通路,上调不育症大鼠睾丸组织Bcl-2表达,下调Bax、caspase-9、caspase-3表达,改善睾丸病理损伤,提高大鼠精子密度与活力,结果优于阳性组,并且具有明显的量效关系,这可能是桂药生精胶囊治疗不育症的作用机制之一。
综上所述,桂药生精胶囊是通过多成分、多靶点、多通路共同调控来达到治疗不育症的目的。但本实验仅从细胞凋亡通路中核心靶点Bcl-2、Bax、caspase-9、caspase-3表达来验证桂药生精胶囊治疗不育症的作用机制,未对细胞凋亡的其他相关靶点及其他信号通路进行研究探讨,因此完整的调控机制仍需今后进一步的研究来验证说明。
