天麻中巴利森苷类成分药理作用、体内过程研究进展
2022-12-02宋娜丽马克坚
张 菊, 宋娜丽, 马克坚
(云南省中医中药研究院,云南 昆明 650000)
天麻始载于《神农本草经》,为兰科植物天麻GastrodiaelataBl.的干燥块茎,味甘,性平,归肝经[1]。现代药理研究表明,天麻具有镇痛[2]、镇静[3]、抗惊厥[4]、抗抑郁[5]、抗癫痫[6]、改善学习记忆[7]、神经保护[8]、抗炎[9]、抗氧化[10]、减肥[11]、平喘[12]等作用。天麻的主要成分为酚类、有机酸类、甾醇类、多糖类等[13-15],其中,天麻素和巴利森苷等酚类物质是天麻的主要活性成分。自1976年Dahmen等[16]首次发现巴利森苷A以来,国内外学者先后从天麻中分离得到36个巴利森苷类化合物,包括巴利森苷A~Z[17-22]、monosubstituted parishin-H2O、disubstituted parishin、disubstituted parishin glucoside、disubstituted parishin glucoside isomer、methyl disubstituted parishin[23]、mono-substituted parishin glucoside、methoxy mono-substituted parishin、methyl parishin、p-hydroxybenzyl di-substituted parishin、p-hydroxybenzyl parishin[24]。2020年版《中国药典》将天麻素和天麻苷元作为评价天麻质量的指标,同时,首次以天麻素、对羟基苯甲醇、巴利森苷A、巴利森苷B、巴利森苷C、巴利森苷E为特征峰建立特征图谱[1],为更加全面地反映天麻质量提供依据。近年来,有关巴利森苷的研究逐渐深入,本文对天麻中巴利森苷类化合物的药理及药动学相关研究进行综述,以期为巴利森苷的应用和研究提供参考。
1 药理作用
1.1 脑保护 2014年,冯育林等[25]从天麻中提取分离得到巴利森苷J,药效实验发现,该化合物能够有效对抗东莨菪碱、乙醇对小鼠记忆功能的损害,具有改善脑血管缺血引起的记忆力减退的作用,可用于防治血管性痴呆[26]。刘智慧等[27]发现,巴利森苷A和巴利森苷C可以改善东莨菪碱诱导模型小鼠的空间学习记忆能力障碍,还可以改善东莨菪碱诱导模型大鼠海马脑区长时程增强效应的抑制作用,并呈剂量依赖性。与天麻素相比,巴利森苷C结构独特,能更好地与目标靶蛋白结合,其在代谢方面也具有优势,在体内可通过水解代谢为天麻素,再代谢为天麻苷元,延缓了吸收半衰期、消除半衰期、达峰时间[28]。实验发现,巴利森苷C改善东莨菪碱诱导的学习记忆障碍效果比巴利森苷A强10倍,比天麻素强20~30倍。Liu等[29]发现,巴利森苷C可减弱模型大鼠Aβ1-42抑制的NMDAR电流,保护NMDA受体免受Aβ的损伤,进而保护NMDA受体不受长时程增强效应的抑制。近年来,王珂等[30-33]从天麻中提取、精制巴利森苷衍生物,得到巴利森苷A、巴利森苷B、巴利森苷C,结果显示,巴利森苷类成分总含量在25%(特别是50%以上)时,有防治老年痴呆作用;总含量35%(特别是50%以上)时,有防治血管性痴呆作用;总含量为50%以上(优选75%以上,更优选95%以上)时,有脑保护作用;总含量在35%~99.8%时,有防治帕金森氏病作用。5-HT1A受体是精神分裂症的重要治疗靶点,Shin等[34]发现,巴利森苷C是5-HT1A全激动剂,对5-HT1A受体表现出高亲和力以及5-HT1A激动剂活性,可以阻断PCP诱导的行为效应,从而改善PCP诱导精神分裂样小鼠的异常行为,增强社会互动。见表1。
1.2 镇痛 镇痛药物作用于中枢或外周神经系统,可分为麻醉类、解热镇痛类、抗惊厥类、离子通道调节类[35]。徐帮会等[36]灌胃给予小鼠0.9 mg/g天麻提取物,每天1次,连续7 d,观察天麻在小鼠热板法和醋酸扭体法中的镇痛效果,结果显示,天麻的镇痛作用是由多组分共同发挥作用。在热板法中,镇痛作用贡献依次为巴利森苷C>巴利森苷B>巴利森苷A>天麻素>对羟基苯甲醇;在醋酸扭体法中,镇痛作用贡献的大小顺序为巴利森苷B>巴利森苷A>天麻素>巴利森苷C>对羟基苯甲醇。在2个药效实验中,天麻同一成分出现了贡献率不同的情况,这可能是由于2组实验的疼痛机制不同所致,扭体法是评价外周镇痛的经典模型,热板法则用于评价高位中枢参与的中枢性镇痛。研究发现,天麻素对慢性痛条件下外周伤害性感受器超兴奋状态及初级传入突触传递效能具有抑制作用,且呈剂量依赖性,巴利森苷类成分在体内通过水解为天麻素发挥镇痛作用,在不同生理状态下,各成分转化成天麻素的速度与程度不同,导致镇痛效果发生变化[37-38]。

表1 巴利森苷类成分的脑保护作用
1.3 抗肿瘤 2001年,Berek等[39]在巴利森苷相关化合物对淋巴瘤细胞多药耐药外流泵的研究中发现,大多数化合物不能逆转小鼠淋巴瘤细胞的多药耐药,而巴利森苷C能适度降低外排泵活性,巴利森苷A、巴利森苷C和粗提物对抗体依赖性细胞毒性反应有增强作用,提示巴利森苷类化合物对治疗肿瘤有一定疗效。2018年,孟姣等[40]针对现有免疫检查点抑制剂对于非小细胞肺癌患者敏感度较低的缺点,从药用植物中筛选可产生协同作用的药物组合物,结果发现,当免疫检查点抑制剂与巴利森苷类化合物的质量比为1∶(0.1~1)时,巴利森苷类化合物可通过提高派姆单抗对非敏感肿瘤细胞的敏感度来实现协同作用,合用后,对非小细胞肺癌的治疗效果提高。
1.4 保护心肌细胞 天麻素是天麻的主要成分,研究表明,天麻素通过抑制c-Jun氨基末端激酶(JNK)来减弱心肌细胞H9c2的炎症反应[41],具有保护心肌细胞的作用。因为巴利森苷类化合物在来源上与天麻素有着密切的关系,所以Wang等[42]研究巴利森苷A、B、J、K、X对H9c2细胞缺氧/复氧损伤的潜在保护作用,结果显示,与天麻素相比,巴利森苷J和巴利森苷B对H9c2细胞缺氧-复氧损伤的保护作用更为显著,其通过降低细胞质和Bax蛋白中裂解的半胱氨酸蛋白酶-3、细胞色素c水平,实现心肌保护作用。进一步机制研究发现,巴利森苷J能过通过抑制OGD/R诱导的JNK-1磷酸化水平、降低缺氧复氧后OGD/R诱导的c-Jun和ATF2的磷酸化水平、降低14-3-3蛋白的磷酸化水平、增加14-3-3蛋白与Bax蛋白结合等途径,对心肌细胞发挥保护作用。因此,巴利森苷J在开发心肌保护新药方面具有良好的应用前景。
1.5 其他 除上述药理作用外,巴利森苷还显示出促血管生成、平喘、抗衰老、抑制寨卡病毒等作用。Liu等[43]基于斑马鱼模型和代谢组学方法发现,天麻促血管生成作用的最佳质量浓度为100 μg/mL,其中10种化学成分与促血管生成活性有较高的相关性,包括巴利森苷A、巴利森苷C、巴利森苷E等,它们通过调节NOS2、SRC、VEGFA、PTGS1、PTGS2因子水平而作用于VEGF和NF-κB信号通路,从而发挥促血管生成作用。Jang等[12]对天麻中分离得到的9个酚类化合物进行平喘活性筛选,发现50 mg/kg巴利森苷B对气道阻力的抑制作用最显著,具有抗哮喘作用。3、10、30 μmol/L巴利森苷A能通过调控Sir2/Uth1/TOR信号通路,延长K6001酵母的复制寿命,发挥抗衰老作用[44]。包膜蛋白是抑制病毒进入的主要靶点,巴利森苷A对包膜蛋白有很高的亲和力,通过结合寨卡病毒包膜蛋白来抑制病毒进入,并可能产生潜在的抗寨卡病毒药物分子[45]。
2 体内过程
2.1 吸收 巴利森苷类化合物以主动吸收为主。大鼠在体循环灌流实验中,巴利森苷类化合物的累积吸收转化率(A)和吸收速率常数(Ka)在高浓度条件下存在饱和现象,提示巴利森苷类化合物体内过程可能为主动转运[46-47]。巴利森苷A、巴利森苷B、巴利森苷C在不同肠段(十二指肠、空肠、回肠、结肠)均有吸收,由于极性相对较大,在各组织中的分布范围相对较窄,主要为经小肠代谢,同时胆汁可以促进巴利森苷类成分的吸收。不同粒径天麻粉末可影响巴利森苷类化合物的肠吸收特性,这可能是由于粒径不同,有效成分暴露程度不同,加上巴利森苷类化合物特殊的结构造成其热不稳定,且降解速率受到pH影响,当3
2.2 组织分布 Jiang等[49]建立UHPLC-ESI-MS/MS法研究天麻素和巴利森苷A在大鼠体内的相对组织分布,结果显示,巴利森苷A在大鼠体内的主要分布组织是肺、肝、肾。郑秀艳[50]灌胃给予大鼠4 g/kg天麻微粉和0.6 g/kg天麻提取物(相当于4 g/kg生药量),研究发现,天麻素和巴利森苷A均能快速分布到心、肝、脾、肺、肾中,但在脑组织中,只检测到了微量巴利森苷A,未检测到天麻素,灌胃给予4 g/kg天麻微粉时肾和肺中含量最高,灌胃给予0.6 g/kg天麻提取物时肾中含量最高。Wang等[51]采用高效液相色谱法对天麻药动学和组织学进行研究,发现天麻进入体内0.5~10 h能检测到巴利森苷C,在所有组织中含量均较高,其中心脏组织中的巴利森苷C含量最高,其次是肝脏、脾脏。心脏及脾脏在4 h、肝脏7 h、肾脏10 h分别达到吸收峰,肺和脑中含量较低。巴利森苷C在肝脏中含量较高,这可能与天麻属肝经有关。
2.3 代谢
2.3.1 灌胃 Tang等[52]灌胃给予大鼠375 mg/kg巴利森苷A,5 min内巴利森苷A完全代谢为天麻素、对羟基苯甲醇、巴利森苷B、巴利森苷C。天麻素在45 min时质量浓度达到峰值,为6.3 μg/mL,对羟基苯甲醇、巴利森苷B、巴利森苷C分别在60、60、30 min达到28、955、592 ng/mL的峰值浓度。给药8 h后,天麻素、对羟基苯甲醇、巴利森苷B、巴利森苷C在体内迅速消除,4种代谢物的质量浓度分别降至343.2、6.9、40.7、25.0 ng/mL。Tang等[28,53]又灌胃给予大鼠游离天麻素、巴利森苷A、天麻提取物,结果在大鼠血浆和尿液中检测和鉴定到14种巴利森苷AⅠ期代谢和Ⅱ期转化代谢产物,包括7种水解物和7种天麻素衍生物,主要代谢过程是水解、氧化、硫酸化、葡萄糖醛酸化、甘氨酸结合或混合模式,代谢途径见图1。灌胃给药5 min后,在大鼠血浆中检测到天麻素,游离天麻素、巴利森苷A、天麻提取物分别在0.42、0.83、1 h后达到Cmax。大鼠灌胃给予游离天麻素后,天麻素迅速从血浆中消除,而以巴利森苷A、天麻提取物灌胃后,天麻素的tmax分别延迟约2、2.3倍,提示天麻素在体内作用时间短,而以巴利森苷或天麻提取物形式给药可延缓吸收半衰期、消除半衰期和达峰时间,避免临床上多剂量给药。Liu等[54]灌胃给予比格犬低、中、高剂量高天麻胶囊,采用LC-ESI-MS/MS法对比格犬血浆中的天麻素及巴利森苷A、B、C、E进行分析,研究发现,灌胃给药10 min后,比格犬血浆中检测到天麻素,各剂量组比格犬tmax大约是大鼠的2倍,提示天麻素在比格犬体内的作用起效时间比在大鼠上出现的时间长。天麻素平均血浆清除率(CL)最快,巴利森苷E体内药物消除速度最慢。
2.3.2 静脉注射 Tang等[55]通过静脉注射给予大鼠72.5、116、220 mg/kg巴利森苷A后,巴利森苷A代谢为天麻素、对羟基苯甲醇、巴利森苷B、巴利森苷C、巴利森苷E、巴利森苷G和3种甲基代谢物,其中巴利森苷A到天麻素的转化率为50%。静脉注射巴利森苷A 8 h内可在血浆中检测到天麻素,而对羟基苯甲醇仅在2 h内可检测到,其他最多在4 h内可检测到。由于柠檬酸和天麻素之间的化学键是酯键,在强酸或强碱环境、酶反应或恒定的环境中容易被破坏,巴利森苷A静脉给药后迅速代谢,平均消除半衰期约为0.35 h,这比灌胃天麻提取物和天麻粉后的巴利森苷平均消除半衰期(约1 h)低。各剂量巴利森苷A的每种代谢物都有相似的代谢过程,并且巴利森苷A的生物利用度约为14%。
2.4 排泄 Jiang等[49]灌胃给予大鼠4.0、0.6 g/kg天麻提取物,在大鼠的粪便中几乎找不到天麻素和巴利森苷A,这可能是由于肠肝循环作用或分析物被肠道菌群分解成其他化合物所致。大鼠灌胃4.0、0.6 g/kg天麻提取物后,尿排泄是主要途径,其中天麻素在尿中24 h内的累积排泄率较高,而巴利森苷A的累积排泄率较低,这可能是巴利森苷A在各组织中广泛代谢的结果,巴利森苷A可在肝脏或其他组织中转化为天麻素或其他形式。
2.5 巴利森苷药物动力学特点 大鼠灌胃给药天麻后,巴利森苷C在3 h达到峰值,t1/2α为(0.699±0.051)h,AUC0~∞为(12.8±1.57)mg·h/L,CL为(0.077 9±0.003 3)L/(h·kg),提示巴利森苷C在血浆中清除迅速,符合一室模型特点[51]。
表2显示不同给药途径给予SD大鼠后巴利森苷A的主要药动学参数[28,55-56]。由此可知,静脉注射给药巴利森苷A半衰期t1/2小于灌胃给药t1/2,静注给药巴利森苷A总清除率(CL)大于灌胃给予天麻提取物与天麻粉CL,提示静脉给药在大鼠体内迅速吸收,而后迅速消除;静脉给药途径中巴利森苷A半衰期t1/2与剂量无关,一次给药的血药浓度-时间曲线下面积AUC与剂量成正比,提示巴利森苷A静脉给予SD大鼠符合药物体内一级速度过程。表3显示灌胃给予比格犬不同剂量天麻胶囊后巴利森苷类成分的主要药动学参数[54],它们是通过非房室模型拟合血药浓度曲线得到的,由此可知,灌胃给药途径中巴利森苷A、B、C、E的半衰期t1/2与剂量无关,一次给药的血药浓度-时间曲线下面积AUC与剂量成正比,提示灌胃给予巴利森苷类成分在比格犬体内符合药物一级速度过程。
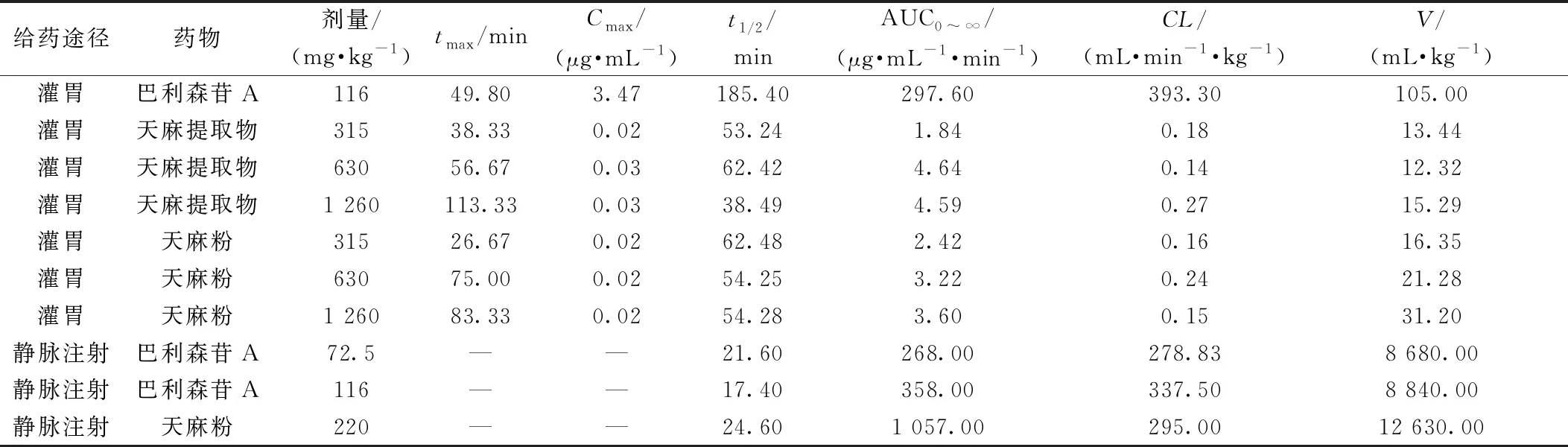
表2 不同给药途径给予SD大鼠后巴利森苷A主要药动学参数
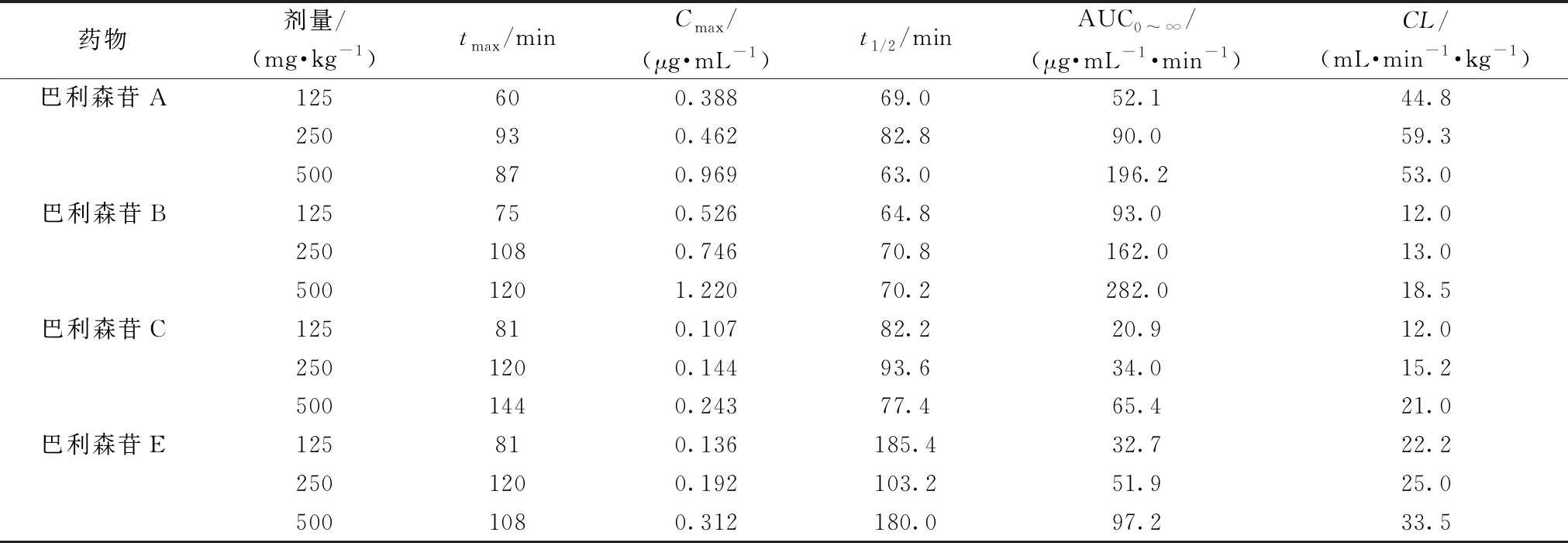
表3 天麻胶囊灌胃给药比格犬后巴利森苷类成分主要药动学参数
2.6 组分配伍对巴利森苷体内过程的影响分析 彭春燕[57]以活性单体成分巴利森苷A和异钩藤碱配伍来代替单味药天麻及钩藤的配伍,研究发现,巴利森苷A吸收入血后大部分代谢转化成天麻素,在联合给药时,异钩藤碱和钩藤碱的吸收效果优于单独给药,天麻素主要的药动学参数得到优化,AUC值是单独给药的1.31倍,t1/2是后者的2.79倍,平均驻留时间是后者的1.84倍,组分配伍给药延长巴利森苷A在体内的作用时间,同时巴利森苷A存在明显的双峰现象,提示其在体内存在肝肠循环过程。在偏头痛模型大鼠体内,异钩藤碱和钩藤碱在各个组织中均有分布,而巴利森苷A和天麻素主要分布在小肠,各成分在给药6 h后基本代谢完毕。
3 讨论
天麻炮制历史悠久,不同炮制方法对天麻有效成分影响较大[58-60],同一炮制方法也可能由于操作程度的不同,而引起有效成分变化[61-62]。近年来对天麻炮制研究多集中在工艺优化方面,对炮制后各有效成分发生变化的机制研究不够深入,应该积极开展机制研究,从本质上理解炮制如何让天麻素与巴利森苷发生转化,从而利用炮制技术来聚集所需有效成分;另一方面可从体内代谢角度对主要有效成分转化进行深入研究,分析天麻炮制前后巴利森苷类成分的药动学参数变化,明确天麻素与巴利森苷类成分在体内的吸收转化情况,可为阐明天麻炮制机制提供新的切入点。
目前,天麻制剂主要集中在天麻素方面,巴利森苷类制剂研究较少。天麻素吸收受转运载体影响,有吸收饱和现象,导致制剂的生物利用度低。药动学研究发现,天麻素很难透过血脑屏障,脑靶向性差,临床上需要大剂量给药才能维持有效的血药浓度,患者耐受性差[63]。巴利森苷类化合物是以天麻素及其衍生物在不同羧基位点与柠檬酸缩合形成的酚类成分,在天麻中含量高于天麻素,有的甚至超过10倍,研究表明,巴利森苷作为前药,在体内可通过代谢成天麻素发挥药理效应[64-65],以巴利森苷形式给药可显以延缓天麻素吸收半衰期、消除半衰期和达峰时间[28]。因此,积极开展巴利森苷类成分的制剂研究,开发创新药物,为解决天麻素的生物利用度和脑靶向性低、临床上多剂量给药等问题提供新的理论支持和技术支撑,这是巴利森苷开发的重要方向。
