芹菜素纳米结构脂质载体的制备及其体内抗肿瘤活性研究
2022-12-02王风云李伟宏
王风云, 李伟宏
(河南应用技术职业学院,河南 郑州 450042)
芹菜素属于黄酮类化合物,也称芹黄素,主要存在于柏科圆柏叶、卷柏科卷柏全草及伞形科植物旱芹叶中[1],具有多种活性,主要包括抗炎、抗氧化、抗动脉硬化、抗血栓、抗病毒、抗焦虑等[2],并且近年来其抗肿瘤作用也日益得到关注[3-5],尤其是在抗乳腺癌方面最显著,其机制可能是通过增加Bax/Bcl-2比值、下调突变型p53基因表达、上调P73介导PIG3基因表达等来抑制肿瘤细胞生长[5],但该成分为难溶性物质[6],难以制成注射剂。纳米技术是难溶性药物制成注射剂的有效途径[7],往往可增强中药有效成分的抗肿瘤活性,已报道的芹菜素相关研究有固体脂质纳米粒[1]、PLGA纳米粒[8]、胶束[9]等,但存在包封率和载药量不高、稳定性差等缺陷。
纳米结构脂质载体将固液脂质联合使用,具有较高的包封率及载药量[10-13],稳定性良好,能有效改善难溶性药物的溶解性、药效等[14-15]。本实验制备芹菜素纳米结构脂质载体,并考察其体内抗肿瘤活性,以期为该成分提供可静脉注射的剂型,丰富其抗肿瘤活性研究,也为相关临床应用奠定基础。
1 材料
Agilent 1260型高效液相色谱仪(配置二极管阵列检测器,美国Agilent公司);MSA6.6S型电子分析天平(百万分之一,上海精密仪器仪表有限公司);TMX-22R型高速离心机(美国贝克曼-库尔特公司);PRD-S-027HDHT型超声波清洗仪(深圳市普瑞登科技有限公司);Master-sizer型粒度分析仪(英国马尔文仪器有限公司);ELx808型酶标仪(山东浩中化工科技有限公司);HSX-1000N恒温恒湿培养箱(上海幕斯实验设备有限公司);超滤离心管(30 kDa,美国Millipore公司)。
紫杉醇注射液(批号200518,北京协和药厂)。芹菜素原料药(批号200218,纯度98.6%,陕西惠科植物开发有限公司)。Miglyol®812(批号P20191205,北京凤礼精求医药股份有限公司);单硬脂酸甘油酯(批号161025,北京凤礼精求医药股份有限公司);泊洛沙姆188(批号20201105,武汉新大地环保材料股份有限公司)。
人乳腺癌MDA-MB-231细胞,购自河南省肿瘤研究所。
SPF级雌性裸鼠,6~7周龄,体质量20~24 g,购自河南省动物实验中心,动物生产许可证号SCXK(豫)2016-0001。
2 方法与结果
2.1 HPLC法测定芹菜素含量
2.1.1 色谱条件 Agilent SB C18色谱柱(250 mm×4.6 mm,5 μm);流动相0.1%磷酸-乙腈(30∶70,超声混匀后单泵进样);体积流量1.0 mL/min;柱温30 ℃;检测波长312 nm。
2.1.2 线性关系考察 称取芹菜素对照品50 mg至50 mL量瓶中,30 mL甲醇超声处理3 min,静置10 min后甲醇定容,得1.0 mg/mL贮备液,流动相依次稀释成50.0、25.0、10.0、1.0、0.5、0.05 μg/mL溶液,在“2.1.1”项色谱条件下进样测定。以对照品峰面积(Y)对其质量浓度(X)进行回归,得方程为Y=18.712 5X+0.843 2(r=0.999 9),在0.05~5.0 μg/mL范围内线性关系良好。
2.1.3 供试品溶液制备 取纳米结构脂质载体混悬液1 mL,置于50 mL量瓶中,30 mL甲醇超声处理3 min,流动相定容至刻度,0.45 μm微孔滤膜过滤,取续滤液,即得。
2.1.4 方法学考察 取纳米结构脂质载体混悬液适量,按“2.1.3”项下方法平行制备6份供试品溶液,在“2.1.1”项色谱条件下进样测定,测得芹菜素含量RSD为1.32%,表明该方法重复性良好。取同一份供试品溶液,在“2.1.1”项色谱条件下进样测定6次,测得芹菜素含量RSD为0.71%,表明仪器精密度良好。取同一份供试品溶液,于0、1、2、4、8、12 h在“2.1.1”项色谱条件下进样测定,测得芹菜素含量RSD为0.85%,表明溶液在12 h内稳定性良好。取9份纳米结构脂质载体混悬液,每份1.0 mL,置于50 mL量瓶中,分为低、中、高3组,每组3份,分别加入对照品溶液0.6、0.8、1.0 mL,30 mL甲醇超声处理3 min,流动相定容至刻度,0.45 μm微孔滤膜过滤,取续滤液,在“2.1.1”项色谱条件下进样测定,测得芹菜素平均加样回收率分别为99.37%、100.13%、99.69%,RSD分别为0.44%、0.72%、0.50%。
2.2 纳米结构脂质载体制备 固定芹菜素用量为50 mg,固态脂质材料为单硬脂酸甘油酯,液态脂质材料为Miglyol®812,加入20 mL无水乙醇,75 ℃水浴搅拌溶解,作为有机相;固定水相体积为60 mL,加入一定量泊洛沙姆188,75 ℃水浴搅拌溶解,作为水相,在800 r/min下将有机相滴至水相中,滴毕后敞口搅拌1.5 h,在300 W功率下超声处理15 min(工作2 s,间隔2 s),置于-15 ℃冰箱中低温固化10 min,室温静置20 min,0.45 μm微孔滤膜过滤,补加蒸馏水至60 mL,摇匀,即得。
2.3 包封率、载药量测定 取纳米结构脂质载体混悬液1 mL,置于50 mL量瓶中,30 mL甲醇超声处理3 min,流动相定容至刻度,0.45 μm微孔滤膜过滤,取续滤液,在“2.1.1”项色谱条件下进样测定,计算芹菜素总含量(m总)。取1 mL纳米结构脂质载体混悬液至超滤管中,12 000 r/min离心30 min,取外管续滤液,计算游离芹菜素含量(m游离),按照文献[12]报道的方法测定包封率、载药量。
2.4 粒径、Zeta电位测定 取0.1 mL纳米结构脂质载体混悬液,加入3.5 mL蒸馏水混匀,转移至比色皿中,测定粒径、Zeta电位。
2.5 Box-Behnken响应面法 对纳米结构脂质体而言,包封率、粒径是重要指标[9]。课题组前期考察大豆油、Miglyol®812、油酸,发现以Miglyol®812制备时包封率、粒径均优于大豆油、油酸,故选择其作为液态脂质。不同固液脂质比(1∶1、2∶1、3∶1、4∶1、5∶1)对包封率有一定影响,而对粒径影响更大,由于1∶1时初乳有分层现象,5∶1时包封率较低,故对2∶1、3∶1、4∶1进行优化。不同脂药比(10∶1、15∶1、20∶1、25∶1)对包封率、粒径有一定影响,由于25∶1时包封率不再增加,粒径开始增大,故对10∶1、15∶1、20∶1进行优化。不同表面活性剂用量(0.5%、0.8%、1.2%、1.6%、2.0%)对包封率、粒径的影响较大,由于0.5%时粒径较大,包封率较低,1.8%时包封率出现下降趋势,故对0.8%、1.2%、1.6%进行优化。再对超声功率(200、250、300、350 W)、超声时间(5、10、15、20 min)进行考察,最终确定两者分别为300 W、15 min。
在上述预实验基础上,选择脂药比(X1)、固液脂质比(X2)、表面活性剂用量(X3)作为影响因素,包封率(Y1)、粒径(Y2)作为评价指标,采用Box-Behnken响应面法优化制备工艺,因素水平见表1,结果见表2。

表1 因素水平


表2 试验设计与结果
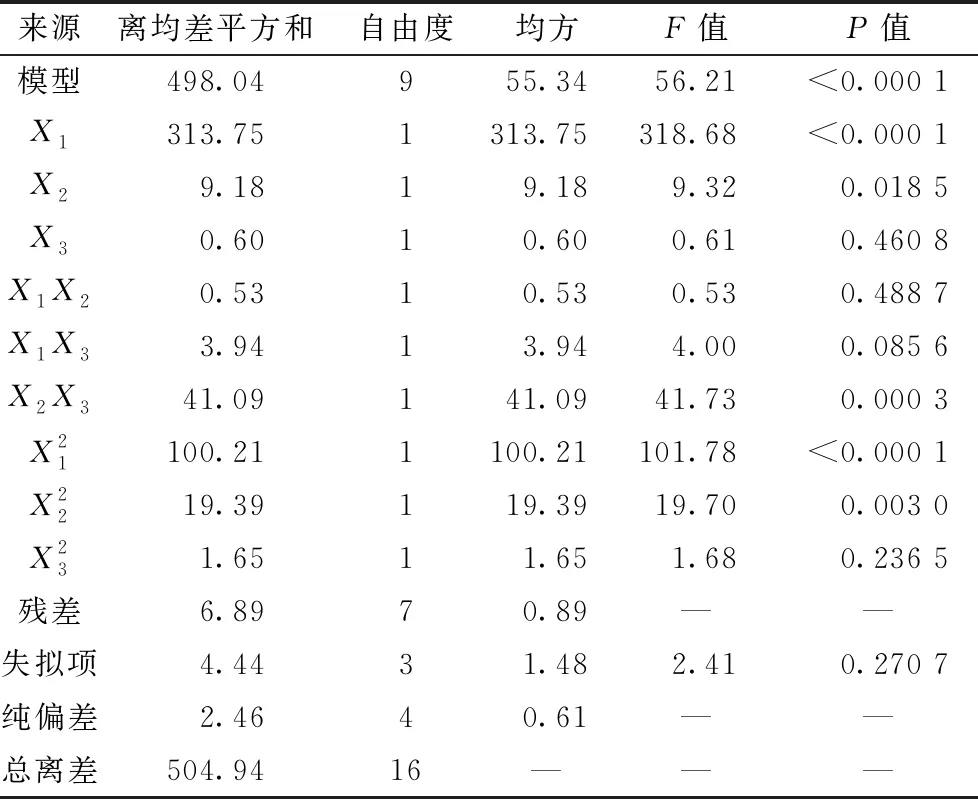
表3 Y1方差分析

表4 Y2方差分析
响应面分析见图1~2。由图1可知,固定X3时随着X1或X2增加,包封率先升后降,以X1影响程度更明显;固定X1时X2与X3交互作用较明显,包封率随着X2或X3增加有降低趋势;固定X2时包封率随着X1增加先升后降。由图2可知,X1X2、X1X3、X2X3曲面均较陡峭,表明两者交互作用明显,随着其中2个因素同时减小,粒径均呈先降低后略微升高的趋势。最终确定,最优工艺为脂药比14.3∶1,固液脂质比3.8∶1,表面活性剂用量1.3%,包封率为84.54%,粒径为162.4 nm。按上述优化工艺平行制备3份纳米结构脂质载体,测得平均包封率为82.87%,粒径(图3)为164.8 nm,与预测值84.54%、162.4 nm接近,表明该工艺稳定可行。
2.6 载药量、Zeta电位测定及形态观察 取“2.5.4”项下3批纳米结构脂质载体,按“2.3”项下方法测得平均载药量为5.13%,按“2.4”项下方法测得平均Zeta电位(图4)为-33.5 mV。
取纳米结构脂质载体混悬液0.1 mL,加入3 mL蒸馏水混匀,滴在铜网上,静置0.5 h后滴加0.5%钨酸钠溶液,静置10 min染色,滤纸轻轻吸去多余液体,在透射电镜(TEM)下观察,结果见图5。由此可知,纳米结构脂质载体呈球形或椭圆形,基本无粘连。
2.7 体外释药研究 设定溶出仪温度为(37±1)℃,搅拌桨转速为75 r/min,释放介质为2%SDS溶液,体积为1 000 mL。剪取5 cm透析袋(截留分子量8 000~14 000 Da),活化后备用。取纳米结构脂质载体混悬液(芹菜素含量为2 mg)适量,加入3 mL释放介质,转移至透析袋,两端扎紧,再制备芹菜素乙醇溶液及2%SDS混悬液,同法操作,于0、0.25、0.5、1、2、2.5、3、4、6、8、12、24、36、48、72 h各取样3 mL,同时补加3 mL空白释放介质,0.45 μm微孔滤膜过滤,在“2.1.1”项色谱条件下进样测定,测定累积释放度,结果见图6。由此可知,乙醇溶液在6 h内基本释放完全,透析袋基本不吸附该成分;2%SDS混悬液12 h内累积释放度为35.17%,但72 h内仅增加至38.63%;纳米结构脂质载体在前6 h释药相对较快,累积释放度为51.32%,之后进入明显的缓慢释药阶段,72 h内累积释放度为79.08%。
2.8 介质稳定性研究 取纳米结构脂质载体混悬液适量,分别与1.8%NaCl溶液、10%葡萄糖溶液等体积混合,或与空白血浆按1∶4比例混合,置于37 ℃水浴中,于0、4、8、12、16、20、24 h测定粒径,结果见图7。由此可知,加入1.8%NaCl溶液、10%葡萄糖溶液或空白血浆后粒径均有增加趋势,但在1.8%NaCl溶液中程度最小,故选择其作为注射介质。
2.9 体内抗肿瘤活性研究
2.9.1 模型建立 取对数生长期的MDA-MB-231细胞,生理盐水重悬其密度至2.5×107/mL,接种前将细胞悬液摇匀以保证肿瘤呈圆形或类圆形。将细胞悬液振荡后,于超净工作台上按0.2 mL/只剂量接种于裸鼠背部右侧靠近腋窝处皮下,轻压注射点以防止细胞外渗,全程在SPF级实验环境中进行。
2.9.2 分组、给药与指标检测 将荷瘤裸鼠随机分为空白组、阳性组(5 mg/kg紫杉醇)及芹菜素纳米结构脂质载体低剂量组(2 mg/kg)、中剂量组(5 mg/kg)、高剂量组(10 mg/kg),每组8只,每2 d天腹腔注射给药1次,连续3周。每3 d测量肿瘤短径(a)、长径(b),计算瘤体积V[16],公式为V=ab2π/6,选择大于100 mm3者进行后续研究。实验结束后称定瘤重,颈椎脱臼处死裸鼠,剥离瘤体,计算抑瘤率,公式为抑瘤率=(1-给药组平均瘤重/空白组平均瘤重)×100%[16-17]。
2.9.3 结果分析 各组裸鼠均未出现死亡现象,并且体质量变化程度均未超过15%(增重分别为13.7%、9.6%、3.2%、-4.7%、-12.9%),一般认为在治疗期间动物死亡超过20%或体质量下降超过15%时均为药物毒性反应[18],可知本实验所用药物剂量基本不产生毒性。图8~9、表5显示,各组裸鼠瘤体积由大到小依次为空白组、芹菜素纳米结构脂质载体低剂量组、芹菜素纳米结构脂质载体中剂量组、芹菜素纳米结构脂质载体高剂量组、阳性组;与空白组比较,阳性组及芹菜素纳米结构脂质载体中、高剂量组裸鼠瘤重降低(P<0.01),表明抑瘤作用显著,其中高剂量组降低程度与阳性组无明显差异(P>0.05),抑瘤率大于30%,具有较好的开发潜力,并且2组裸鼠体质量比较,差异有统计学意义(P<0.05),表明高剂量芹菜素纳米结构脂质载体毒性可能低于紫杉醇。
3 讨论
芹菜素在水中溶解度仅为1.35 μg/mL[6],不具备直接制成注射剂的条件[16],故本实验采用纳米技术将该成分制成纳米结构脂质载体,并采用Box-Behnken响应面法优化处方。体外释药研究结果显示,初期(0~6 h)释药较快,可能是由于纳米结构脂质载体中存在一定量的游离芹菜素,也可能与吸附在纳米结构脂质载体浅表层、表层的药物容易释放有关;后期(6 h后)释药较慢,可能是由于固液脂质载体对包裹于内部的药物有阻滞作用所致[15]。

表5 各组裸鼠抑瘤率比较
正常组织细胞间距一般在50 nm左右,而肿瘤细胞由于生长速度较快,导致其细胞间距也较大,一般在100~250 nm之间[17],故200 nm左右粒径的纳米制剂可选择性进入肿瘤组织而发挥抗肿瘤作用,提高药效,同时其缓释作用也有助于药物持续发挥药效[7,19]。芹菜素体内稳定性存在一定问题[20],而采用固体脂质体包裹后有助于改善其稳定性,提高药效。体内抗肿瘤研究结果表明,纳米结构脂质载体高剂量组(10 mg/kg)的肿瘤抑制率超过30%,基本达到紫杉醇(5 mg/kg)水平。本实验解决了芹菜素制备注射剂的难题,而且证明了其体内有效性,后续将对该成分体内药动学、冻干制剂工艺、质量标准等方面作进一步研究。
