高寒草甸植物根际溶磷菌的筛选鉴定及其溶磷与促生效果
2022-12-01蔺宝珺杨文权柴港宁鱼杨华武燕茹韩显忠李希来寇建村
蔺宝珺,杨文权,赵 帅,柴港宁,鱼杨华,武燕茹,韩显忠,李希来,寇建村*
(1.西北农林科技大学草业与草原学院,陕西 杨凌 712100;2.西北农林科技大学生命科学学院,陕西 杨凌 712100;3.门源县草原站,青海 门源 810300;4.青海大学农牧学院,青海 西宁 810016)
土壤中的磷以有机和无机的形式存在,其作为植物生长发育所必需的矿质营养元素对植物的生长发育和品质提高具有重要意义[1-2]。然而磷作为一种沉积性矿物,绝大部分与土壤中阳离子等结合,植物难以吸收利用,所以往往成为植物生长的主要限制因素[3-5]。施用磷肥是提高土壤有效磷常用的方法,但磷肥施入土壤后常会被金属离子固定形成磷酸钙等难溶性磷酸盐,降低了磷肥效果。此外,长期施用磷肥会造成一系列环境问题如土壤板结、酸化和水体富营养化等[6]。
溶磷菌可以将难溶无机磷转化为可溶性磷酸盐,或是将有机磷转化为无机磷,易于植物和土壤微生物的吸收利用,既能缓解土壤速效磷的缺乏问题,又能减少环境污染,因此,溶磷微生物的开发利用成为研究热点[7-10]。土壤中溶磷细菌的种类和磷素来源不同,其溶磷的机制不同,此外土壤结构类型、质地、土壤有机质和耕作方式对溶磷菌的数量和分布也有很大影响[11-12]。目前,关于溶磷菌在水稻(OryzasativaL.)、小麦(TriticumaestivumL.)、玉米(ZeamaysL.)等农作物上的研究较多[13-18],而高寒草地等特殊生境下的植物根际溶磷菌的研究也引起了不少关注,且大部分研究集中在筛选、溶磷能力及作用机理等方面。其中,在川西北高寒草甸植物根际筛选出12株兼具溶磷、固氮和解钾的多功能菌株[19];在四川红原高寒草地筛选出的部分溶磷菌株既分泌吲哚-3-乙酸(IAA),又能分泌赤霉素(GA3)和玉米素(t-Z)[20];在西藏阿里的高寒牧草根际筛选出的高效溶磷菌对植物有较好的促生作用[21]。尽管如此,青藏高原高寒地区的溶磷菌资源的筛选及其应用的研究鲜有报道,挖掘该地区的溶磷菌用于菌肥开发和高寒退化草地修复已成为一项具有重要意义的工作。为此,本研究对祁连山国家公园青海片区的门源县硫磺沟高寒草甸植物根际土壤中的溶磷细菌进行了分离,并对分离的4株溶磷菌的溶磷特性、促生效果等进行了研究,为青藏高原特殊环境下的微生物菌肥的开发和利用提供理论基础。
1 材料与方法
1.1 土壤来源
采样地点位于祁连山公园青海片区的青海省门源回族自治县硫磺沟。选择生长旺盛的小嵩草(Kobresiamyosuroides(Villars)Foiri)和洽草(Koeleriamacrantha(Ledebour)Schultes),用铲子将植物连根挖出,刷掉根际土壤装于无菌密封袋中并编号,带回实验室于4℃冰箱保存。
1.2 溶磷菌株的分离、筛选
溶磷菌采用稀释平板涂布法在无机磷固体培养基表面进行分离纯化[22]。28℃培养3—5 d后,挑选出现透明圈的不同形态菌落,在无机磷固体培养基上划线数次,得到纯化的单菌落并编号。将纯化后的溶磷菌株保存于装有已灭菌的LB液体培养基[21,23]和甘油的保菌管中,置于-80℃冰箱备用。
1.3 菌株溶磷能力的测定
1.3.1溶磷圈直径的测定 采用溶磷圈法对溶磷菌的溶磷性能进行定性测试[24],用游标卡尺测量D,d值,并计算SI值。D表示透明圈直径,d表示菌落直径,单位均为mm。公式如下。
SI=D/d
1.3.2溶磷菌磷增量的测定 挑取待测菌株单菌落于LB液体培养基,置于摇床培养24 h,调OD700至1,再按1%的接种量将菌液分别接种到无机磷液体培养基中,以未接菌培养基作空白对照(CK),置于28℃,190 r·min-1摇床震荡培养7 d后,在4℃,8 000 r·min-1下离心20 min,取上清液用钼锑抗比色法测定扣除对照后各个菌株有效磷增量[24],并计算解磷率[25]。同时用酸度计测定上清液的pH值。

式中,ρ为从标准曲线上查得有效磷的浓度(μg·mL-1),Ts为分取倍数,V0为测定培养液的体积(mL),V为显色时定容体积(mL)。
1.4 菌株分泌有机酸能力的测定
采用不同分析纯有机酸标准品(草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸)制备不同梯度有机酸标准品混合液。取上述培养液离心后的上清液,参照管国强等人[26]试验方案进行有机酸测定。
1.5 菌株16S rRNA序列鉴定
将筛选出来的菌株纯培养后送至北京擎科生物科技有限公司西安分公司进行16S rRNA基因测序[27],并使用MEGA10软件的Neighbor-Joining法构建系统发育树。
1.6 盆栽试验
所用营养土来源于品氏托普园艺(上海)有限公司。种植前将营养土置于高温高压灭菌锅中灭菌三次作为培养基质,披碱草种子用75%酒精和2%(v/v)次氯酸钠溶液消毒促生,并用无菌水清洗数次[27-28]。每盆均匀播种25粒,待披碱草出苗一周后进行接菌试验。挑取所接菌株单菌落于LB液体培养基中,在28℃,190 r·min-1摇床上震荡培养,调节菌液OD700=1时接菌,每周接菌一次,共接种4次。试验设置5个处理,每个处理三个重复,分别为添加25 mL未接菌(CK)和接种了MXSC5,MXSC6,MXSC7及MQC13的LB液体培养基。第一次接菌28 d后测量植株绝对株高,收获地上部分测定鲜重、干重并计算含水量。参考鲍士旦《农化分析第三版》[29],测定土壤pH值、有机质、速效磷和速效氮以及植物全氮、全磷、全钾。
1.7 数据处理
利用Excel软件对菌株溶磷能力、分泌有机酸含量及盆栽试验数据进行整理并处理,SPSS19.0软件进行单因素方差分析(One-Way ANOVA)和最小显著差异(LSD)检验,用Origin2021软件作图。
2 结果与分析
2.1 菌株溶磷能力测定
从小嵩草和洽草根际土中筛选到具有溶磷效果的菌株4株。源自小嵩草根际土壤的菌株命名为MXSC5,MXSC6和MXSC7,筛选自洽草根际土壤的菌株命名为MQC13。4株溶磷菌均能在固体培养基上良好生长,并可形成肉眼可见的透明圈,随着培养时间的增加,透明圈直径(D)和菌落直径(d)均在增大(表1)。菌株MXSC5和MXSC7的SI值在第14 d达到最大,菌株MXSC6和MQC13的SI值在第16 d时略有增加。
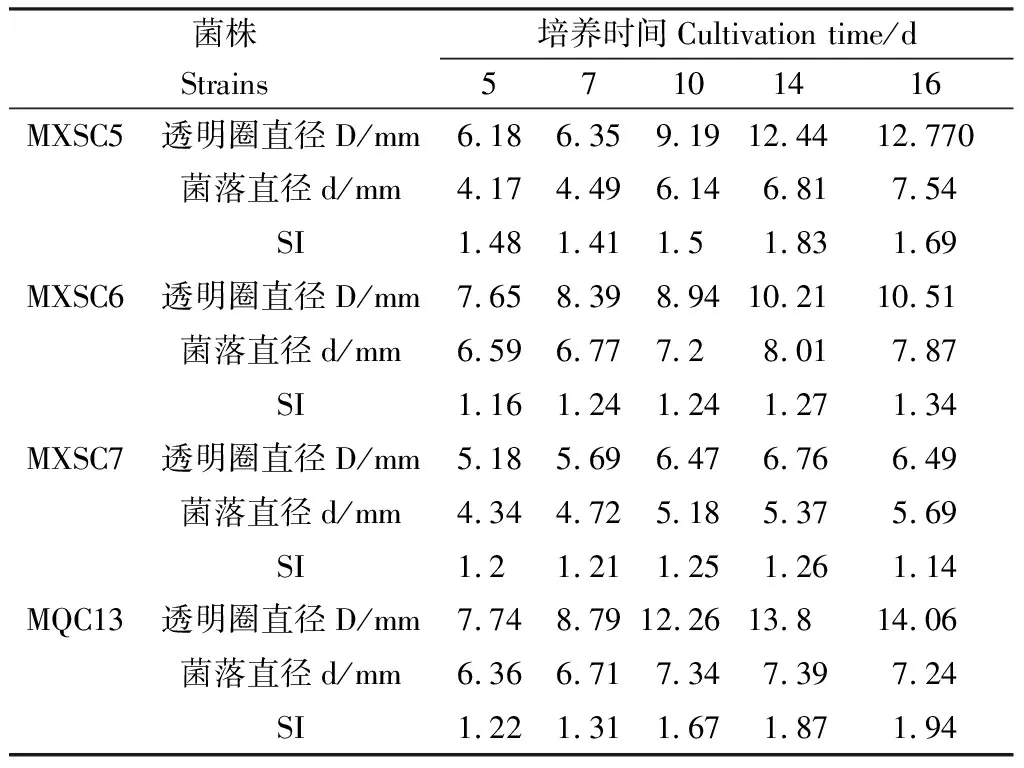
表1 4株溶磷菌在固体培养条件下的溶磷表现
液体培养条件下,4株菌株在第7 d的溶磷能力测定结果显示,有效磷增量在156.17~511.33 μg·mL-1之间,各处理组间差异显著(P<0.05),其中MQC13磷增量最大,MXSC7的磷增量最小,解磷率范围为3.12%~10.23%;与对照组相比,接菌培养液pH值都有所降低(表2)。
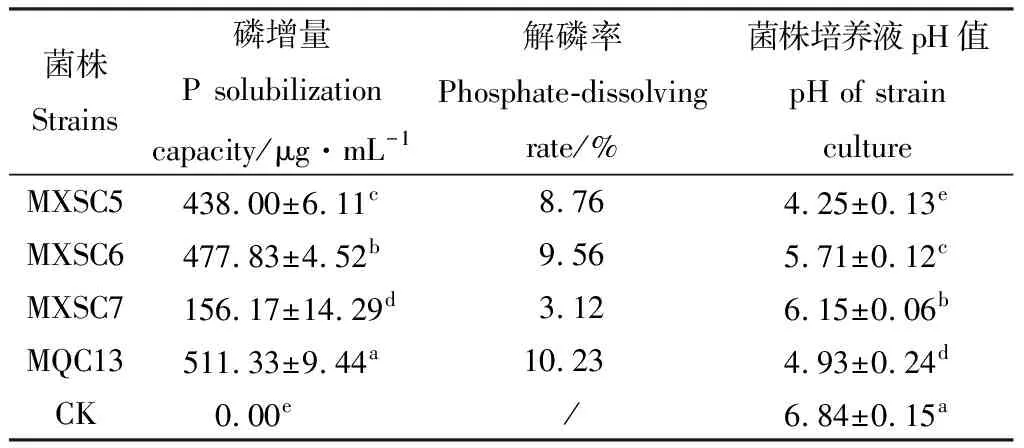
表2 4株溶磷菌第7 d在液体培养条件下的溶磷能力和培养液的pH值
2.2 菌株分泌有机酸的种类及浓度
4株菌株在溶磷过程中均分泌草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸和琥珀酸,草酸含量最高。总有机酸量在522.36~986.69 mg·L-1之间,MQC13培养液的总有机酸量最高,MXSC7总有机酸含量最低,且MXSC5的总有机酸量与MXSC6和MXSC7的差异极显著(P<0.01),这与MQC13的表现一致(表3)。由此可见,4株溶磷菌分泌的有机酸含量差异较大。
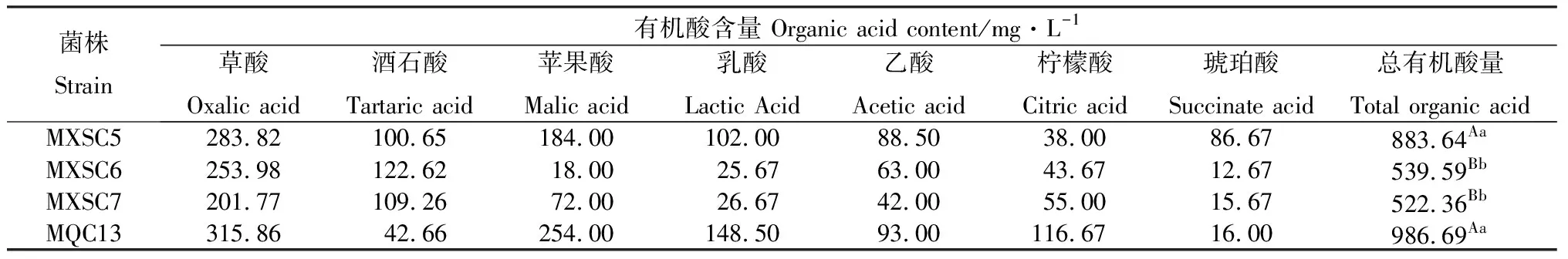
表3 4株溶磷菌分泌的有机酸的含量
2.3 菌株的鉴定
对筛选出的4株溶磷菌株进行16S rRNA基因测序,提交所得序列至EZbiocloud并进行比对,选取了相似度较高的菌株16S rRNA基因序列与所筛选菌株构建系统发育树(图2)。结果显示,MXSC6和MQC13分别鉴定为P.brassicacearumsubsp.Neoaurantiaca和P.atacamensis;4株溶磷菌株均为假单胞菌属。
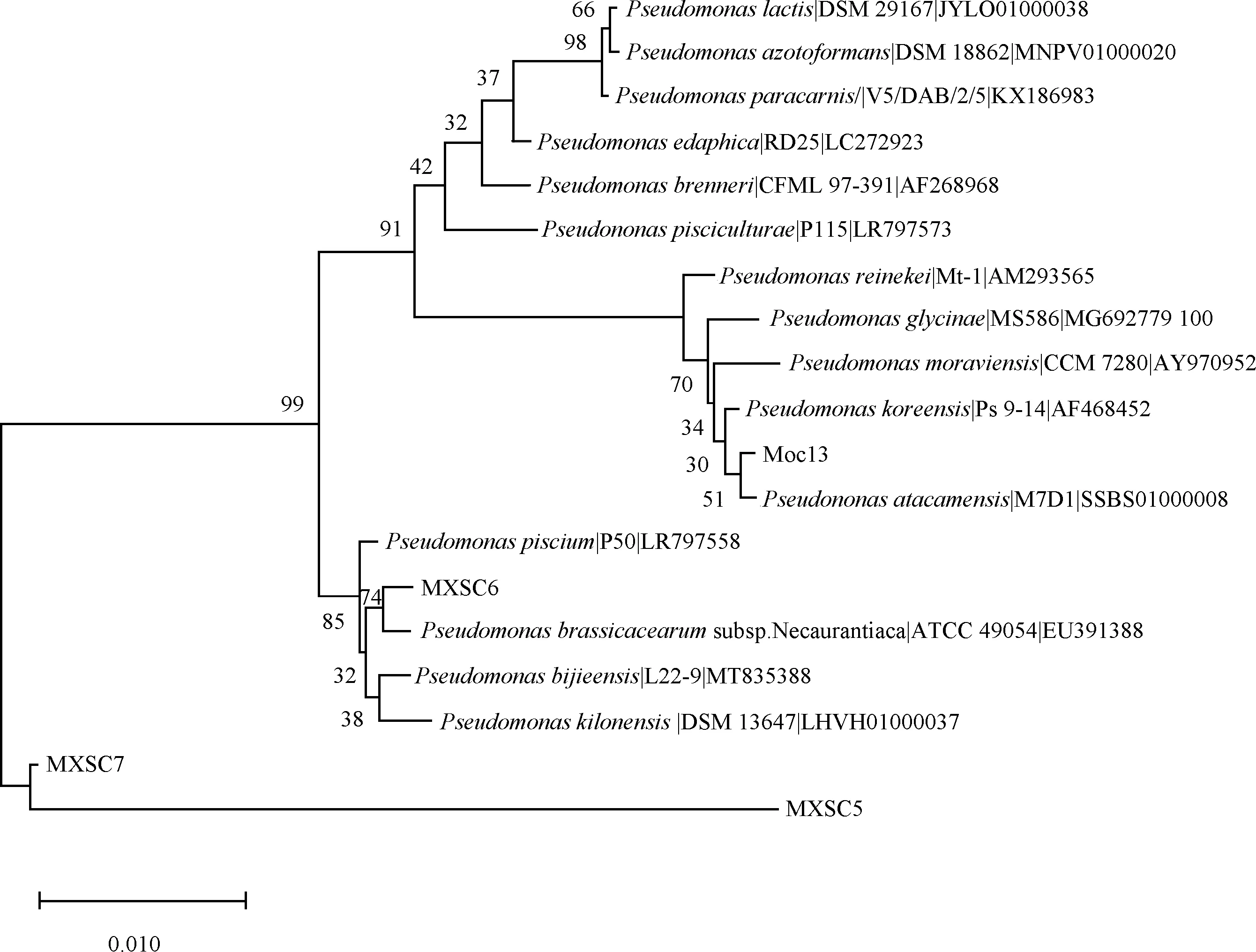
图1 基于16S rRNA基因序列构建的4株溶磷菌的系统发育树
2.4 盆栽试验
接菌增加了披碱草的株高和地上部干重(图2,图3a,3b)。4组接菌处理植株的株高在44.73~47.43 cm之间,较对照组增加显著(P<0.05)。5组处理中,披碱草地上部干重在3.05~4.34 g之间,除MXSC6处理外,其余接菌处理较对照组增加显著(P<0.05)。

图2 接菌对披碱草生长状况的影响
5组处理中披碱草地上部全氮、全磷、全钾含量高低不同(图3 d,3e,3f)。除MQC13处理外,其余接菌处理全氮含量较对照组增加显著(P<0.05)。植株地上部全磷含量为MXSC5处理最高,较对照组增加显著(P<0.05),MXSC7处理则低于其他处理组及对照。此外4组接菌处理植株地上部全钾含量较对照组增加显著(P<0.05)。
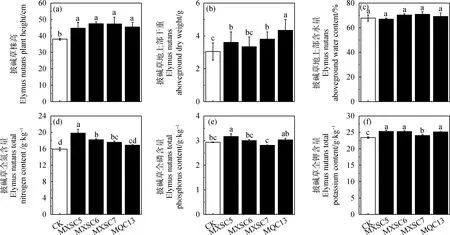
图3 接菌对披碱草生长指标及养分含量的影响
接菌处理后土壤养分发生不同程度的变化,与对照组相比,接菌处理组的土壤速效氮、速效磷和有机质含量均高于对照组(图4)。其中接菌处理的土壤速效氮含量较对照组增加显著;除MXSC6处理外,其他接菌处理的土壤速效磷含量增加显著;而对于土壤有机质含量,MXSC5处理较对照组增加显著(P<0.05)。
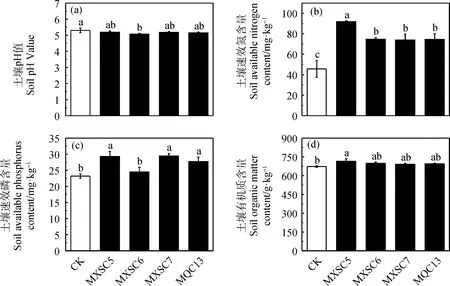
图4 接菌对土壤pH值及养分含量的影响
3 讨论
3.1 高寒草甸溶磷菌的筛选鉴定及溶磷能力分析
土壤中的溶磷菌主要有细菌、真菌和放线菌,种类、数量及实际应用最多的是细菌,包括芽孢杆菌属(Bacillussp.)、假单胞菌属(Pseudomonassp.)、欧文氏菌属(Erwiniasp.)等[2,30]。本研究从高寒草甸筛选出4株可以溶解无机磷的菌株,经16S rRNA基因序列分析,MXSC6和MQC13分别鉴定为P.brassicacearumsubsp.Neoaurantiaca和P.atacamensis,4株溶磷菌株均鉴定为假单胞菌属。前人针对不同溶磷菌的溶磷特性与适应能力都有较多研究,同时也有将溶磷菌与其他根际促生菌等结合以促进植物对养分的吸收,为更好地将溶磷菌与实际生产相结合提供理论基础[30-32]。本研究中4株溶磷菌在无机磷固体培养基上随着培养时间增加,溶磷圈直径也在变化,最后均达到最大或增长幅度趋于平缓,这可能与培养基中难溶性磷酸盐的含量、菌株代谢产物释放速度等有关。4株菌株在无机磷液体培养基中的磷增量在156.17~511.33 μg·mL-1之间,高于杨婉秋[19]、张英等人[21]在高寒草地植物根际筛选的溶磷菌。其原因可能是,一方面不同植物根际促生菌的种类及其产生的有机酸、菌体内代谢途径不同,另一方面培养基或土壤养分也会对溶磷菌的生长状况和代谢途径产生影响,进而表现出不同溶磷效果[19]。
3.2 菌株分泌有机酸及溶磷能力相关性研究
溶磷菌分泌的有机酸可以跟阳离子形成螯合物,释放磷酸根离子,菌种不同,其产酸的种类、含量和溶磷能力也不相同[33-36]。本试验所筛选的4株菌均可分泌草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸和琥珀酸7种有机酸,各菌株均为草酸含量最高,在溶磷过程中发挥主要作用。同时有效磷增量最高的菌株MQC13,其总有机酸量最高。各菌株在固体培养基上的SI值大小比较为MQC13>MXSC5>MXSC6>MXSC7,这与总有机酸量的表现一致,而在液体培养条件下的磷增量大小为MQC13>MXSC6>MXSC5>MXSC7。对总有机酸量与磷增量之间相关性进行研究,发现两者之间并无相关性,这可能是由于金属离子与不同种类的有机酸的结合能力不同,因此单一的总有机酸量并不能完全代表菌株的溶磷效果;也有可能是因为菌株在溶磷过程中自身吸收利用了一部分磷元素,或是以无机磷酸盐的形式贮藏在溶磷菌株细胞内,使得该菌株的溶磷能力被低估[4,37]。有研究认为溶磷菌溶磷量与pH值呈负相关[38-39],然而也有研究指出微生物的溶磷量与pH值之间不存在显著的相关性[40]。本试验中接菌处理的培养液的pH值与CK培养液相比有所降低。这与马文文等人在东祁连山高寒地区分离的溶磷菌在液体培养过程中培养液的pH值变化情况相一致[24]。相关性分析显示培养液pH值与总有机酸量相关性显著(P<0.05),与磷增量之间无显著相关性,说明本试验中有机酸降低了培养液pH值,但pH值的降低对菌株的溶磷能力作用较微弱。
3.3 菌株对披碱草促生效果研究
诸多研究表明溶磷微生物可以增加土壤养分,提高作物产量[41-42]。本试验盆栽结果显示,从高寒草甸根际土中所筛选出的4株溶磷菌株均可显著提高披碱草的株高和地上部干重(P<0.05),这与张英在高寒草原分离出的溶磷菌在披碱草盆栽接种试验的结果一致[21]。此外,菌株培养液提高了土壤速效养分,这与Kurek、Wu等人分别接种溶磷菌于苹果树(MalusdomesticaBorkh.)幼苗和油茶(CamelliaoleiferaAbel)的盆栽试验中,溶磷菌对土壤速效氮和速效磷有正向影响的结果相似[43-44]。接种溶磷菌使得植物生长和土壤养分发生变化,可能是由于溶磷菌株通过产生有机酸和胞外磷酸酶溶解土壤中的不溶性磷酸盐,缓解土壤中磷素的限制,从而促进植物的生长[45-46];另一方面可能与其代谢有关,溶磷菌通过分泌多种植物生长调节物质、维生素,对解磷以及植物生长具有双重促进效果[47]。此外,本试验所用营养土有机质含量较高,为溶磷菌提供足够有机碳源,促进其生命活动,也进一步提高了土壤速效养分[48]。
4 结论
本研究从青海高寒草甸洽草和小嵩草根际土壤中分离筛选出4株优良溶磷菌,均属于假单胞菌属;4株优良溶磷菌能有效促进植物生长,在高寒地区植物促生和微生物菌肥开发利用方面具有良好的潜力。
