有机杂质对硝酸铵液体热危险性影响的试验研究*
2022-12-01涂严暑朱顺兵刘昌浩段毅
涂严暑 朱顺兵,2 刘昌浩 段毅
(1.南京工业大学安全科学与工程学院,南京 210009;2.江苏省危险化学品本质安全与控制技术重点实验室,南京 210009)
0 引言
硝酸铵(AN)作为一种典型的危险化学品,在工业、农业等领域发挥着至关重要的作用。近来由于硝酸铵的热危险性引起的火灾爆炸事故频频发生,这不仅给国家经济造成严重损失,而且对人民的生命财产也造成严重威胁。最近的一次硝酸铵爆炸事故发生在2020年8月4日黎巴嫩的贝鲁特港口,此次爆炸共造成100多人死亡,4 000多人受伤,直接经济损失高达150亿美元且港口受损严重,是近年来发生的伤亡最惨重的一次事故。因此,通过硝酸铵的热危险性试验,以提高硝酸铵生产运输、储存的安全性至关重要。由于前人研究的仪器精度不足以及试验环境的限制,笔者采用更为精密的仪器进行试验,拟通过使用OLT420氧化性液体试验仪进行火灾危险性试验,通过对纯硝酸铵、混入有机杂质的硝酸铵混合物进行试验以及使用同步热分析仪SDT对硝酸铵热解特性进行试验分析,并结合Semenov模型进行理论推算,为安全生产提供重要依据。
1 试验
1.1 试验设备及试剂
试验装置为OLT420氧化性液体试验仪,同步热分析仪SDT Q600。OLT420氧化性液体试验仪通过在密闭条件下对试验样品进行点火测试,观察物质是否出现爆燃现象。试验研究硝酸铵与有机杂质混合体系热危险性影响特性。试验试剂包括硝酸铵、乙酸和尿素3种固体以及质量分数为85%的硝酸铵溶液。
1.2 试验方法
1.2.1 火灾危险性测试
火灾危险性是指火灾发生的可能性与暴露于火灾或燃烧产物中而产生的预期有害程度的综合反应,而硝酸铵的火灾危险性主要体现在其溶液的液体氧化性,文章对硝酸铵开展液体氧化性试验分析其火灾危险性。
反应物质按照试验方案称重后加入OLT420仪器反应腔内,按照标准进行试验并采集实验数据。设计3组对比试验,样品1为质量分数为85%的纯硝酸铵溶液(以下简称“硝酸铵溶液”);样品2为硝酸铵溶液与乙酸药品按质量比95∶5配置混合溶液;样品3为硝酸铵溶液与尿素药品按质量比95∶5配置混合溶液。样品试剂配制完成后迅速加入仪器反应腔。
1.2.2 热分解性测试
将配置好的试验样本加入同步热分析仪(SDT Q600)仪器中,试验并收集数据。为排除其他因素对试验的干扰,设定升温速率为10℃/min、气体流量为20 mL/min、气体氛围为空气。设置5组热分解试验,试验样品质量均为10.56 mg,样品4为纯硝酸铵固体;样品5为质量比为98∶2的硝酸铵-乙酸固体混合物;样品6为质量比为95∶5的硝酸铵-乙酸固体混合物;样品7为质量比为98∶2的硝酸铵-尿素固体混合物;样品8为质量比为95∶5的硝酸铵-尿素固体混合物,样品配置完成后立即加入仪器反应区。
2 结果与讨论
2.1 有机杂质对硝酸铵火灾危险性影响
采用OLT420仪器测试有机杂质对硝酸铵液体火灾危险性影响,测试结果如图1所示。且由图1可知,样品2、3的压力上升时间分别为3.7 s和4.2 s,反应最大压力分别为2 869.8 kPa和2 649.2 kPa。与样品1的曲线对比可知,乙酸能加快反应速率,而尿素会减慢反应速率。相较于85%硝酸铵溶液,加入乙酸后,压力上升时间缩短了0.16 s,而加入尿素后,压力上升时间增加了1.2 s。根据液体溶液火灾危险性评估标准,说明尿素对85%硝酸铵溶液的火灾危险性有明显的抑制作用。
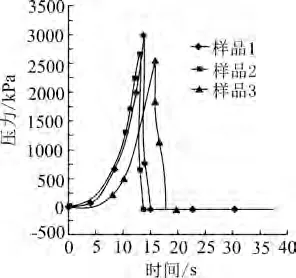
图1 3种样品溶液P-T曲线对比
2.2 纯硝酸铵以及混入杂质的硝酸铵混合物热分解研究
图2为样品4纯硝酸铵TG-DTG热分解曲线,图3为其热分解过程热流随温度变化的DSC曲线和其对应的一阶导数DDSC曲线。
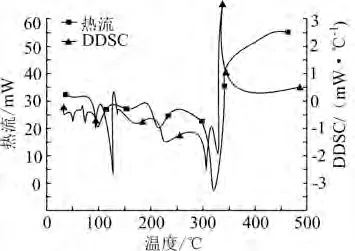
图3 纯硝酸铵热分解的DSC、DDSC曲线
从图2可以看出,纯硝酸铵在空气氛围下失重一个台阶,起始分解温度Ti为230℃,终止温度Tf为313℃。根据DTG曲线可知,在165℃时,硝酸铵开始出现质量损失,但失重速率十分缓慢,230℃之后,失重速率迅速增加,并在294℃时达到峰值,整个过程质量损失率为95%。由DSC曲线可知,硝酸铵热分解过程一共出现5个吸热峰。结合TG曲线图可知,前4个吸热峰发生时,硝酸铵仅发生晶型结构和形态的转变。最后一个吸热峰峰值发生在250℃之后,此时硝酸铵发生热分解,分解初始温度为274℃,达到热流峰值温度为305℃,终止温度为339℃,通过对曲线进行积分运算可知反应焓变为725.2 J/g。
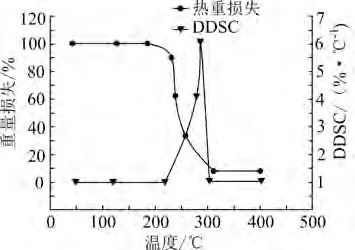
图2 纯硝酸铵热分解的TG、DTG曲线
对于混入不同含量的乙酸杂质的硝酸铵混合物的热分解试验,测试结果如图4—图5所示。

图4 加入乙酸的硝酸铵混合物DSC曲线

图5 加入乙酸的硝酸铵混合物DDSC曲线
从DSC曲线上能明显看出,不同浓度的乙酸对硝酸铵晶体转变峰和熔融峰的相变温度几乎无影响。但随着乙酸浓度的增加,会使热流曲线向着低温方向偏移。由DDSC曲线可知,加入乙酸后曲线波动较大,说明乙酸能加速硝酸铵的热分解,引起两者之间的热流补偿,故DSC能捕捉到放热信号。随后放热峰的峰值降低,并在其后转变为吸热峰,此时体系放热量减小,硝酸铵热分解过程放热和吸热有一定的抵消,所以仍然测出了吸热峰。
当在硝酸铵中混入乙酸时,其具体催化机理如下:
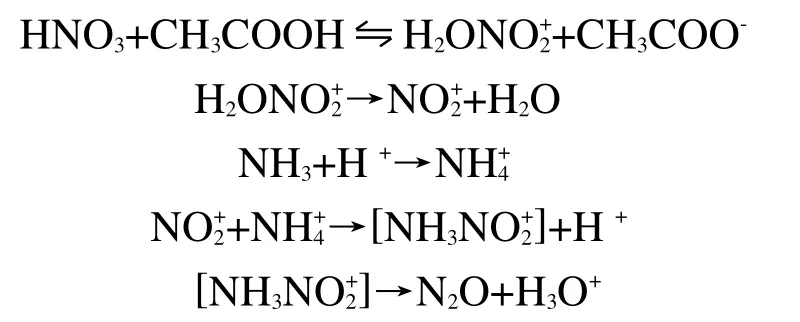
添加乙酸的硝酸铵在分解过程中,形成中间产物[NH4NO]。热解速率加快是由于H+的介入促使反应生成了中间产物[NH4NO],加速反应正向进行,从而加快硝酸铵的热分解过程。
图6—图7分别为混入不同含量尿素的硝酸铵混合物样品的TG、DSC曲线。由图6可知,两种样品的TG曲线显示都只有一个失重台阶,与纯硝酸铵TG曲线相比,硝酸铵-尿素混合物曲线整体向高温方向偏移,且偏移程度随着尿素含量的增加而增加。由图7可知,硝酸铵与尿素混合样品在整个升温过程出现了4个吸热峰,与纯硝酸铵的DSC曲线比较接近。表1为两种不同浓度尿素的硝酸铵混合物以及纯硝酸铵的DSC试验特征参数。
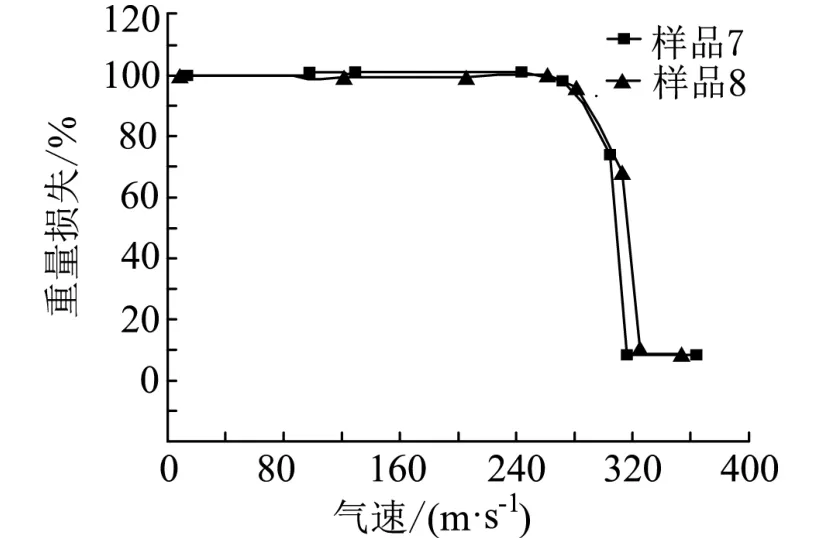
图6 加入尿素的混合物TG曲线
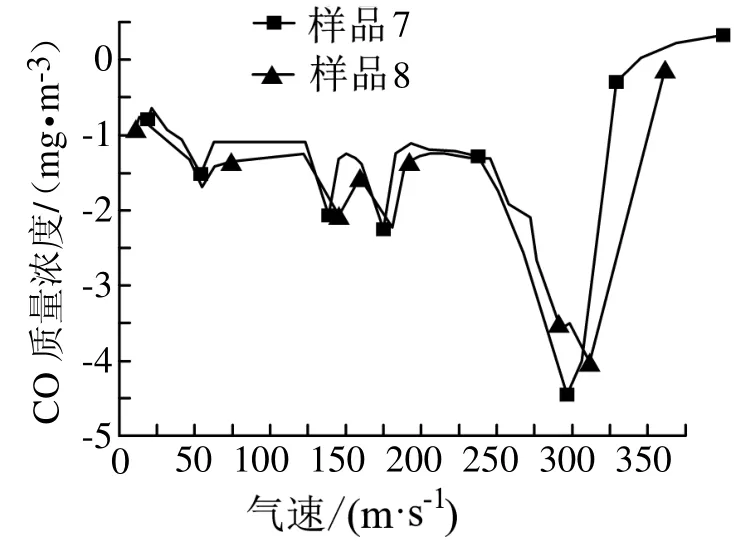
图7 加入尿素的混合物DSC曲线
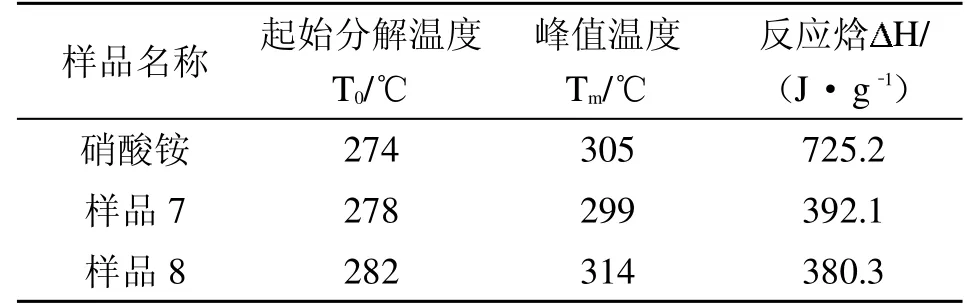
表1 不同浓度硝酸铵-尿素混合物与纯硝酸铵的DSC特征参数
尿素(CH4N2O)作为一种选择性还原剂(SCR),例如与NOx反应,将其还原成氮气(N2)和水(H2O)。尿素在受热时也会发生热分解,分解产物为氨气(NH3)和异氰酸(HNCO),反应方程式如下:
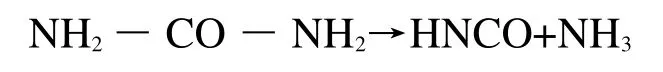
HNCO会进一步与水反应生成氨气(NH3)和二氧化碳(CO2),反应方程式如下:
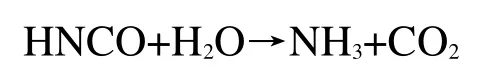
上述试验表明,尿素对硝酸铵的热分解起到一定抑制作用,主要是由于尿素热分解产生的NH3能使硝酸铵分解反应逆向进行,此外NO2作为反应中间体,而NH3能与NO2反应生成NO、N2O和N2,通过消耗体系内NO2含量来对硝酸铵的热分解起到抑制作用,具体反应方程式如下:

2.3 基于Semenov模型的热分解分析
以上均为特定条件下硝酸铵的热分解试验,而对于硝酸铵在实际生产、运输、储存等过程中的热危险性需要进一步研究,故通过自加热分解温度(SADT)的热危险性表征参数[5],理论结合试验,使结果更具参考价值。
在Semenov模型下,反应体系的热平衡方程为:
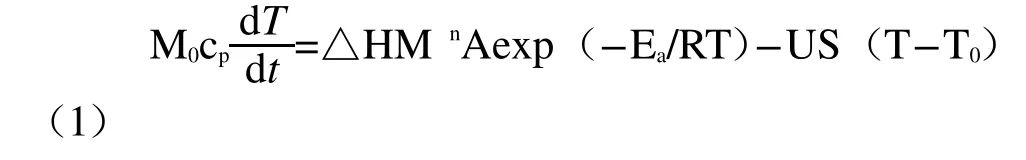
根据相关理论可知,当体系反应放热速率曲线与体系向环境的散热曲线有且仅有一个交点时,此时环境温度即为所要求的SADT,此时有:

将式(2)、式(3)带入式(1)中整理可得:

式中,TNR为不归还温度。
综合试验数据并代入公式求出活化能Ea和指前因子A,再将结果带入式(4)计算得到SADT值。表2为基于Semenov模型计算25 kg标准包装硝酸铵及其与不同有机添加剂混合物的相关动力学参数以及SADT数值,其中包装面积S=0.481 2 m2,表面导热系数U=2.839 J/(m2·K·s)。
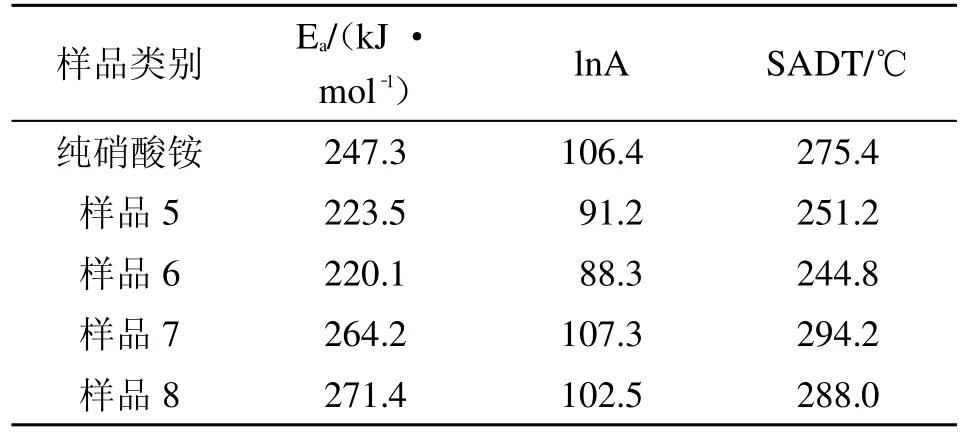
表2 硝酸铵及其混合物的SADT值
对比表中数据可知:指前因子A越大,反应物每碰撞一次发生反应的概率越高,体系越不稳定,但推算的结果却大相径庭,说明相较于指前因子A,活化能Ea对硝酸铵的SADT影响更大。从动力学角度解释为乙酸能降低硝酸铵反应时所需反应活化能,从而增加硝酸铵热危险性,而尿素能提高其反应时的反应活化能,从而增加其稳定性。
3 结论
1)液体氧化性试验表明:硝酸铵溶液的压力上升时间以及反应峰值压力与其浓度呈正相关;与85%硝酸铵溶液相比,混入乙酸会增大其火灾危险性,混入尿素则会降低其火灾危险性。
2)乙酸通过降低硝酸铵热分解过程的特征温度来增加其热危险性,而尿素会使硝酸铵热分解时间增长。两种有机杂质对硝酸铵热分解影响的机理都是通过影响硝酸铵热分解反应速率,从而影响硝酸铵的热稳定性。
3)通过对硝酸铵及杂质混合物的热动力学参数计算,并基于Semenov模型对SADT进行推算,与纯硝酸铵试验对比,乙酸的加入能降低硝酸铵的反应活化能从而降低其热稳定性,而尿素会提高硝酸铵反应活化能。
4)在进行理论推算的过程中,由于试验得出的数据均为毫克级别,且缺少对其爆炸危险性的研究分析,后续可采用精密度更高的仪器开展试验以降低误差,针对硝酸铵爆炸危险性进行试验补充。
