燕麦品种间脂肪酶活性差异及低脂肪酶优质品种的预测
2022-12-01相玉婷王晓龙胡新中任长忠郭来春李璐
相玉婷,王晓龙,胡新中,任长忠,郭来春,李璐
燕麦品种间脂肪酶活性差异及低脂肪酶优质品种的预测
相玉婷1,王晓龙1,胡新中1,任长忠2,郭来春2,李璐3
1陕西师范大学食品工程与营养科学学院,西安 710119;2吉林省白城市农业科学院/国家燕麦荞麦产业技术研发中心,吉林白城 137000;3桂林西麦食品股份有限公司,广西桂林 541004
【目的】探究不同品种间燕麦脂肪酶活性的差异机制,分析影响燕麦脂肪酶活性的内在因素,为筛选低脂肪酶优质品种提供理论依据。【方法】选取3个燕麦主产地的6个主栽品种为研究对象,测定其脂肪酶活性、营养指标、物理性状及农艺指标。通过相关性分析筛选与燕麦脂肪酶密切相关的指标,通过聚类分析将多个燕麦样品按脂肪酶活性分类,通过主成分分析将具有相关性的数据组转化为便于统计分析的综合变量,考察燕麦品种间的脂肪酶活性差异;结合灰色关联度与多元逐步回归的分析方法,得出各品种与理想品种的关联度,并以脂肪酶活性为因变量,拟合得出脂肪酶活性预测模型,筛选低脂肪酶活性优质品种。【结果】脂肪酶活性与粗脂肪含量呈显著正相关(=0.32,<0.05),且脂肪含量、不饱和脂肪酸含量、脂肪酶活性、酸值4个指标的变化趋势一致;脂肪酶活性与粗蛋白含量呈极显著正相关(=0.46,<0.01),且脂肪酶活性越高的品种,其位于31—43 kD的电泳条带所占百分比越大;脂肪酶活性与籽粒容重呈极显著负相关(=-0.71,<0.01);脂肪酶活性与生育期呈极显著正相关(=0.37,<0.01);经灰色关联度分析知白燕18号、迪燕1号与理想品种0关联度较高,分别为0.951和0.883,属于低脂肪酶且高营养品种;经多元逐步回归,仅保留影响显著的容重与蛋白质含量作为自变量,建立脂肪酶活性预测模型(脂肪酶活性)=720.274-2.255×容重(g·L-1)+75.761×蛋白质含量(%),<0.01,2为0.658。【结论】不同品种间燕麦脂肪酶活性差异明显,脂肪含量、蛋白质含量、容重、生育期是燕麦脂肪酶活性的主要影响因素,灰色关联法和逐步回归分析相结合建立的优质品种筛选与脂肪酶活性预测模型,可以有效地对燕麦品种进行综合评价,并优选出低脂肪酶活性品种。
燕麦品种;种植区域;脂肪酶活性;相关性分析;预测模型
0 引言
【研究意义】燕麦(L)分为皮燕麦和裸燕麦,裸燕麦(俗称莜麦)是中国华北、西北、西南等海拔较高的冷凉地区特色作物[1],富含蛋白质、脂肪、膳食纤维等营养物质[2],作为非油料作物,裸燕麦脂肪平均含量可达6.3%,且不饱和脂肪酸含量占80%以上[3-4],一方面给消费者带来一定的软化血管、降低胆固醇的健康功能;另一面是在燕麦籽粒贮藏或加工过程中极易被内源脂肪酶水解产生游离脂肪酸,导致产品营养损失、风味劣变[3]。因此,如何控制脂肪酶活性成为制约燕麦产品加工的重要问题。脂肪酶活性受基因型、环境型及互作,以及贮藏条件、加工共同影响[3],筛选原料是控制产品脂肪酶活性的关键步骤。因此,从原料筛选的角度出发,首先选择低脂肪酶活性的燕麦原料,其次配合适当的灭酶技术,不仅可以提高灭酶效率、减少能源损耗,还有助于保留营养物质、提升产品风味,稳定产品货架期与质量。【前人研究进展】燕麦的脂肪酶分子量约为40 kD[5],在弱碱性(pH=7.5左右)环境中活性最强,其与丝氨酸蛋白水解酶的作用机理相同,具有特殊的三元体活性中心和α螺旋盖子结构,但因植物脂肪酶的提取和纯化较为困难,燕麦脂肪酶的三维结构仍未有报道[6]。与其他谷物相比,燕麦具有较高的脂肪酶活性(以释放的油酸量表示脂肪酶活性(mg·g-1)),玉米为4—5,小麦为2—4.5,糙米为11—13,燕麦为20—23,稻谷麸皮为20—30[7]。裸燕麦因其种植区域范围广(华北、西北、西南),各区域栽培品种多,导致不同品种间差异大[8]。其中,基因型差异包括各品种的营养、物理、农艺指标,脂肪酶本质是蛋白质,籽粒越大的燕麦品种,脂肪酶活性越低[3]。燕麦脂肪酶主要分布在籽粒皮层,在种子萌发和生长过程中大量合成,分解内源脂肪,为种子生长提供能量[6, 9]。环境型差异包括种植区域的气象、地理环境等因素,海拔、经纬度、气温、降雨量都会显著影响植株的生长情况与物质积累[8],脂肪酶水解产物的氢过氧化物作为与燕麦植株抗逆性相关的过氧化物酶、过氧化酶[3]的部分底物,有助于燕麦生长于高寒地域。贮藏过程中,温度、湿度、氧气等因素都会影响脂肪酶活性,阴凉、干燥、密封的环境可以有效延长燕麦的保存时间[3]。加工过程中,如果灭酶温度不够、时间不够,脂肪酶会出现假死现象,短暂休眠后又恢复活性[3],导致脂肪快速分解,产生哈败味、苦味等异味,严重影响产品口感和品质。【本研究切入点】原料筛选与灭酶工艺都是影响燕麦产品货架期的重要因素,在实际生产中为了有效延长燕麦及其产品货架期,通常采用烘烤、蒸汽、微波、红外等灭酶工艺[10-12]来稳定产品质量,但长时间的高温灭酶处理不仅耗能高,还会造成燕麦营养物质的损失(蛋白变质、β-葡聚糖分解)[13-14]。另外,新型燕麦产品(燕麦乳、燕麦酸奶、烘烤燕麦)的出现对优质原料与新型加工技术提出了更高要求,决定了选育出低脂肪酶活性优质燕麦品种的必要性。研究表明,裸燕麦品种的脂肪酶变异系数高达35%[15],但如何影响的内在机制尚未可知。环境型及基因环境互作对燕麦脂肪酶的影响因素多且复杂,研究难度较大。【拟解决的关键问题】本研究选取国内3个燕麦主产区的6个主栽品种,通过比较燕麦品种间的指标差异及关联,分析基因型对脂肪酶活性的影响及原因,建立脂肪酶活性预测模型,为快速筛选低脂肪酶燕麦品种提供理论依据。
1 材料与方法
1.1 试验田地点及供试材料
试验田地点分别位于山西朔州右玉县、甘肃定西通渭县、河北张家口张北县3个裸燕麦主产区,地理环境信息见表1。种植试验随机区组设计,每品种种植一小区(9㎡),重复3组,籽粒收获后混匀、经清理除杂后使用。供试材料为2019年分别于3个试验点收获的迪燕1号、魏都莜5号、晋燕17号、张莜9号、坝莜18号和白燕18号。
1.2 燕麦基本指标测定
参考GB 5009.3-2016直接干燥法测定水分;参考GB 5009.6-2016索氏浸提法测定粗脂肪含量;参考GB 5009.5-2016凯氏定氮法测定蛋白质含量;参考AACC 32-23.01使用K-BGLU试剂盒(爱尔兰,Megazyme公司)测定β-葡聚糖含量;参考AACC 76-13.01使用K-TSTA试剂盒(爱尔兰,Megazyme公司)测量总淀粉含量;参考GB/T 5498-2013测定容重;参考GB/T 5519-2018测定千粒重;参考GB/T 15684-2015测定酸值。
1.3 脂肪酶活性测定
参照Kwon等[16]、胡新中[17]方法测定脂肪酶活性,稍做改进。用粉碎机粉碎燕麦籽粒,过20目筛,立即用正己烷脱脂,室温重复脱脂3次,每次2 h。称量0.5 g脱脂燕麦粉,加入98 µL甘油酯(对照样品不加)、330 µL三羟甲基氨基甲烷缓冲液(0.05 mol·L-1,pH=7.5),用玻璃棒混合(玻璃棒不得混用)形成面团后立即37℃培养60 min,以100 µL HCl(1 mmol·L-1)终止酶反应。加入5 mL丙酮,沸水浴5 min,4 000 r/min离心10 min,吸取4 mL上清液,混合0.8 mL醋酸铜显色液,振荡均匀后,2 500 r/min离心10 min,取200 µL上清液于酶标板,715 nm比色。以油酸标品作标准曲线,酶活性以每小时每克样品释放油酸的µmol数表示。
1.4 燕麦油超临界CO2萃取
选取干燥燕麦籽粒经粉碎机粉碎,取30 g装入萃取釜中,参照卢丹等[18]方法,萃取压力为450 MPa,萃取温度50℃,收集燕麦油并置于-20℃保存,用于燕麦油脂肪酸组成分析。
1.5 燕麦油脂肪酸组成分析
取200 μL燕麦油样品,加入4 mL 5 mol·L-1KOH-甲醇溶液,摇匀,于70℃水浴10 min,加入5 mL 14%(w/w)的三氯化硼-甲醇溶液,沸水浴30 min,迅速冷却后加入5 mL正庚烷和氯化钠饱和溶液,充分振荡后静置分层,取上清液过0.45 µm有机相滤膜,进行气相-质谱分析,分析条件参照石珂心等[19]方法。采用NIST标准质谱数据库检索和人工图谱解析,用峰面积归一化法确定各成分的相对含量。
1.6 燕麦蛋白提取及SDS-PAGE电泳
参考刘建垒[20]方法提取蛋白,稍有改动。将燕麦脱脂粉按料液比1﹕15溶于蒸馏水中,用NaOH(1 mol·L-1)调pH至10.1,室温搅拌1.5 h,4 000 r/min离心20 min,取上清液,用HCl(1 mol·L-1)调pH至4.2,静置10 h,4 000 r/min离心15 min,取沉淀冷冻干燥后备用。电泳参照Laemmli[21]方法,采用5%的浓缩胶与12%的分离胶,称取3 mg样品溶于100 µL上样缓冲液中,沸水浴至少5 min,上样量10 µL。电泳过程中,浓缩胶部分采用80 V电压,分离胶增至120 V电压,跑至终点后用考马斯亮蓝溶液R-250对凝胶染色1 h,再使用脱色液过夜脱色至条带清晰后拍照。使用Image J软件对凝胶图片进行处理分析。
1.7 灰色关联度分析与逐步回归分析
按照对研究对象的影响确定各指标的方向构建0。对于正向指标,采取上限测度的方法,取所有数据的最大值;对于中性指标,取所有数据的平均值;对于负向指标,采取下限测度的方法,取所有数据的最小值。以0为标准,通过公式(1)对不同指标实际数值进行无量纲化处理,得到一组新数列,与0进行灰色关联度分析。

由相关分析结果选取与研究对象显著相关的指标,利用多元线性回归中的步进法进一步筛选相关指标,拟合线性关系并检验可靠性,得出预测模型,通过公式(2)计算误差,评价模型精确度。

1.8 数据处理
采用SPSS 26进行数据分析,由Origin 2020完成图像绘制。所有试验均平行测定3次。
2 结果
2.1 燕麦品质指标测定
通过对不同燕麦品种籽粒的脂肪酶活性、营养指标、物理性状及生育期进行测定(表2)。不同品种间的脂肪酶活性差异显著,按从大到小排列为张莜9号((274.90±93.47)µmol·h-1·g-1)>晋燕17号>魏都莜5号>迪燕1号>坝莜18号>白燕18号((120.74±35.01)µmol·h-1·g-1)。按变异系数排序为坝莜18号(67.40%)>晋燕17号>魏都莜5号>迪燕1号>张莜9号>白燕18号(28.82%),可见白燕18号脂肪酶活性低且更稳定,受产地影响较小。脂肪和淀粉含量无明显差异,但坝莜18号的变异系数均为最大(15.13%和6.77%);不同品种间粗蛋白含量与β-葡聚糖含量差异显著,且均为晋燕17号最高(14.99%和4.82%),张莜9号的变异系数最大(4.80%和12.26%)。不同品种的千粒重与容重均存在显著差异,其中,坝莜18号的变异系数最大(4.77%和7.98%);张莜9号的千粒重最高(26.73 g),白燕18号的千粒重最低(21.27 g);白燕18号的容重最高(768.66 g·L-1),晋燕17号的容重最低(727.19 g·L-1)。生育期在不同品种间也存在差异,其中,张莜9号生育期最长(101 d),且产地间较稳定;白燕18号生育期最短(83 d),且产地间不稳定。
2.2 聚类分析
将18个样品按脂肪酶活性进行聚类分析(图1),当欧氏距离>10时,燕麦品种可分为高脂肪酶活性与低脂肪酶活性两类;当欧氏距离介于5—10时,燕麦品种可分为高((386.98±0.24)µmol·h-1·g-1)、中((233.59±1.92)—(322.90±13.22)µmol·h-1·g-1)、低((82.68±4.53)—(185.74±13.91)µmol·h-1·g-1)活性三类,此分类可作为挑选耐贮存品种的依据。
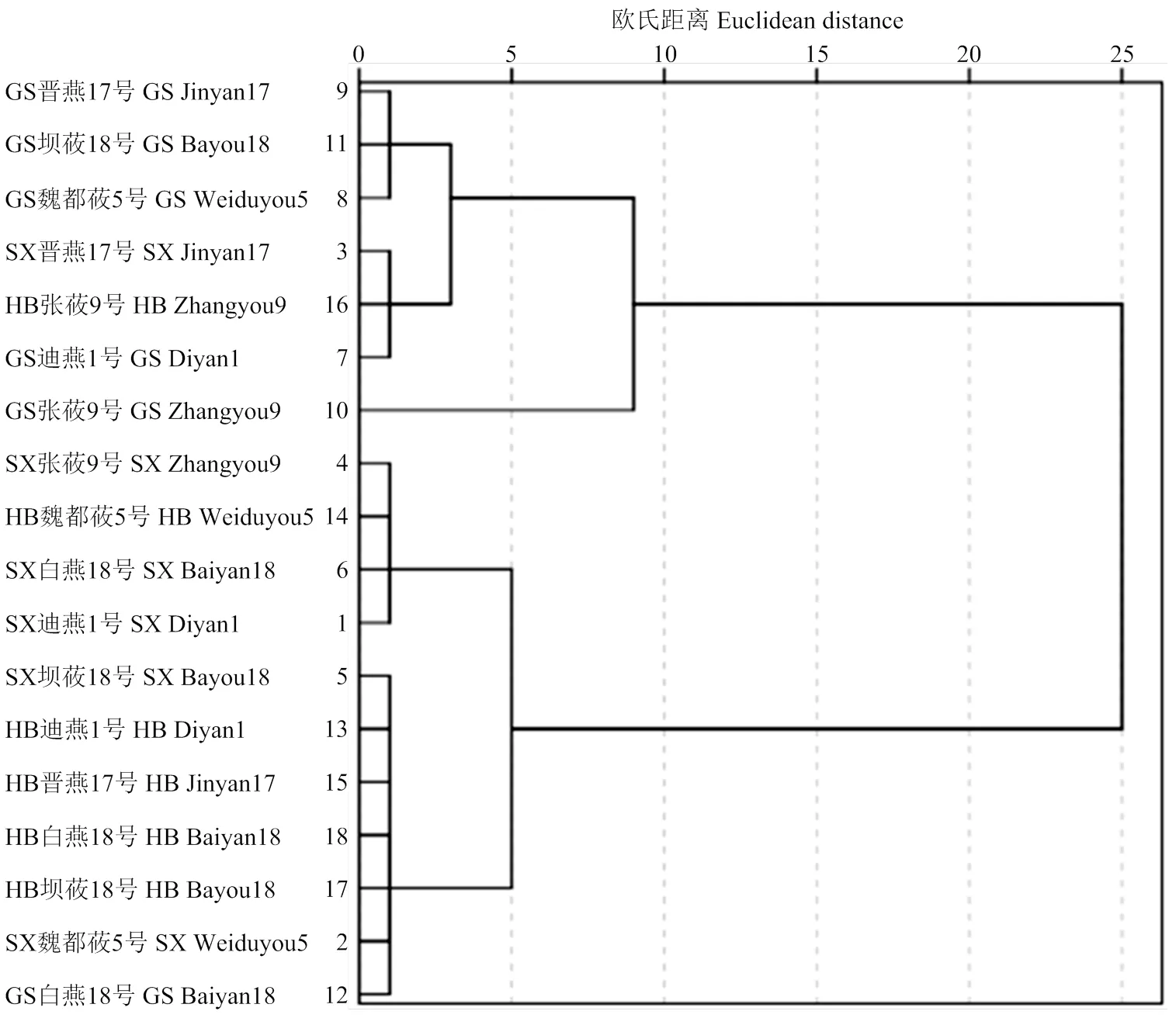
SX:山西;GS:甘肃;HB:河北。下同

表1 燕麦产地环境信息(2019年)

表2 不同品种燕麦品质指标测定结果
同列数据后不同字母表示差异在0.05水平显著。下同
Different letters after data in the same column indicate that the difference is significant at the 0.05 level. The same as below
2.3 相关性分析及探究
2.3.1 相关性分析 通过对燕麦样品脂肪酶活性、营养指标、理化性质与生育期之间进行相关性分析(图2)。脂肪酶活性与脂肪含量、蛋白质含量分别呈显著和极显著正相关(=0.32,<0.05;=0.46,<0.01),可推测燕麦脂肪酶活性与燕麦脂肪酸及燕麦蛋白质组成有关。此外,脂肪酶活性与容重呈极显著负相关(=-0.70,<0.01),容重越大,籽粒越饱满,则表面积越小,而脂肪酶主要分布在籽粒皮层,因此脂肪酶活性也相对减小。脂肪酶与生育期(=0.37,<0.01)呈极显著正相关,这与生长时间越长,籽粒物质积累越多有关。
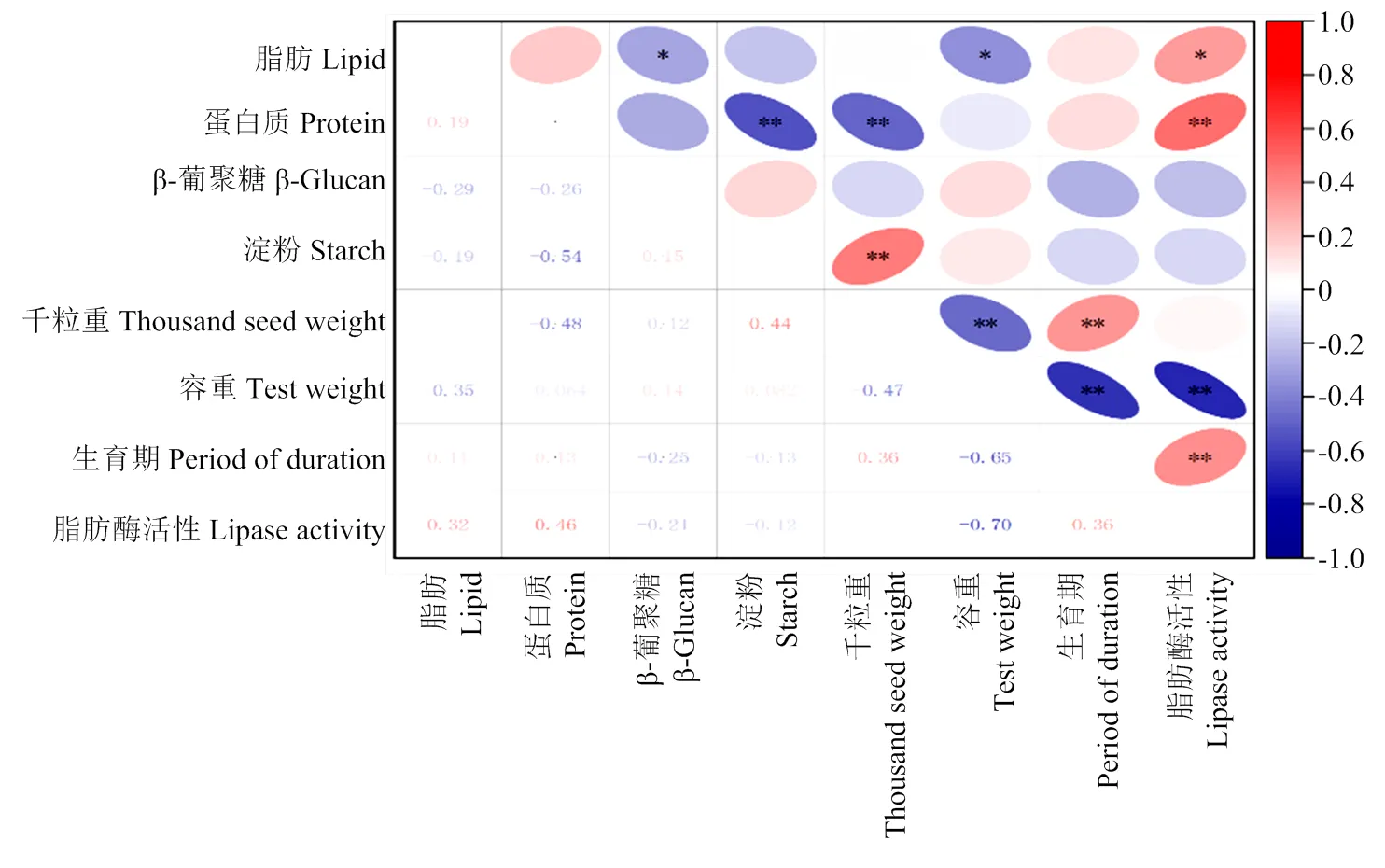
* P<0.05,** P<0.01。左下部分数字为相关系数,右上部分图形代表相关性强弱(红色为正相关,蓝色为负相关)。下同
2.3.2 燕麦品种脂肪含量及其性质指标分析 通过对3个产地6个品种燕麦的脂肪含量及性质指标进行测定(表3)。在3个产地间,脂肪含量、酸值和脂肪酶活性皆为甘肃通渭最高(6.56%、51.75 mg KOH/ 100 g和279.95 µmol·h-1·g-1),山西右玉居中(6.45%、47.18 mg KOH/100 g和166.26 µmol·h-1·g-1),河北张北最低(6.34%、42.52 mg KOH/100 g和130.84 µmol·h-1·g-1)。同一品种燕麦在不同地区的脂肪含量存在显著差异,如山西右玉的坝莜18号(5.65%)与甘肃通渭的坝莜18号(8.01%);同一地区不同品种的脂肪含量也存在显著差异,如甘肃通渭的坝莜18号(8.01%)与甘肃通渭的张莜9号(5.86%),可见燕麦的基因型与环境型对其品质都有很大影响。不同品种燕麦的不饱和脂肪酸含量相差不大,均在78%左右,甘肃通渭白燕18号最低(77.53%),河北张北的魏都莜5号最高(78.96%)。酸值和脂肪酶活性在不同品种间有显著差异,河北张北的白燕18号酸值与脂肪酶活性都为最低(36.02 mg KOH/100 g和82.58 µmol·h-1·g-1);甘肃通渭坝莜18号的酸值(61.14 mg KOH/100 g)最高;同地张莜9号的脂肪酶活性最高(386.98 µmol·h-1·g-1)。
图3相关性分析可知,不同燕麦品种的不饱和脂肪酸含量与脂肪含量(=0.51,<0.01)、脂肪酶活性(=0.35,<0.01)、酸值(=0.54,<0.01)均呈极显著正相关。说明燕麦籽粒中不饱和脂肪酸含量越多,脂肪含量与脂肪酶活性越高,越易发生酸败。酸值与脂肪含量(=0.62,<0.01)、脂肪酶活性(=0.88,<0.01)均呈极显著正相关,说明酸值、脂肪含量、脂肪酶活性的变化趋势相同。脂肪酸组成是脂肪直接相关的指标,酸值是与脂肪酶活性密切相关的指标,这些指标间均具有同向性,可验证脂肪酶活性与脂肪含量呈正相关关系。
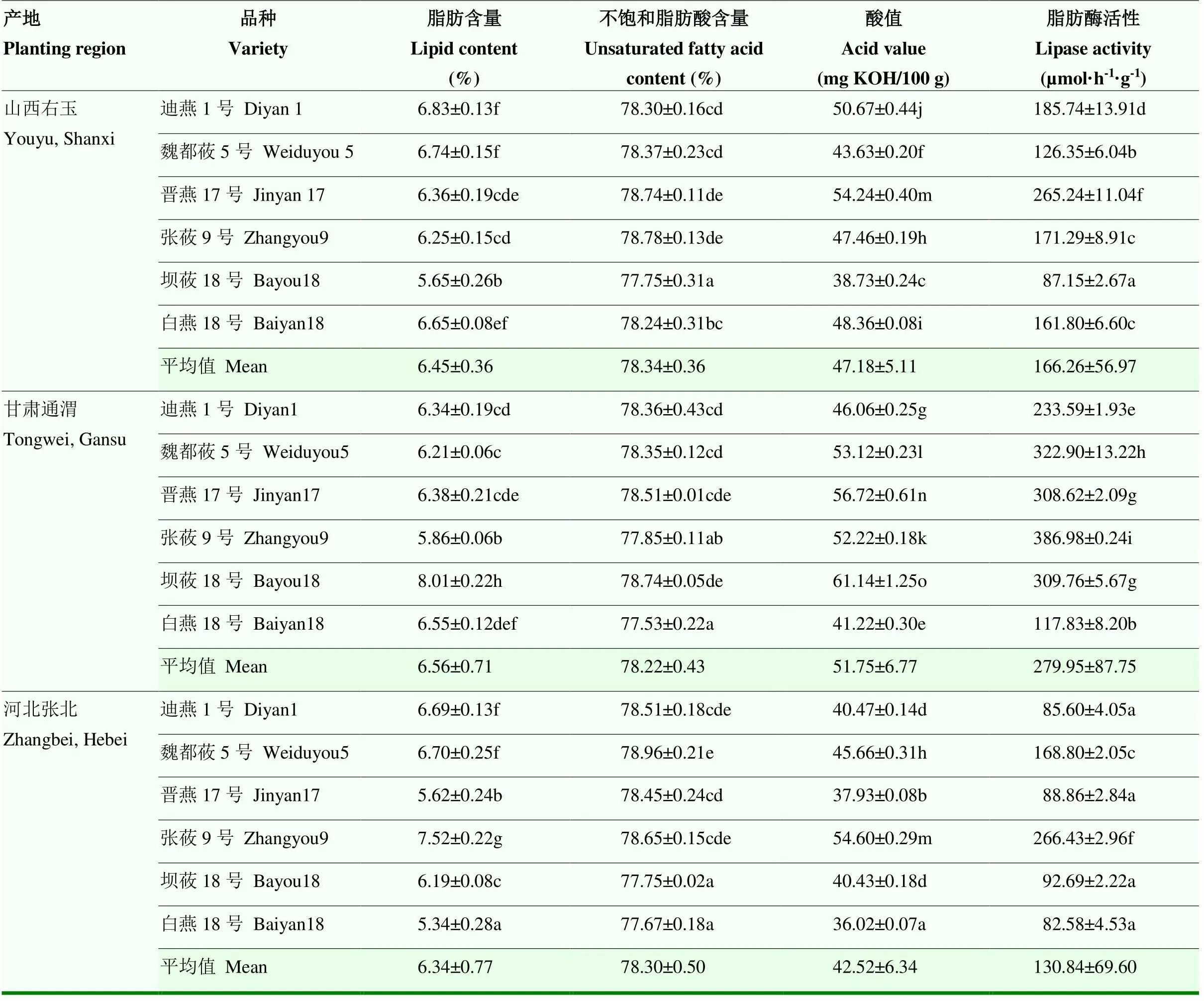
表3 燕麦品种脂肪含量及其性质指标

图3 不同燕麦品种脂肪有关指标相关性分析结果
2.3.3 燕麦蛋白SDS-PAGE电泳分析 通过对不同品种的燕麦蛋白进行SDS-PAGE电泳(图4),不同样品间在蛋白组成上无明显差异,条带种类基本一致。种子蛋白质可以按溶解性分为球蛋白、清蛋白、谷蛋白、醇溶蛋白四大类,其中,球蛋白与醇溶蛋白是燕麦籽粒中的主要蛋白质。如图4所示,燕麦蛋白主要集中在两区域,一部分在22.0 kD附近,另一部分于31.0—43.0 kD。经ImageJ软件对电泳图谱数字化分析,在上样量相同时,甘肃通渭地区泳道总灰度值明显大于山西右玉、河北张北两地,说明甘肃通渭地区燕麦蛋白含量最高,与上文结果一致。31—43 kD特定区间条带的灰度值(GV1)随相应泳道总灰度值(GV2)的增加而增加,说明此区间蛋白含量随燕麦总蛋白含量增高而增高,与相关性分析结果具有一致性。如图4所示,甘肃通渭张莜9号最大,为21.08%;山西右玉坝莜18号最小,为17.56%。计算各品种GV1/GV2在三产地间的平均值,从大到小排列为张莜9号(20.67%)>晋燕17号(20.47%)>魏都莜5号(19.32%)>白燕18号(19.05%)>坝莜18号(18.69%)>迪燕1号(18.50%)。GV1占比越大的品种含有的脂肪酶含量较多,与表2对照,基本符合GV1占比越大,脂肪酶活性越高的规律,这与酶浓度越高、催化活性越强的常理相符。

GV2为每泳道总灰度值;GV1为31—43 kD区间灰度值;A:山西;B:甘肃;C:河北;1:张莜9号,2:魏都莜5号,3:坝莜18号,4:白燕18号;5:晋燕17号;6:迪燕1号
2.4 主成分分析
为了更充分地表达燕麦耐贮性与相关指标之间的关系,对6个品种的脂肪酶活、营养、物理、农艺指标进行主成分分析(图5)。PC1和PC2的贡献率分别为34.0%和26.2%,累计贡献率为60.2%,可以概括大部分信息[22]。由图5可知,蛋白、脂肪与脂肪酶之间的夹角小于90°,说明其存在正相关关系,与上文相关性分析一致。综合18个样品点来看,不同样品差异较大,其中,张莜9号脂肪酶活性较高,但在不同产地间不稳定,白燕18号脂肪酶活性最低,且在不同产地间稳定性较高。
2.5 优质品种筛选及回归预测
2.5.1 灰色关联度分析 参考试验中6个品种燕麦样品各指标的实际测量值,区分正向、负向及中性指标[23],选取各指标中的最优值,构造出理想品种0(表4)。蛋白、脂肪、淀粉、β-葡聚糖、容重及千粒重皆为正向指标,选取各指标下的最大值构造0;生育期为中性指标,计算所有数据的平均值构造0;脂肪酶活性为负向指标,选取最小值构建0。可见理想燕麦品种即为营养含量高(蛋白14.99%,脂肪6.68%,淀粉61.59%,β-葡聚糖4.82%)、籽粒饱满(容重768.66 g·L-1,千粒重27.11 g)、脂肪酶活性低(120.77 µmol·h-1·g-1)的中熟(生育期94 d)品种。
经灰色关联度分析,6个燕麦品种与理想品种0的关联情况如表5所示。白燕18号与理想品种关联度最高(0.951),说明此品种营养品质高,且脂肪酶活性低,是理想的耐贮藏优质品种。其次为迪燕1号(0.883)、坝莜18号(0.878)、魏都莜5号(0.844)、晋燕17号(0.832)、张莜9号(0.814)。

D1:迪燕1号;W5:魏都莜5号;J17:晋燕17号;Z9:张莜9号;Ba18:坝莜18号;B18:白燕18号。相同颜色点代表相同品种燕麦

表4 灰色关联度X0取值情况

表5 燕麦品种与理想品种的关联系数及关联度
2.5.2 逐步回归模型建立及验证 由相关性分析已知,蛋白质含量、脂肪含量、籽粒容重及生育期与燕麦脂肪酶活性具有显著相关性,进一步利用逐步回归法对其进行定量模型拟合,以蛋白质含量、脂肪含量、籽粒容重、生育期为自变量,脂肪酶活性为因变量进行多元线性逐步回归分析(表6),经数据处理后,仅保留影响显著的容重与蛋白质含量作为自变量,建立模型为(脂肪酶活性)=720.274-2.255×容重(g·L-1)+75.761×蛋白质含量(%),<0.01,2为0.658,说明容重与蛋白两变量可以共同解释脂肪酶活性65.8%的变量。将6个燕麦品种的实际容重与蛋白质含量代入进行验证(表7),模型预测结果排序与实际相差不大,预测值与实际值误差最高为24.74%(坝莜18号),最低为1.64%(魏都莜5号),由灰色关联度法筛选出的优质品种白燕18号(误差9.15%)、迪燕1号(误差12.41%)的预测结果都较为准确,此模型可作为低脂肪酶品种快速筛选的依据。

表6 逐步回归分析结果

表7 回归模型验证
3 讨论
3.1 燕麦脂肪酶活性相关因素分析
燕麦脂肪酶与脂肪含量呈显著正相关关系。燕麦货架期缩短的首要原因是脂肪劣变,脂肪被脂肪酶水解产生脂肪酸和甘油,不饱和脂肪酸又极易被氧化为氢过氧化物和羰基化合物,产生不良风味,因此,燕麦产品的稳定性与其脂肪酸组成密切相关。燕麦油中饱和脂肪酸﹕单不饱和脂肪酸﹕多不饱和脂肪酸=0.5﹕1﹕1,与目前市场上营养调和油的0.7﹕1﹕1的脂肪酸比例相近[3]。由燕麦脂肪酸组成分析可知,油酸与亚油酸是燕麦油脂中的主要成分,其比例约为1﹕1,总量约占总油脂的80%,且脂肪含量越高的燕麦品种,不饱和脂肪酸相对含量越高。戚向阳等[4]研究也表明,燕麦油脂的含量与硬脂酸和油酸含量呈正相关,与棕榈酸、亚油酸和亚麻酸含量呈负相关。酸值是反应燕麦油脂变质的直接指标,脂肪酶活性越高的品种,酸值越高,即变质速度越快,与李诗炜[24]研究结果一致。酸值变化还与燕麦脂肪含量呈正相关,这是由于在酶促反应中,可消耗的底物越多,反应速率越快。正在制定的中国好粮油(燕麦及其制品)行业标准中要求,燕麦粉的酸值以不超过90 mg KOH/100 g为达标,说明所取燕麦样品是新鲜未变质的,具有可参考性。
燕麦脂肪酶与蛋白质含量呈显著正相关关系。燕麦中球蛋白占主要地位,含量高于55%[3],分子量分布范围为30—40 kD和50—60 kD,燕麦醇溶蛋白分子量为23.5和15.5 kD[25]。对从燕麦麸中提取的蛋白电泳条带进行分析,37.0 kD与22.0 kD处条带最明显,与本文结果相一致,其为球蛋白的酸性亚基与碱性亚基[26-27]。清蛋白是水溶性蛋白,分子量分布于14—17 kD、20—27 kD及36—47 kD,生物活性蛋白大多集中于此,如脂肪酶、蛋白酶、α-淀粉酶等[28]。Jung等[5]从燕麦中提取并纯化出分子量为40 kD的脂肪酶,Yu等[29]从米糠中提取出约34 kD的2种脂肪酶,不同脂肪酶的结构虽不完全相同,但分子量差异不大。结合所用预染蛋白质标记,选定31—43 kD为燕麦脂肪酶目标区间,为避免加样量差异等无关因素对条带灰度值的影响,计算各泳道GV1占GV2的百分比来表示目标区域蛋白的相对含量,要知道燕麦脂肪酶具体分子量,还需进行后续提取纯化研究。
容重和千粒重是评价燕麦籽粒质量的2个重要指标。其中,容重可以评价籽粒结构的饱满度、成熟度及结构紧密度,一般情况下成熟饱满、结构紧密、形状圆短的籽粒容重大[30]。千粒重则是体现籽粒大小和饱满程度的指标,也是预测产量时的重要依据。已有研究表明,脂肪酶主要分布于籽粒的皮层和糊粉层[27],较大的籽粒比表面较小,则脂肪酶活性越低[17]。本文由相关性分析可知,不同品种间,容重越大的籽粒,脂肪酶活性越低,容重往往和千粒重及籽粒大小呈负相关[30],即籽粒短、小、圆的品种,脂肪酶活性越低。
研究表明,燕麦脂肪酶是参与种子生长代谢的重要酶,在发芽过程中活力较高[9, 31],因此,在燕麦生长发育过程中的各种外界因素都会对种子的内源酶及营养物质的积累产生影响,因此,脂肪酶活性还与品种生育期有一定的关系,甘肃通渭地区品种属于北方中晚熟型,生育期稍长,山西右玉、河北张北地区属于华北早熟型,生育期较短,可以推测早熟型燕麦的脂肪酶活性要低于晚熟型。此外,本研究中所选取的3个产地皆为北方产区,分别为华北产区(山西右玉、河北张北)和西北产区(甘肃通渭),因此,想要进一步寻找地区间的脂肪酶差异规律需收集更大范围的样品。
3.2 低脂肪酶活性燕麦籽粒的筛选
中国野生燕麦资源丰富,截至2013年,中国国家种子库已收集燕麦种质资源3 000余份,目前已选育出120余个燕麦品种[32],因此,在众多燕麦品种中综合产量因素、营养因素及加工需求综合筛选出适合加工的品种是非常必要的。
对于燕麦品种,就籽粒形态而言,燕麦籽粒越大,脂肪酶活性越低[33]。裸燕麦品种植株上的籽粒不止一个,籽粒在植株中的位置也决定了籽粒大小,燕麦穗上主籽粒大小大于次籽粒和第三、第四籽粒。选择植株上籽粒数量越少的裸燕麦品种,籽粒会相对较大,或者选择主籽粒,脂肪酶活性相对会越低[17]。相同品种中,大籽粒的脂肪酶活性约是正常籽粒的80%,小籽粒的脂肪酶活性约是正常籽粒的1.2倍[3]。千粒重是表征籽粒形态的核心指标,裸燕麦和皮燕麦按千粒重可分别划分为大(≥26 g,≥28 g)、中(19—26 g,21—28 g)、小(≤19 g,≤21 g)三级,较小籽粒品种如,张北大莜麦(16.2 g)[32]、张家口丰宁大滩(13.4 g)[32]、张家口草莜1号(18.84 g)[33]、张家口蒙燕833-1(18.49 g)[33]、国外裸燕麦品种VAO-3[34]等。籽粒千粒重大小也会影响到容重大小,燕麦籽粒性状有细长型、粗短型和卵圆型,粗短型和卵圆型品种的容重略高于细长型品种。由籽粒大小筛选低脂肪酶活性品种时,不能仅考虑籽粒大小,还应考虑籽粒形状,在考虑圆形燕麦籽粒的基础上,尽可能选择容重大的品种。
燕麦的蛋白质含量(11.3%—19.9%)在谷类作物中居于首位,且氨基酸组成在谷物中最为平衡。与大豆蛋白相似,燕麦蛋白中球蛋白(60%—70%)最多,具有乳化性强及低致敏的优点,因此,高含量的燕麦蛋白有望成为植物蛋白素肉产业中新的蛋白来源[35]。皮燕麦的脂肪含量低于裸燕麦,脂肪酶活性也低于裸燕麦,国外燕麦片加工企业一般都选用皮燕麦进行加工[3];中国燕麦粉加工一般采取三熟工艺,脂肪含量高能够给燕麦面制品带来特殊的风味,这些特殊风味受到裸燕麦种植区域消费者喜欢,因此,脂肪含量高并不一定是燕麦产品加工的短板,应该根据产品特色采取有效的脂肪酶抑制措施,延长货架期。燕麦β-葡聚糖含量一直是燕麦品质育种的首选指标,但β-葡聚糖含量与燕麦产量没有必然关系。在筛选优质品种时,在蛋白含量高、脂肪含量高的前提下,尽量保证β-葡聚糖含量也处于较高水平,使得脂肪酶活性、营养品质达到较好平衡。
燕麦脂肪酶本质为活性蛋白质,产地不同会造成不同品种之间燕麦蛋白含量的差异[36-37]。本研究选取了3个产地,旨在尽量消除产地不同对脂肪酶活性的影响,从而更准确地寻找品种间的脂肪酶活性差异。本文以灰色关联度分析法[23]与逐步回归法[38]相结合,筛选出了低脂肪酶活性的优质品种,且建立了脂肪酶活性预测模型。脂肪酶活性检测方法较为繁琐,此模型仅需知晓燕麦品种的蛋白含量与容重,即可较准确地推算其脂肪酶活性。结合聚类分析所区分的高、中、低脂肪酶活性范围,可快速判断燕麦品种的脂肪酶活性水平,为燕麦产品精深加工提供优质、适宜原料。
4 结论
不同品种间燕麦脂肪酶活性差异显著,脂肪含量、蛋白质含量、容重、生育期是影响燕麦脂肪酶活性的主要因素,合理的品种筛选可以有效提高后续灭酶效率、减少能耗。建立优质燕麦品种筛选与脂肪酶活性预测模型,可以有效地对燕麦品种进行综合评价。
[1] 任长忠, 胡跃高.中国燕麦学. 北京: 中国农业出版社, 2013.
REN C Z, HU Y G. Chinese Oatology. Beijing: China Agriculture Press, 2013. (in Chinese)
[2] 周素梅, 申瑞玲. 燕麦的营养及其加工利用. 北京: 化学工业出版社, 2009.
ZHOU S M, SHEN R L. Nutrition and processing and utilization of oats. Beijing: Chemical Industry Press, 2009. (in Chinese)
[3] 胡新中, 魏益民, 任长忠. 燕麦品质与加工. 北京: 科学出版社, 2009.
HU X Z, WEI Y M, REN C Z. Oat quality and processing. Beijing: Science Press, 2009. (in Chinese)
[4] 戚向阳, 曹少谦, 刘合生, 陈伟. 不同品种燕麦的油脂组成及与其它营养物质相关性研究. 中国食品学报, 2014, 14(5): 63-71.
Qi X Y, CAO S Q, LIU H S, CHEN W. Studies on the lipid composition of different oat varieties and its relationship with other nutrients. Journal of Chinese Institute of Food Science and Technology, 2014, 14(5): 63-71. (in Chinese)
[5] Jung H, Moon S J. Purification, distribution, and characterization activity of lipase from oat seeds (L.). Journal of the Korean Society for Applied Biological Chemistry, 2013, 56(6): 639-645.
[6] Angajala G, Pavan P, Subashini R. Lipases: An overview of its current challenges and prospective in the revolution of biocatalysis. Biocatalysis and Agricultural Biotechnology, 2016, 7: 257-270.
[7] 李兴军. 谷物及其加工品脂肪酶解的生化机制.粮食科技与经济, 2012, 37(6): 55-58.
LI X J. Enzymic degradation of lipids in cereal and their products. Grain Science and Technology and Economy, 2012, 37(6): 55-58. (in Chinese)
[8] 林伟静, 吴广枫, 李春红, 王燕, 周素梅.品种与环境对我国裸燕麦营养品质的影响. 作物学报, 2011, 37(6): 1087-1092.
LIN W J, WU G F, LI C H, WANG Y, ZHOU S M. Effects of cultivar and environment on nutritional quality of Chinese naked oats. Acta Agronomica Sinica, 2011, 37(6): 1087-1092. (in Chinese)
[9] 曹品豹. 燕麦油脂及在燕麦发芽过程中的变化和微胶囊化制备工艺[D]. 武汉: 华中农业大学, 2009.
CAO P B. Lipids of oat, their changes during germination and preparation technics of microencapsulation[D]. Wuhan: Huazhong Agricultural University, 2009. (in Chinese)
[10] Ziegler V, Ferreira C D, DA Silva J, Zavareze E D R, Dias A R G, Oliveira M D, Elias M C. Heat-moisture treatment of oat grains and its effects on lipase activity and starch properties. Starch-Stärke, 2018, 70(1/2): 1700010.
[11] Gao Y C, Wang L L, Qiu J, Bai G L, Li Z G. Effects of different lipase inactivation treatments on physicochemical properties of naked oat globulins. Cereal Chemistry, 2016, 93(3): 248-254.
[12] 胡新中, 罗勤贵, 欧阳韶晖, 郑建梅, 张国权. 裸燕麦酶活性抑制方法及品质比较. 中国粮油学报, 2006(5): 46-50.
HU X Z, LUO Q G, OUYANG S H, ZHENG J M, ZHANG G Q. Comparison of naked oat stabilizing methods and their quality effect. Journal of the Chinese Cereals and Oils Association, 2006(5): 46-50. (in Chinese)
[13] 刘婷玉, 佟立涛, 王丽丽, 周素梅, 刘丽娅. 燕麦籽粒不同灭酶方式对燕麦乳稳定性和营养物质的影响. 中国粮油学报, 2021, 36(10): 22-28.
LIU T Y, TONG L T, WANG L L, ZHOU S M, LIU L Y. Effects of different enzyme inactivating modes on the stability and nutrients of oat milk. Journal of the Chinese Cereals and Oils Association, 2021, 36(10): 22-28. (in Chinese)
[14] 甄红敏, 栾广忠, 胡新中, 张培培, 徐超, 郑建梅. 灭酶方法对燕麦淀粉和蛋白质体外消化特性的影响. 麦类作物学报, 2011, 31(3): 475-479.
ZHEN H M, LUAN G Z, HU X Z, ZHANG P P, XU C, ZHENG J M. Effects of different lipase deactivated treatments on in vitro starch and protein digestibility of oat whole meal. Journal of Triticeae Crops, 2011, 31(3): 475-479. (in Chinese)
[15] 倪香艳, 顾军强, 钟葵, 佟立涛, 刘丽娅, 周素梅.燕麦品种的品质性状及聚类分析. 中国粮油学报, 2016, 31(10): 18-24.
NI X Y, GU J Q, ZHONG K, TONG L T, LIU L Y, ZHOU S M. Quality characteristics of oat cultivars and cluster analysis. Journal of the Chinese Cereals and Oils Association, 2016, 31(10): 18-24. (in Chinese)
[16] Kwon D Y, Rhee J S. A simple and rapid colorimetric method for determination of free fatty acids for lipase assay. Journal of the American Oil Chemists’ Society, 1986, 63(1): 89-92.
[17] 胡新中. 燕麦的酶活性及其食品加工中抑制工艺研究[D]. 杨凌: 西北农林科技大学, 2007.
HU X Z. Oat enzyme activity and its deactivation for food processing [D]. Yangling: Northwest A&F University, 2007. (in Chinese)
[18] 卢丹, 张文婷, 赵武奇, 胡新中, 李小平. 超临界CO2萃取燕麦油工艺研究. 中国油脂, 2018, 43(4): 1-6.
LU D, ZHANG W T, ZHAO W Q, HU X Z, LI X P. Supercritical CO2extraction of oat oil. China Oils and Fats, 2018, 43(4): 1-6. (in Chinese)
[19] 石珂心, 赵武奇, 谷如祥, 张文婷.超临界CO2萃取樱桃仁油及GC-MS分析. 中国粮油学报, 2016, 31(1): 60-64+69.
SHI K X, ZHAO W Q, GU R X, ZHANG W T. The supercritical carbon dioxide fluid extraction of cherry kernel oil and analysis by GC-MS. Journal of the Chinese Cereals and Oils Association, 2016, 31(1): 60-64+69. (in Chinese)
[20] 刘建垒. 燕麦蛋白的提取及其亚基与功能特性研究[D]. 晋中: 山西农业大学, 2013.
LIU J L. Oat protein isolatie: extraction, protein subunits and functional properties [D]. Jinzhong: Shanxi Agricultural University, 2013. (in Chinese)
[21] Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970, 227(5259): 680-685.
[22] 王建芳, 高山, 牟德华. 基于主成分分析和聚类分析的不同品种燕麦品质评价. 食品工业科技, 2020, 41(13): 85-91.
WANG J F, GAO S, MOU D H. Quality evaluation of different varieties of oat based on principal components analysis and cluster analysis. Science and Technology of Food Industry, 2020, 41(13): 85-91. (in Chinese)
[23] 王青, 戴思兰, 何晶, 季玉山, 王朔. 灰色关联法和层次分析法在盆栽多头小菊株系选择中的应用.中国农业科学, 2012, 45(17): 3653-3660.
WANG Q, DAI S L, HE J, JI Y S, WANG S. Application of grey correlation analysis and AHP method in selection of potted Chrysanthemum. Scientia Agricultura Sinica, 2012, 45(17): 3653-3660. (in Chinese)
[24] 李诗炜. 熟化谷物粉在储藏过程中的氧化及其评价指标分析[D]. 无锡: 江南大学, 2017.
LI S W. Analysis of oxidation and evaluation indexes of instant cereal flours during storage [D]. Wuxi: Jiangnan University, 2017. (in Chinese)
[25] Mirmoghtadaie L, Kadivar M, Shahedi M. Effects of succinylation and deamidation on functional properties of oat protein isolate.Food Chemistry, 2009, 114(1): 127-131.
[26] 管骁, 姚惠源. 燕麦麸蛋白的组成及功能性质研究. 食品科学, 2006, 27(7): 72-76.
GUAN X, YAO H Y. Composition and functional properties of oat bran protein. Food Science, 2006, 27(7): 72-76. (in Chinese)
[27] Urquahart A A, Altosaar I, Matlashewski G J. Localization of lipase activity in oat grains and milled oat fractions. Cereal Chemistry, 1983, 60(2): 181-183.
[28] KUMAR L, Sehrawat R, KONG Y Z. Oat proteins: A perspective on functional properties. LWT- Food Science and Technology, 2021, 152: 112307.
[29] Yu C W, Zheng L F, Cheng M Y, Yu X Y, Wang S Y,Fan Y W, Deng Z Y. Purification, identification, characterization and catalytic mechanism of two lipases from rice bran (). LWT- Food Science and Technology, 2021, 140: 110693.
[30] 车海先, 李海玉. 玉米容重影响因素浅析. 粮食与食品工业, 2011, 18(1): 56-58+61.
CHE H X, LI H Y. Analysis of influencing factors on maize test weight. Cereal & Food Industry, 2011, 18(1): 56-58+61. (in Chinese)
[31] Peterson D M. Lipase activity and lipid metabolism during oat malting. Cereal Chemistry, 1999, 76: 159-163.
[32] 任长忠, 杨才. 中国燕麦品种志. 北京: 中国农业出版社, 2018.
REN C Z, YANG C. Oat varieties of China. Beijing: China Agriculture Press, 2018. (in Chinese)
[33] 李涵鑫, 李小平, 马蓁, 李俊俊, 胡新中, 任长忠. 燕麦籽粒特性与理化及加工品质特性的关系. 麦类作物学报, 2015, 35(4): 499-507.
LI H X, LI X P, MA Z, LI J J, HU X Z, REN C Z. Relationships between oat kernel, physicochemical and processing parameters. Journal of Triticeae Crops, 2015, 35(4): 499-507. (in Chinese)
[34] Hu X Z, Wei Y M, Ren C Z, Zhao J. Relationship between kernel size and shape and lipase activity of naked oat before and after pearling treatment. Journal of the Science of Food and Agriculture, 2009, 89(8): 1424-1427.
[35] Mel R, Malalgoda M. Oat protein as a novel protein ingredient: Structure, functionality, and factors impacting utilization. Cereal Chemistry, 2021, 99(1): 21-36.
[36] 赵春, 宁堂原, 焦念元, 韩宾, 李增嘉. 基因型与环境对小麦籽粒蛋白质和淀粉品质的影响. 应用生态学报, 2005(7): 1257-1260.
ZHAO C, NING T Y, JIAO N Y, HAN B, LI Z J. Effects of genotype and environment on protein and starch quality in wheat grain. Chinese Journal of Applied Ecology, 2005(7): 1257-1260. (in Chinese)
[37] 金欣欣, 姚艳荣, 贾秀领, 姚海坡, 申海平, 崔永增, 李谦.基因型和环境对小麦产量、品质和氮素效率的影响. 作物学报, 2019, 45(4): 635-644.
JIN X X, YAO Y R, JIA X L, YAO H P, SHEN H P, CUI Y Z, LI Q. Effects of genotype and environment on wheat yield, quality and nitrogen use efficiency. Acta Agronomica Sinica, 2019, 45(4): 635-644. (in Chinese)
[38] 武辉, 侯丽丽, 周艳飞, 范志超, 石俊毅, 阿丽艳, 肉孜, 张巨松. 不同棉花基因型幼苗耐寒性分析及其鉴定指标筛选. 中国农业科学, 2012, 45(9): 1703-1713.
WU H, HOU L L, ZHOU Y F, FAN Z C, SHI J Y, A L Y, ROU Z, ZHANG J S. Analysis of chilling-tolerance and determination of chilling-tolerance evaluation indicators in cotton of different genotypes. Scientia Agricultura Sinica, 2012, 45(9): 1703-1713. (in Chinese)
lipase activity difference of oat varieties and prediction of low lipase activity variety with high quality
Xiang Yuting1, Wang Xiaolong1, Hu Xinzhong1, Ren Changzhong2, Guo Laichun2, Li Lu3
1College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi’an 710119;2Baicheng Academy of Agricultural Sciences/China Oat and Buckwheat Research Center, Baicheng 137000, Jilin;3Guilin Seamild Foods Co., Ltd., Guilin 541004, Guangxi
【Objective】This study explored the differences and causes of oat lipase activity of different varieties. Providing a theoretical basis for screening varieties with low lipase activity and achieving stable enzyme inactivation effect of oat products. 【Method】Six main varieties of three main oat planting regions were selected for the study, and their lipase activity, nutritional indexes, physical traits, and agronomic indexes were measured. To answer the differences in lipase activity of oat varieties, the indicators significantly related to oat lipase were screened by correlation analysis. Through cluster analysis, classified multiple oat samples by lipase activity. Transform data having correlations into composite variables for statistical analysis by principal component analysis. To derive a predictive model for lipase activity, an analytical method combining gray correlation and multiple stepwise regression was used. The indicators correlating with lipase activity were used as independent variables, and the lipase activity was used as dependent variables for quantitative model fitting. 【Result】Lipase activity was significantly positively correlated with crude fat content (=0.32,<0.05), and the various trends of fat content, unsaturated fatty acid content, lipase activity, and acid value were consistent. Lipase activity was significantly positively correlated with crude protein content (=0.46,<0.01), and the higher lipase activity was, the higher percentage of electrophoretic bands located in 31-43 kD were. It was significantly negatively correlated with grain test weight (=-0.71,<0.01) and positively associated with growth period (=0.37,<0.01). Baiyan 18 and Diyan 1 had low lipase activity and high nutrition varieties according to grey relational analysis, and the relevance value with ideal variety0were 0.951 and 0.883, respectively. Stepwise regression analysis only retained the test weight and protein content as independent variables. The prediction model of lipase activity was established as=720.274-2.255×test weight (g·L-1)+75.761× protein content (%),<0.01,2=0.658.【Conclusion】The varieties had significant effects on oat lipase activity. Protein content, fat content, test weight, and growth period were the main influencing factors of oat lipase activity. Grey relational analysis combined with stepwise regression analysis could be used to comprehensively evaluate oat varieties effectively and quickly select varieties with low lipase activity.
oat varieties; planting area; lipase activity; correlation analysis; prediction model

10.3864/j.issn.0578-1752.2022.21.002
2022-06-03;
2022-08-15
国家燕麦荞麦产业技术体系(CARS-07-E1)、陕西省创新团队(2020TD-049)、陕西省谷物科学国际联合研究中心(2019GHJD-15)
相玉婷,E-mail:xyt980907@163.com。通信作者胡新中,E-mail:hxinzhong@126.com
(责任编辑 李莉)
