一种由对苯醌合成对苯二酚的工艺研究
2022-12-01潘学祥黄德奇冯守佰陈绍杰刘红红
潘学祥,王 芳,黄德奇,冯守佰,陈绍杰,刘红红
(1 扬州工业职业技术学院,江苏 扬州 225127;2 江苏扬农化工集团有限公司,江苏 扬州 225009)
对苯二酚,又名氢醌,分子式为C6H6O2,白色针状结晶,密度为1.328 g/cm3见光易变色,是苯的两个对位氢被羟基取代形成的化合物。对苯二酚常温下溶解度低,但易溶于热水,溶于乙醚无味、乙醇、乙酸乙酯等溶液,微溶于苯[1]。受高热分解易放出有毒气体[2]。对苯二酚广泛的应用于橡胶、染料、医药及农药等相关化工领域[3-4]。对苯二酚主要用于制备蒽醌染料、偶氮染料、照相机的黑白显影剂、涂料的抗氧化剂、橡胶单体的阻聚剂等。对苯二酚的合成工艺较多[5-7],包括Reppe法,苯胺法、苯酚和丙酮法等传统方法,Reppe法为乙炔与一氧化碳在高温高压下,通过贵金属Ru、Rh催化制备对苯二酚[8]。该法虽生产工艺简单,副产物少,但贵金属催化剂价格昂贵且难于回收造成生产成本高。苯胺法为在温度5~8 ℃下加入由苯胺与硫酸配制成的苯胺硫酸盐溶液后,加入锰浆溶液或重铬酸钠溶液,反应生成苯醌,将精馏出的对苯醌与铁粉反应生成对苯二酚,该方法易于控制,且产率较高,但反应的副产物多,反应过程产生大量的锰盐、铁泥及硫酸盐等废液废渣难以处理,不仅增加了生产成本同时也造成了环境污染[9]。丙酮与苯酚法又称为双酚A法,即苯酚与丙酮在盐酸催化下反应生成双酚A,向双酚A中加入少许碱性催化剂,反应分解为苯酚与对异丙基苯酚,向分离出的对异丙基苯酚中加入少量双氧水,氧化生成丙酮和对苯二酚[10]。该方法虽然无三废产生,但生成的反应中间体对异丙基苯酚易发生聚合,严重影响了反应的收率,故该法被淘汰。因此开发出一种绿色环保的合成工艺,用于替代上述反应工艺迫在眉睫。
一直以来人们都青睐于苯酚羟基化生成对苯二酚,利用有机溶剂乙腈溶解苯酚,在催化剂和氧化剂的共同作用下,生成对苯醌[11],向对苯醌中加入还原剂得到对苯二酚,苯酚氧化得到对苯醌的方法是20世纪70年代的时候开发出来的,杜邦公司曾采用过该法,苯酚氧化法最开始的氧化剂为氧气,反应过程需要的氧气压力较高,后逐渐由过氧化氢取代了氧气,如徐等[12]报道以有机硒为催化剂苯酚经双氧水选择性氧化得到对苯醌,而对苯醌的进一步还原,需要以氢气为还原剂,在催化剂的作用下,对苯醌催化加氢合成对苯二酚[13],然而氢气的易燃易爆特性阻碍了其进一步的发展,本文系统研究了对苯醌催化加氢的工艺,优化加氢的反应工艺,提升反应的安全性,并筛选了合适的加氢催化剂,系统研究了反应温度压力及加氢方式对对苯醌催化加氢反应的影响,通过工艺条件优化,提高了反应的安全性,确定最佳合成工艺条件,实现对苯二酚绿色合成的工艺目标。
1 实 验
1.1 仪器和试剂
主要试剂:对苯醌(质量分数为99%);骨架镍催化剂;氢气;氮气;Pd/C(Pd:5wt%);Pt/C(Pt:5wt%)。
主要仪器:WHF-0.5高压反应釜,威海自控;GC 2010 Pro气相色谱仪,岛津;N-1300旋转蒸发仪,东京理化。
1.2 合成方法
1.2.1 绿色合成工艺研究
釜式反应:将5 g对苯醌溶于95 mL的温水配成对苯醌水溶液加入到高压反应釜内,按对苯醌:催化剂=100:1的质量比将催化剂加入到高压反应釜内,加入密封反应釜,通入氮气置换出釜内空气,通入氢气后,保持压力在1.5 MPa,搅拌升温在90 ℃下反应3 h。反应结束后冷却降温,排气,过滤回收催化剂,同时检测产物的收率及纯度。
固定床反应:将对苯醌与温水混合,配制成5%的对苯醌水溶液,将制备的骨架镍催化剂造粒成4 mm的小球,装天道固定床中,将反应装置经过氮气吹扫后,通入反应液,待反应液持续通入3 min后,向反应装置中通入H2,在压力为1.5 MPa,反应温度为90 ℃下,考察反应30 min后对苯醌的转化率及对苯二酚的收率。
超重力催化反应:将对苯醌与温水混合,配制成5%的对苯醌水溶液,将制备的骨架镍催化剂造粒成4 mm的小球,装填入无挡板树脂填料中,制备出填装式催化剂填料,将反应装置经过氮气吹扫后,通入反应液,待反应液持续通入3 min后,向反应装置中通入H2,在压力为1.5 MPa,反应温度为90 ℃下,考察反应30 min后对苯醌的转化率及对苯二酚的收率。各种催化剂的合成是通过文献相关方法合成。
2 结果与讨论
2.1 催化剂对对苯醌催化加氢反应的影响
在催化剂作用下,对苯醌催化加氢的反应方程式如图所示。反应体系中氢气扩散至催化剂表面,被催化剂吸附并被活化为氢原子;被吸附在催化剂表面的对苯醌扩散到活性位点形成化学吸附,被吸附的对苯醌与活化后的氢原子发生亲核加成反应,生成对苯二酚,生成的对苯二酚分子在活性位点进行解吸,进一步的由催化剂表面发生扩散并分离。氢气催化加氢反应工艺的关键就是催化剂的选择,不同的催化剂的选择决定了反应物传质速度和反应物化学吸附的速率。常用的还原醌类化合物的催化剂主要包括Pd/C、Pt/C、骨架镍催化剂等。

对苯醌与催化剂的投料比为100:1,反应温度为100 ℃,反应时间3 h,进行不同催化剂催化效果对比研究,实验结果见表1,如表1所示,在未加催化剂的条件下,对苯醌亦可在该反应条件下转化为对苯二酚,该反应下对苯醌的转化率为28.7%,采用贵金属类催化剂Pd/C和Pt/C参与反应后,对苯二酚的收率较高,但贵金属催化剂不仅价格昂贵,循环使用活性位点易中毒,活性下降快,使用寿命短,镍基催化剂原料易得,催化加氢性能优异,故选择了两种镍基催化剂,从表中可知使用镍基催化剂时对苯醌转化率和对苯二酚收率都得到显著提高,同时负载型骨架镍催化剂的催化性能与Pt/C催化剂的性能相当,故选择负载型骨架镍催化剂进行反应。

表1 催化剂种类对对苯醌加氢反应的影响
2.2 反应压力及温度对对苯醌催化加氢反应的影响
对苯醌催化加氢反应过程中,反应压力不同,我们考察了不同反应压力下,釜式反应中对苯二酚收率的变化,由图1可知以骨架镍为催化剂还原对苯醌,对苯二酚的收率随着氢气反应压力的增大逐渐升高,当达到一定压力后对苯二酚的收率基本不变。当反应压力较低时,氢气的压力对反应速率的影响较为显著,随着压力的升高,体系内催化剂吸氢速率加快,反应转化率提高,当反应压力逐渐升高时,反应体系内气-液-固三相达到平衡,活化后的氢原子数量增加,利于反应的正向进行,当氢气的反应压力为1.5 MPa时反应转化率基本不发生变化,故氢气压力为1.5 MPa时,反应转化率最佳。

图1 氢气压力对对苯二酚收率的影响
根据对苯醌还原反应的机理,当反应温度过低时,不但影响对苯醌在水中的溶解度,同时会影响反应的转化率,当反应温度过高时,反应的选择性下降,反应中出现了过度氢化的副产物,因此通过改变反应温度来研究温度对对苯醌催化加氢反应的影响情况。对苯醌与骨架镍催化剂的投料比为100:1,反应压力1.5 MPa,反应时间3 h,进行不同温度反应对比研究,实验结果见表2。如表2所示,在温度低于90 ℃时,随着反应温度的升高,对苯二酚的收率明显提高,在此阶段,温度升高催化剂的活性提高,有利于对苯醌的充分溶解分散,有利于反应的正向进行。当温度为90 ℃时,对苯二酚的收率达到最佳。表明此时催化剂活化性能与主反应的选择性达到最佳。当温度高于90 ℃时,催化剂过度活化,导致副反应增多,同时该反应为放热反应,过高的温度抑制了反应的正向进行,对苯二酚的选择性下降,主反应的收率出现下降趋势。因此反应的最佳温度为90 ℃。

表2 不同反应温度对对苯醌加氢反应的影响
2.3 不同反应方式对对苯醌催化加氢反应的影响
为了更好地提高反应的转化率,我们采用了不同的加氢催化反应方式,分别探究了固定床反应、超重力催化反应器进行催化加氢反应的影响。为了更好地对比反应效果,三种不同方式采用的催化剂为负载型骨架镍造粒后的颗粒,反应结果如表所示。由表可知,采用造粒后的催化剂进行釜式反应,对苯醌的转化率为92.3%,对苯醌的收率为84.3%,而采用超重力催化反应装置进行反应,对苯醌的转化率能达到100%,对苯二酚的收率可达到98%以上,采用固定床反应器进行反应,可以保证反应液充分的与催化剂接触同时控制氢气的流速,保证反应物在床层的停留时间,有利于提高反应的转化率和选择性。采用超重力催化反应器,在反应过程中模拟超重力环境,使流经转子催化剂填料的流体形成大量的微米级到纳米级的液滴及液膜,有利于提高反应中反应物与催化剂的接触面积和界面更新速率,进一步强化不同相间的传质和混合效果,同时采用超重力反应器反应可以减少氢气的消耗量,精准控制氢气的进入量,提高反应体系的安全性。同时采用超重力催化反应装置进行反应可以大大缩短反应时间,采用釜式反应需3 h,而采用超重力反应器反应30 min后,反应转化率达到987%,且为连续性出料。
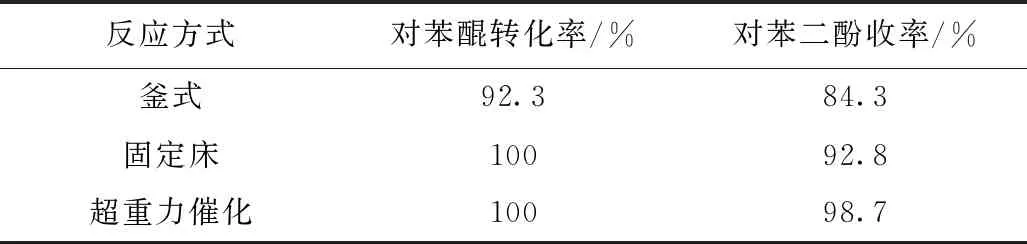
表3 不同反应方式对对苯醌加氢反应的影响
3 结 论
以对苯醌为原料,负载型骨架镍为催化剂进行催化加氢反应制备对苯二酚,经工艺条件优化后其最佳反应条件为采用超重力催化装置,在压力为1.5 MPa,温度为90 ℃条件下进行连续化反应,在该条件下反应3 h后对苯二酚的收率可达到98.7%。
