高考中离子平衡图像分析题模型探究
2022-11-30黑龙江崔广龙
黑龙江 崔广龙
溶液中离子平衡的图像往往是从多角度动态地描述了电离平衡、盐类水解平衡、沉淀溶解平衡等变化,体现了“变化观念与平衡思想”的核心素养的考查;通过分析推理等方法认识电离平衡、盐类水解平衡、沉淀溶解平衡的本质特征;通过建立平衡模型,突出了“证据推理与模型认知”核心素养的考查。此类试题的主要命题点有水的电离程度的比较、离子浓度的大小关系、电离常数的计算、pH的计算、溶度积的计算,侧重学生分析问题、解决问题能力的考查。解答好此类题目必须准确把握平衡的本质和规律、内涵与外延,移动与平衡之间的联系,建构认知模型和思维模式,从而揭示图像表征背后所隐含的平衡规律和事物本质。
一、酸碱中和滴定曲线

盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线提醒:①两个图像曲线的起点不同:酸滴定碱的曲线高起点低落点;碱滴定酸的曲线低起点高结点②曲线的pH突跃范围不同:强酸与强碱滴定的突跃范围最大;弱酸或弱碱滴定的曲线突跃范围变窄③达到滴定终点时,pH不一定等于7:强酸与强碱滴定终点pH=7;强酸与弱碱滴定终点的pH<7;强碱与弱酸滴定终点的pH>7
二、Kw和Ksp曲线
1.Kw曲线

不同温度下水溶液中c(H+)与c(OH-)的变化曲线曲线变形:pH-pOH曲线提醒: ①A、B两点为中性,Kw(B) 大于Kw(A)②C点为碱性溶液,D点为酸性溶液,Kw(A)=Kw(C)=Kw(D)③AB直线左上方均为碱性溶液,右下方均为酸性溶液提醒:①A、B两点为中性,Kw(B)大于Kw(A)②C点为碱性溶液,D点为酸性溶液,Kw(A)=Kw(C)=Kw(D) ③AB直线左上方均为酸性溶液,右下方均为碱性溶液
2.Ksp曲线

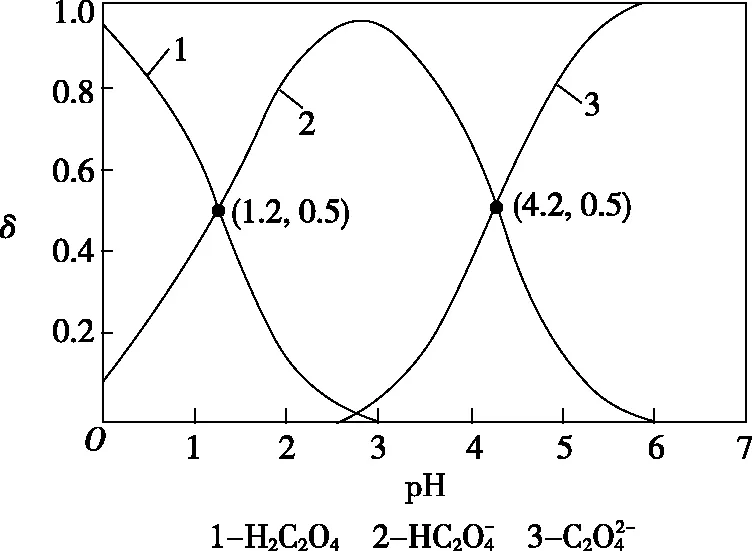
常温下,CaSO4在水中的溶解平衡曲线(Ksp=9×10-6)曲线变形:pMpR曲线①a、c两点在曲线上,a→c的变化为增大c(SO2-4),例如向溶液中加入Na2SO4固体,但线上所有点的Ksp不变②b点在曲线的上方,Qc(b)>Ksp,为过饱和溶液,将有沉淀生成③d点在曲线的下方,Qc(d) 1.相同体积、相同浓度的盐酸和醋酸 加水稀释相同的倍数,醋酸的pH大加水稀释相同的pH,盐酸加的水多 2.相同体积、相同pH的盐酸和醋酸 加水稀释相同的倍数,盐酸的pH大加水稀释到相同的pH,醋酸加水多 3.pH与稀释倍数的线性关系 命题角度1 酸碱中和滴定曲线 【例1】用一定浓度NaOH溶液滴定某醋酸溶液。滴定终点附近溶液pH和导电能力的变化分别如图所示(利用溶液导电能力的变化可判断滴定终点;溶液总体积变化忽略不计)。下列说法不正确的是 ( ) A.a点对应的溶液中:c(CH3COO-)=c(Na+) B.a→b过程中,n(CH3COO-)不断增大 C.c→d溶液导电性增强的主要原因是c(OH-)和c(Na+) 增大 D.根据溶液pH和导电能力的变化可判断:V2 【答案】C 【解题思路】a点溶液pH=7,则c(H+)=c(OH-),而电解质溶液中存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)=c(CH3COO-),A项正确;a→b的过程中,溶液中的CH3COOH逐渐被中和,溶液中的CH3COO-的物质的量逐渐增大,B项正确;达到滴定终点前,溶液中的c(CH3COO-)、c(Na+)逐渐增大是溶液导电性逐渐增强的主要原因,C项错误;d点以后溶液导电能力增长速率更快,说明V(NaOH)=V3时CH3COOH和NaOH完全反应,达到滴定终点,而pH=7时溶液中溶质为CH3COONa和CH3COOH,故V2 命题角度2Kw曲线变形:pH-pOH曲线 【例2】已知:pH=-lgc(H+),pOH=-lgc(OH-)。常温下,向某浓度的盐酸中滴加NaOH溶液,所得溶液pOH和pH变化如图所示。下列说法正确的是 ( ) A.盐酸与NaOH溶液的浓度相等 B.升高温度,滴定过程中pOH+pH>14 C.将滴加NaOH溶液改为滴加氨水,该图曲线不变 D.B点和D点水的电离程度相同 【答案】C 【解题思路】由题图可知,未滴加NaOH溶液时,盐酸的pH=0,则c(H+)=1 mol·L-1,即c(HCl)=1 mol·L-1,最终pH=14,则c(OH-)=1 mol·L-1,由于最终所得溶液是NaCl和NaOH的混合溶液,相当于对原NaOH溶液进行稀释,故c(NaOH)>1 mol·L-1,A项错误;升高温度,水的离子积Kw增大,即c(H+)·c(OH-)>10-14,pH=-lgc(H+),pOH=-lgc(OH-),故pOH+pH<14,B项错误;若将滴加NaOH溶液改为滴加氨水,由于NH3·H2O为弱碱,而饱和氨水的pH约为12,故最终所得溶液pH不可能为14,C项错误;B点、D点水的电离均受到抑制,且由水电离出的c(H+)=c(OH-)=10-10mol·L-1,D项正确。 命题角度3Ksp曲线变形:pM-pR曲线 【例3】已知pA=-lgc(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是 ( ) A.a点无ZnS沉淀析出 B.可用MnS除去MnCl2溶液中混有的少量ZnCl2 C.向CuS悬浊液中加入少量水,平衡向CuS溶解的方向移动,c(S2-)增大 【答案】C 命题角度4 分布曲线 ( ) A.pH=1.2的溶液中:c(K+)+c(H+)=c(OH-)+c(H2C2O4) C.常温下,将相同物质的量的KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2 D.向pH=1.2的溶液中加KOH溶液使pH增大至4.2的过程中水的电离度一直增大 【答案】C 双纵坐标类试题的解题思维模型 注:图像中横坐标和双纵坐标所代表的物理意义可能涉及离子浓度、pH、转化率、温度、分布系数、浓度等物理量,需仔细甄别,还需要注意曲线与纵坐标的对应关系。三、溶液稀释的图像


四、各组分分布曲线