异黄烯衍生物的合成及其抑菌活性
2022-11-30林晋雨杨银华杨春平陈华保乐贵洲
林晋雨, 何 桥, 王 斌, 杨银华, 杨春平, 陈华保, 乐贵洲
(1. 四川农业大学 农学院四川 成都 611130; 2. 四川农业大学 理学院,四川 成都 611130)
仿生合成是开发新型化学和生物农药的重要途径之一[1]。目前,研究人员已通过仿生合成成功开发出多种新产品,例如从蘑菇提取的化合物出发合成的嘧菌酯[2]。从植物中寻找抗真菌活性物质是开发新型杀菌剂的有效策略,例如从天然植物中提取的光甘草定是光果甘草中的主要黄酮类成分之一,其骨架为2-苯基色原酮结构。光甘草定及其衍生物都是以C6—C3—C6为基本碳架的化合物[3](图Chart 1)。

Chart 1
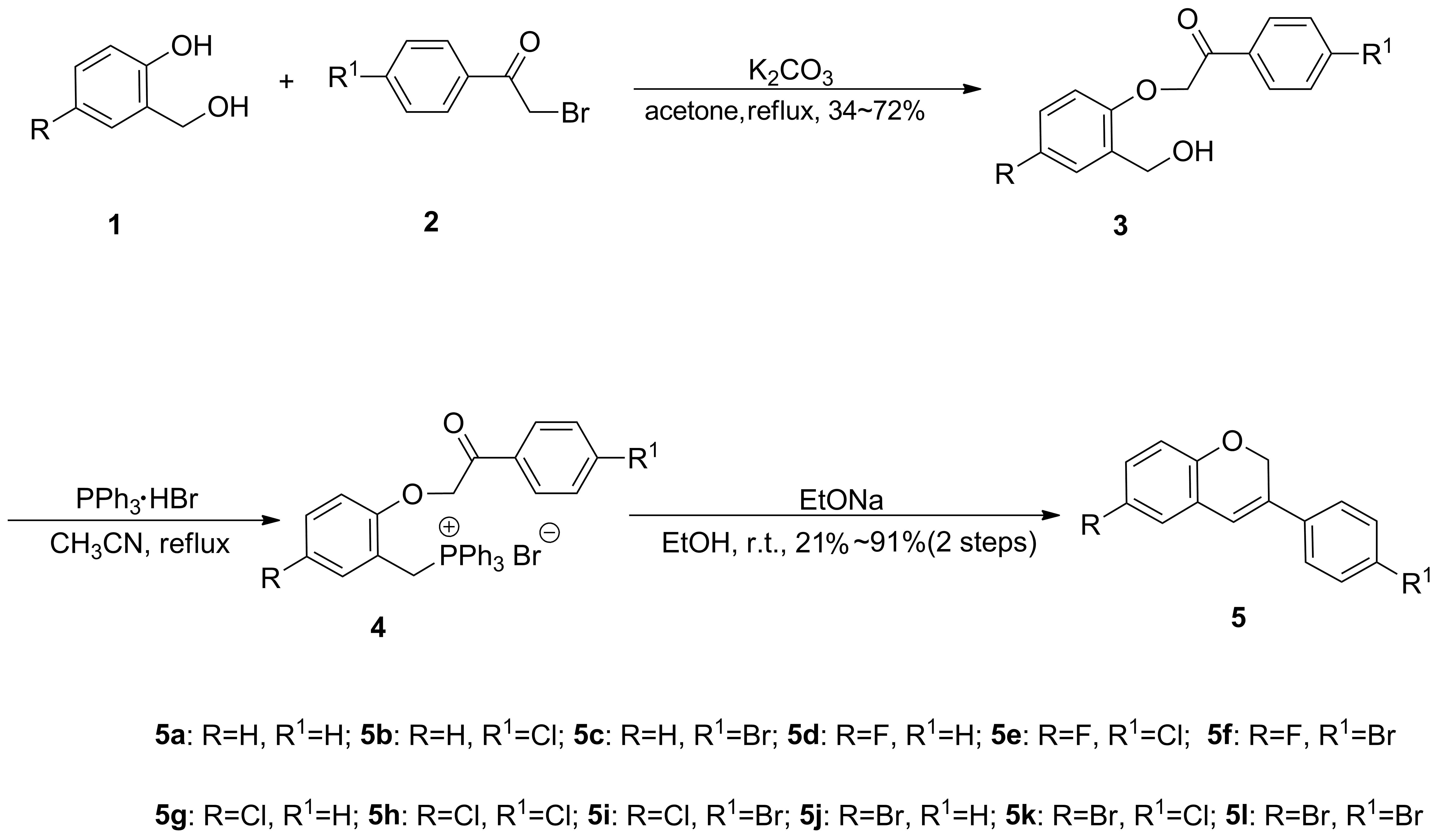
Scheme 1
据文献报道,光甘草定的应用主要集中于医药领域且具有极高的药用价值[4],如作为抗炎剂、用于抑制酶活性、抑制黑色素生成和抑制肿瘤细胞转移等[5-8]。目前,研究人员在对光甘草定的提取工艺、抗肿瘤研究和活性成分化合物的分离分析等方面[9-11]已取得较丰富的成果,但在农药领域的应用报道较少。
徐曙等发现光甘草定对部分植物病原真菌有明显的抑制作用[12],因此推断光甘草定类似物具有潜在的杀菌剂应用价值。本文在Stein等[13]报道的合成化合物方法的基础上,以廉价易得的水杨醇及α-溴代苯乙酮为原料,通过条件优化,反应合成了12个异黄烯衍生化合物5a~5l(Scheme 1),并采用抑制菌丝生长速率法测试了化合物对真菌活性的抑制作用。
1 实验部分
1.1 仪器与试剂
bruker avance neo 400M型核磁共振波谱仪(CDCl3为溶剂,TMS为内标);Agilent Technologies 6224 TOF LC/MS型质谱仪。
柱层析硅胶(200~300目,青岛海洋化工厂)高效薄层层析板(烟台市芝罘黄务厂);草莓灰霉病菌、禾谷镰刀菌、马铃薯早疫病菌、烟草赤星病菌(四川农业大学无公害农药研究实验室);所用试剂均为分析纯或化学纯试剂。
1.2 合成
(1) 中间体3的合成
在干燥的50 mL两颈烧瓶中通入氩气置换,将邻羟基苯甲醇(3.0 mmol, 1.0 eq.)、碳酸钾(3.3 mmol, 1.1 eq.)溶于丙酮(10 mL),搅拌下反应1 h。随后加入2-溴苯乙酮(3.5 mmol, 1.2 eq.),升温至回流,搅拌下反应3 h(薄层层析检测显示反应完全)。过滤取滤液旋干,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1∶3,V∶V)纯化得中间体3。
3a:[CAS: 109790-47-8]; 收率64%;1H NMR(400 MHz, CDCl3)δ: 7.95(d,J=7.6 Hz, 2H), 7.62(t,J=7.6 Hz, 1H), 7.49(t,J=7.6 Hz, 2H), 7.30(d,J=1.2 Hz, 4H), 7.23(t,J=8.0 Hz, 1H), 6.97(t,J=7.6 Hz, 1H), 6.84(d,J=8.4 Hz, 1H), 5.38(s, 2H), 4.75(s, 2H)。
3b:[CAS: 109790-49-0];收率48%;1H NMR(400 MHz, CDCl3)δ: 7.93(d,J=8.8 Hz, 2H), 7.50(d,J=8.8 Hz, 2H), 7.33(dd,J=7.2 Hz, 1.6 Hz, 1H), 7.26(td,J=8.0 Hz, 1.6 Hz, 1H), 7.00(ψt,J=7.2 Hz, 1H), 6.85(d,J=8.0 Hz, 1H), 5.36(s, 2H), 4.77(s, 2H), 3.48(br s, 1H)。
3c:[CAS: 109790-51-4];收率59%;1H NMR(400 MHz, CDCl3)δ: 7.91~7.94(m, 2H), 7.47~7.51(m, 2H), 7.31~7.33(m, 1H), 7.26~7.27(m, 1H), 7.23~7.25(m, 1H), 6.97~7.02(m, 1H), 6.84(d,J=8.0 Hz, 1H), 5.35(s, 2H), 4.76(s, 2H)。
3d:收率60%;1H NMR(400 MHz, CDCl3)δ: 7.97~7.95(m, 2H), 7.64(ψt,J=7.6 Hz, 1.6 Hz, 2H), 7.54~7.50(m, 2H), 7.07(dd,J=8.4 Hz, 3.2 Hz, 1H), 6.91(td,J=8.4 Hz, 3.2 Hz, 1H), 6.79(dd,J=9.0 Hz, 4.2 Hz, 1H), 5.38(s, 2H), 4.74(d,J=4.0 Hz, 1H), 3.44(br s, 1H);13C NMR(100 MHz, CDCl3)δ: 194.7, 152.1(d), 134.3, 134.1, 132.3(d), 129.0, 127.9, 116.1, 115.9, 114.4(d), 113.0(d), 71.1, 61.2; HR-MS(ESI)m/z: calcd for C15H13O3FNa{[M+Na]+}283.0746, found 283.08149。
3e:收率72%;1H NMR(400 MHz, CDCl3)δ: 7.92(d,J=7.6 Hz, 2H), 7.51(d,J=7.6 Hz, 2H), 7.09(d,J=6.4 Hz, 1H), 6.93(s, 1H), 6.80(s, 1H), 5.35(s, 2H), 4.75(s, 2H), 3.41(br s, 1H);13C NMR(150 MHz, DMSO-d6)δ: 194.4, 151.1, 139.1, 133.5, 130.4, 130.3, 129.5, 113.3, 71.3, 58.0; HR-MS(ESI)m/z: calcd for C15H12O3FClNa{[M+Na]+}317.0357, found 317.04340。
3f:收率38%;1H NMR(400 MHz, CDCl3)δ: 7.84~7.82(m, 2H), 7.67~7.65(m, 2H), 7.08(dd,J=8.6 Hz, 3.0 Hz, 1H), 6.91(td,J=8.6 Hz, 3.0 Hz, 1H), 6.77(dd,J=8.8 Hz, 4.0 Hz, 1H), 5.32(s, 2H), 4.73(d,J=4.0 Hz, 1H), 3.28(br s, 1H);13C NMR(100 MHz, DMSO-d6)δ: 194.5, 151.1, 133.8, 133.7(d), 132.3, 130.4, 128.4, 113.8, 113.6, 113.4, 113.3(d), 71.3, 58.1; HR-MS(ESI)m/z: calcd for C15H12O3FBrNa{[M+Na]+}360.9852, found 360.9944。
3g:[CAS: 109790-48-9];收率55%;1H NMR(400 MHz, CDCl3)δ: 7.82~7.84(m, 2H), 7.65~7.68(m, 2H), 7.32(d,J=2.8 Hz, 1H), 7.19(dd,J=2.8 Hz, 2.0 Hz), 6.75(d,J=8.8 Hz, 1H), 5.33(s, 2H), 4.72(s, 2H)。
3h:[CAS: 109790-50-3];收率42%;1H NMR(400 MHz, CDCl3)δ: 7.91(d,J=8.4 Hz, 2H), 7.50(d,J=8.4 Hz, 2H), 7.32(d,J=2.8 Hz, 1H), 7.20(dd,J=8.6 Hz, 2.6 Hz), 6.76(d,J=8.4 Hz, 1H), 5.34(s, 2H), 4.72(s, 2H). 3.21(br s, 1H)。
3i:[CAS: 109790-53-6];收率34%;1H NMR(400 MHz, CDCl3)δ: 7.82(d,J=8.4 Hz, 2H), 7.66(d,J=8.4 Hz, 2H), 7.32(d,J=2.8 Hz, 1H), 7.18(dd,J=8.6 Hz, 2.6 Hz), 6.75(d,J=8.8 Hz, 1H), 5.32(s, 2H), 4.71(d,J=0.8 Hz, 2H), 3.26(br s, 1H)。
3j:[CAS: 133308-49-3];收率72%;1H NMR(400 MHz, CDCl3)δ: 7.96~7.94(m, 2H), 7.67~7.62(m, 1H), 7.54~7.50(m, 2H), 7.45(d,J=2.4 Hz, 1H), 7.33(dd,J=8.6 Hz, 2.6 Hz), 6.72(d,J=8.8 Hz, 1H), 5.38(s, 2H), 4.72(s, 2H), 3.40(br s, 1H)。
3k:收率51%;1H NMR(400 MHz, CDCl3)δ: 7.92~7.89(m, 2H), 7.51~7.46(m, 2H), 7.45(d,J=2.4 Hz, 1H), 7.34(dd,J=8.6 Hz, 2.6 Hz), 6.71(d,J=8.8 Hz, 1H), 5.33(s, 2H), 4.71(s, 2H), 3.22(br s, 1H);13C NMR(100 MHz, CDCl3)δ: 193.0, 155.1, 140.9, 132.4(d), 132.2(d), 131.5, 131.3, 129.4(d), 129.3(d), 114.3, 113.4(d), 70.6, 61.6(t); HR-MS(ESI)m/z: calcd for C15H12O3ClBrNa{[M+Na]+}376.9556, found 376.96521。
3l:收率46%;1H NMR(400 MHz, CDCl3)δ: 7.83~7.80(m, 2H), 7.67~7.64(m, 2H), 7.45(d,J=2.4 Hz, 1H), 7.32(dd,J=8.6 Hz, 2.6 Hz), 6.69(d,J=8.8 Hz, 1H), 5.31(s, 2H), 4.71(s, 2H), 3.29(br s, 1H);13C NMR(100 MHz, CDCl3)δ: 193.3, 155.1, 132.7, 132.5(d), 132.3(d), 132.1, 131.4(d), 129.7, 129.4(d), 114.3, 113.4(d), 70.6, 61.3; HR-MS(ESI)m/z: calcd for C15H12O3Br2Na{[M+Na]+}422.9030, found 422.91204。
(2) 中间体4的合成
在干燥的50 mL两颈烧瓶中通入氩气置换,依次加入中间体3(2.0 mmol, 1.0 eq.)、 PPh3·HBr(2.2 mmol, 1.1 eq.)及乙腈(10 mL),所得溶液于90 ℃条件下搅拌下反应3 h(薄层层析检测显示反应完全)。冷却至室温后,乙醚洗涤过滤,得到鏻盐4,并直接用于下一步反应,无需纯化。
(3) 异黄烯衍生物5的合成
在干燥的50 mL两颈烧瓶中通入氩气置换,依次加入中间体4(2.0mmol, 1.0 eq.)、乙醇钠(2.2 mmol, 1.1eq.)及乙醇(10 mL),室温下搅拌过夜,将所得溶液减压浓缩。随后加入稀盐酸和盐水,混合物用乙酸乙酯(5×25 mL)萃取,合并有机层,无水硫酸镁干燥、过滤,取滤液旋干经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1 ∶6,V∶V)纯化得到产物5。
5a:[CAS: 6054-00-8];收率76%;1H NMR(400 MHz, CDCl3)δ: 7.41~7.44(m, 2H), 7.36~7.40(m, 2H), 7.28~7.33(m, 1H), 7.10~7.14(m, 1H), 7.07~7.09(m, 1H), 6.90(td,J=7.6 Hz, 1.2 Hz, 1H), 6.85(d,J=8.0 Hz, 1H), 6.80(s, 1H), 5.16(d,J=1.6 Hz, 2H)。
5b:[CAS: 77670-09-8];收率77%;1H NMR(400 MHz, CDCl3)δ: 7.36(s, 4H), 7.14(td,J=7.6 Hz, 1.6 Hz, 1H), 7.09(d,J=2.0 Hz, 1.6 Hz, 1H), 6.92(td,J=7.6 Hz, 1.2 Hz, 1H), 6.85(d,J=8.0 Hz, 1H), 6.80(s, 1H), 5.13(d,J=1.2 Hz, 2H)。
5c:[CAS: 109790-38-7];收率69%;1H NMR(400 MHz, CDCl3)δ: 7.36(s, 4H), 7.12~7.15(m, 1H), 7.08~7.10(m, 1H), 6.92(td,J=7.2 Hz, 0.8 Hz, 1H), 6.85(d,J=8.0 Hz, 1H), 6.80(s, 1H), 5.13(d,J=1.2 Hz, 2H)。
5d:收率60%;1H NMR(600 MHz, CDCl3)δ: 7.45~7.39(m, 2H), 7.42~7.39(m, 2H), 7.34(tt,J=7.2 Hz, 1.5 Hz, 1H), 6.84~6.79(m, 3H), 6.75(s, 1H), 5.14(d,J=1.2 Hz, 2H);13C NMR(150 MHz, CDCl3)δ: 149.1, 136.3, 133.5, 128.8(d), 128.4(d), 125.0(d), 124.8, 124.1(d), 119.5(d), 116.3(t), 115.0(d), 113.0(q), 67.3(t); HR-MS(ESI)m/z: calcd for C15H11NFO{M+}226.0794, found 226.0753。
5e:收率73%;1H NMR(400 MHz, CDCl3)δ: 7.38(td,J=4.0 Hz, 8.0 Hz, 4H), 6.88~6.80(m, 3H), 6.74(s, 1H), 5.11(s, 2H);13C NMR(100 MHz, CDCl3)δ: 158.9 , 156.5, 149.1, 134.7, 134.2, 132.2, 126.1, 123.7, 119.3(d), 116.4(d), 115.3(d), 113.09(d), 67.0; HR-MS(ESI)m/z: calcd for C15H11ClFO{[M+H]+}261.0482, found 261.0289。
5f:收率49%;1H NMR(400 MHz, CDCl3)δ: 7.38~7.44(m, 4H), 7.32~7.36(m, 1H), 7.20~7.22(m, 2H), 6.74(s, 1H), 6.72(s, 1H), 5.17(d,J=1.2 Hz, 2H);13C NMR(100 MHz, CDCl3)δ: 149.1(d), 135.2, 132.2, 126.4, 123.8(d), 122.4, 120.0(d), 116.4(d), 115.5, 115.2, 113.1(d), 67.0; HR-MS(ESI)m/z: calcd for C15H11BrFO{[M+H]+}304.9977, found 304.9775。
5g:[CAS: 88040-01-1];收率30%;1H NMR(400 MHz, CDCl3)δ: 7.39~7.45(m, 4H), 7.32~7.36(m, 1H), 7.06~7.08(m, 2H), 6.77~6.80(m, 1H), 6.73(s, 1H), 5.16(d,J=1.2 Hz, 2H)。
5h:[CAS: 109790-37-6];收率21%;1H NMR(400 MHz, CDCl3)δ: 7.33~7.39(m, 4H), 7.05~7.09(m, 2H), 6.78(d,J=8.4 Hz, 1H), 6.71(s, 1H), 5.12(d,J=1.2 Hz, 2H)。
5i:[CAS: 109790-40-1];收率67%;1H NMR(400 MHz, CDCl3)δ: 7.50~7.53(m, 2H), 7.25~7.29(m, 2H), 7.04~7.09(m, 2H), 6.77(d,J=8.4 Hz, 1H), 6.71(s, 1H), 5.11(d,J=1.6 Hz, 2H)。
5j:[CAS: 128723-62-6];收率91%;1H NMR(400 MHz, CDCl3)δ: 7.38~7.44(m, 4H), 7.32~7.36(m, 1H), 7.20~7.22(m, 2H), 6.74(s, 1H), 6.72(s, 1H), 5.17(d,J=1.2 Hz, 2H);13C NMR(100 MHz, CDCl3)δ: 152.3, 136.2, 133.1, 132.0, 131.5, 131.5, 128.9, 128.8, 128.5, 125.8, 124.8, 118.9, 117.2, 113.4, 67.3; HR-MS(ESI)m/z: calcd for C15H12BrO{[M+H]+}287.0072, found 286.9889。
5k:收率40%;1H NMR(400 MHz, CDCl3)δ: 7.32~7.38(m, 4H), 7.18~7.26(m, 2H), 6.72(d,J=8.4 Hz, 1H), 6.70(s, 1H), 5.12(d,J=1.2 Hz, 2H);13C NMR(100 MHz, CDCl3)δ: 152.3, 134.7, 134.3, 131.8, 129.4, 129.0, 126.1, 124.6, 119.4, 117.3, 113.7, 67.0; HR-MS(ESI)m/z: calcd for C15H11BrClO{[M+H]+}320.9682, found 320.9483。
5l:[CAS: 109790-39-8];收率61%;1H NMR(400 MHz, CDCl3)δ: 7.50~7.53(m, 2H), 7.28~7.29(m, 1H), 7.26~7.27(m, 1H), 7.19~7.23(m, 2H), 6.71~6.74(m, 2H), 5.12(d,J=1.2 Hz, 2H)。
1.3 抑菌活性测试
采用菌丝生长速率抑制法测试了目标化合物对草莓灰霉病菌、禾谷镰刀菌、马铃薯早疫病菌和烟草赤星病菌的抑菌活性。以0.1%吐温-20为溶剂,将样品配制成400 mg/L的溶液,吸取1 mL样品溶液与9 mL对苯二胺混合倒入培养皿中制成培养基,灭菌、接种。于适温下孵育4 d,通过交叉杂交方法扩大病原体的直径,重复3次获得菌丝体的生长抑制率。吐温-20(0.1%)为溶剂的光甘草定(400 mg/L)溶液作为对照。
2 结果与讨论
2.1 合成
根据Stein的文献报道,最初以未取代的水杨醇1a及α-溴代苯乙酮1b为底物,按照文献的条件(丙酮/60 ℃)进行亲核取代反应,获得的收率为中等,仅有56%(表1)。随后对该反应条件进行了优化,在溶剂和温度不变的条件下,考察了另外3种碱对反应的影响都没有碳酸钾的效果好。接着以碳酸钾为反应碱,同时考察了溶剂及温度对反应的影响,结果发现在丙酮中反应的温度越低,收率越高,在室温下可以获得70%的收率。其它的溶剂N,N-二甲基甲酰胺、二氯甲烷及四氢呋喃等反应效果都很差(表2)。综合表1及表2的数据,最终选择碳酸钾作反应碱,丙酮作溶剂,于室温下进行反应。
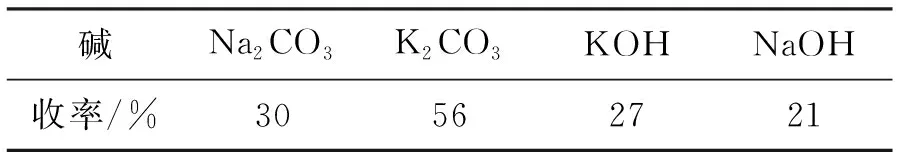
表1 碱对反应的影响

表2 溶剂和温度对反应的影响
随后以该条件,扩展其它取代基的水杨醇1及α-溴代苯乙酮2,以34%~72%的收率得到{1-芳基-2-(邻羟甲基)苯氧基苯乙酮}3。随后,将化合物3加入到乙腈中加热回流,冷却后过滤即获得相应的三苯基溴化鏻盐4。室温下化合物4在乙醇钠的乙醇溶液中发生分子内的维蒂希反应,经两步反应以21%~91%的收率获得化合物5。
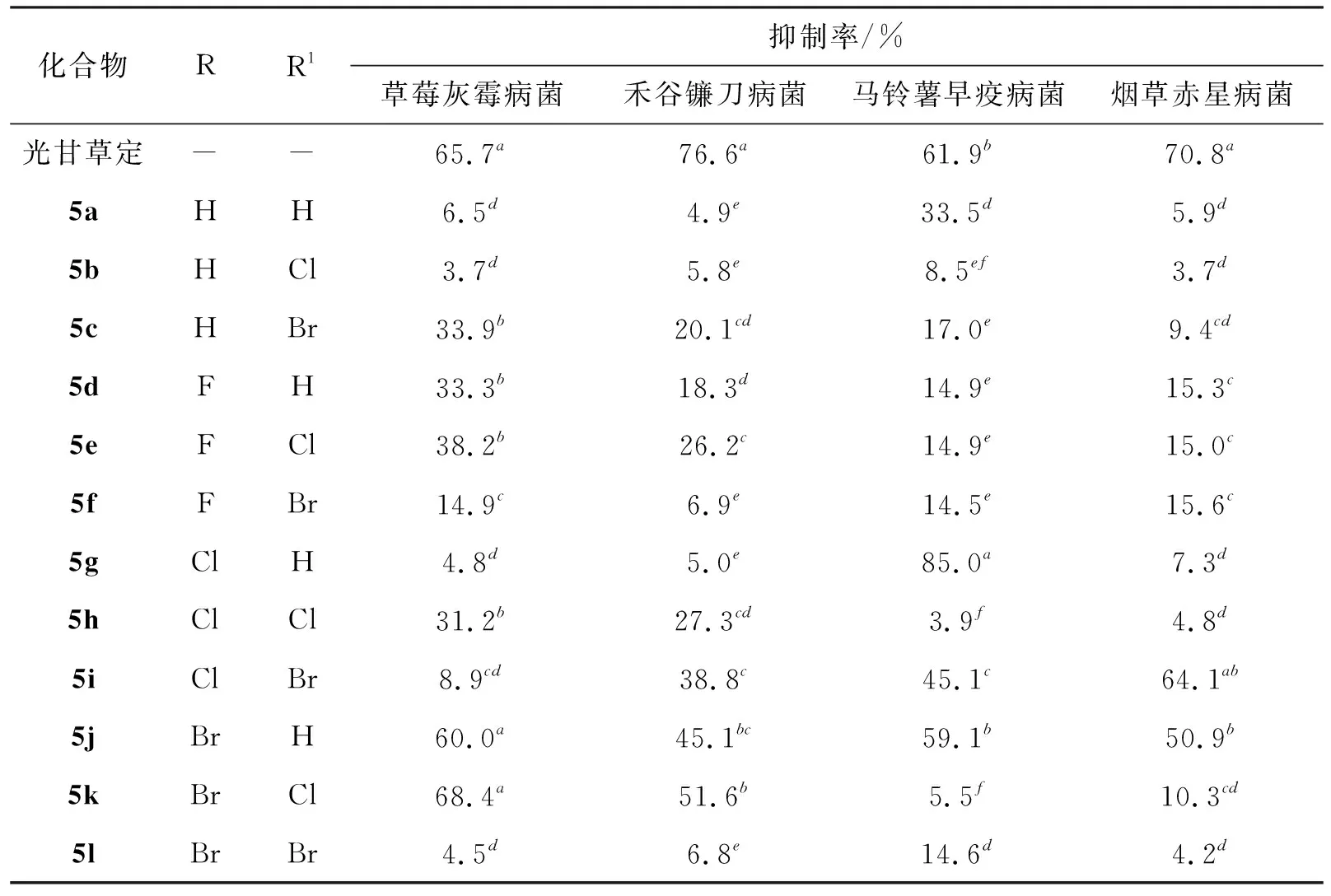
表3 光甘草定及其类似物的体外抑制真菌活性
2.2 抑菌活性
化合物的抑菌活性如表3所示,所有的化合物对草莓灰霉病菌、禾谷镰刀菌、马铃薯早疫病菌和烟草赤星病菌都表现出不同程度的抑制活性。化合物5j和5k对灰霉病菌的抑制率分别为60.0%和68.4%,与光甘草定效果相当且明显高于其他化合物,这表明在R位上溴取代苯并吡喃的前提下在苯环上引入氯原子或不引入都会增加化合物对草莓灰霉病菌的抑制效果,且氯原子取代比氢的作用效果稍好一些;所有化合物对禾谷镰刀病菌的抑制率为4.9%~51.6%,均低于光甘草定相对应的抑制效果,以此看来在苯并吡喃和苯环上引入卤素原子并不能提高化合物对禾谷镰刀病菌的抑制能力。尤其值得注意的是,化合物5g对马铃薯早疫病菌的抑制作用达到了85.0%,且显著高于光甘草定(61.9%),5j的效果与光甘草定相当,表明当苯环不引入原子时苯并吡喃上引入氯原子或溴原子均能增加化合物抑制马铃薯早疫病菌的效果,且氯原子的引入显著提高了化合物抑制马铃薯早疫病菌的效果。化合物5i对烟草赤星病菌的抑制率达到了64.1%,与其它化合物差异显著,可得出氯原子和溴原子分别引入到苯并吡喃和苯环上对烟草赤星病菌有一定抑制活性,但稍低于光甘草定。结果表明,3-芳基异黄酮类化合物具有一定的抑菌活性,对不同真菌的抑制作用差异较大,部分可作为新型杀菌剂的先导化合物,进一步优化研究。
以邻羟基苯甲醇为起始原料,通过亲核取代、季磷盐化和分子内维蒂希反应合成了12个3-芳基异黄烯衍生物,并测试了合成物对草莓灰霉病菌、西瓜枯萎病菌、马铃薯早疫病菌和烟草赤星病菌的抑真菌活性。结果表明,部分化合物对草莓灰霉病菌、禾谷镰刀菌、马铃薯早疫病菌和烟草赤星病菌有一定抑制作用。后续将扩大试验病菌种类,考察化合物的抑菌活性。
