HAPLN3基因在肾透明细胞癌中的表达及其与预后、免疫的关系*
2022-11-30张畅宋具昆袁东波陈伟明何虎钱城杨萌朱建国
张畅,宋具昆,袁东波,陈伟明,何虎,钱城,杨萌,朱建国
(1.贵州医科大学 研究生院,贵州 贵阳 550004;2.贵州省人民医院 泌尿外科,贵州 贵阳 550002)
肾癌起源于肾小管上皮细胞,占成人恶性肿瘤 的2%~3%,其发病率以每年约2.5%的速度上升,2021 年美国新发7 万多例肾癌病例和2万多例死亡病例[1]。肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是最常见的组织学类型,占肾癌的80%~90%[2]。不同时期ccRCC 患者生存率差异较大,其中分化差或已有转移的ccRCC 患者总体生存率普遍较低[3]。多项研究报道,1/3 的局限性ccRCC 患者出现术后复发或转移,单纯手术治疗、放疗及化疗效果均不佳[4-5]。欧洲泌尿外科协会临床指南将免疫检查点抑制剂作为晚期转移性ccRCC 的一线治疗[6]。ccRCC 免疫检查点抑制剂主要通过程序性死亡受体1(programmed cell death protein 1,PD-1)、细胞毒性T 淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4),维护T 淋巴细胞对肿瘤细胞的杀伤力[7]。
透明质酸和蛋白多糖链接蛋白家族基因成员3(hyaluronan and proteoglycan link protein 3,HAPLN3)分子量为40 894 Da,其编码的蛋白是透明质酸和蛋白多糖链接蛋白基因家族成员,包含360 个氨基酸,在人体各组织中广泛表达,主要存在于细胞外基质。该蛋白具有促进癌细胞迁移、诱导血管化、促进肿瘤生长的作用。而由透明质酸与蛋白多糖组成的细胞外基质,对肿瘤细胞的黏附、迁移、增殖、分化和存活等方面均有影响[8]。
既往研究表明,细胞外基质透明质酸和蛋白多糖在ccRCC 的发展中起重要作用[9]。HAPLN3 作为透明质酸与蛋白多糖的链接蛋白在肾癌中的作用显得尤为重要,然而HAPLN3 与ccRCC 的相关性未见报道。本文通过多个数据库进行分析,探讨HAPLN3 在ccRCC 中的差异表达、预后价值及免疫特征,分析HAPLN3 在ccRCC 中免疫及肿瘤相关通路的富集情况,以及HAPLN3基因表达降低对肾癌细胞株增殖的影响。
1 材料与方法
1.1 组织标本
癌症基因组图谱分析(the cancer genome atlas,TCGA)(https://portal.gdc.cancer.gov/)数据库下载时间为2021 年5 月,获取530 个ccRCC 患者及72 个癌旁组织标本的RNA 数据和相应的临床信息。由于TCGA 数据库癌旁组织较少,将基因型-组织表达(Genotype-Tissue Expression,GTEx)数据库的正常组织标本加入对照。使用GTEx 数据库(https://gtexportal.org/home/datasets)V8 版本,下载89 个正常肾脏组织的RNA 数据。mRNA 相对表达量均为标准化处理后的数据,将ccRCC 患者标本设为肿瘤组(530例)。以HAPLN3 mRNA 中位数为截断点,将标本分为高表达组(265例)、低表达组(265例)。按WHO/ISUP分级系统中的G3级、G4级,分为G3组(206例)、G4组(75例)。最后将癌旁组织标本和正常组织标本作为正常组(161例)。临床资料不完整的患者,如pMx 期不能使用,则作为缺失病例处理。
1.2 细胞培养
人肾近曲小管上皮细胞系HK-2、肾透明细胞癌细胞系OS-RC-2、ACHN 购自武汉普诺赛生命科技有限公司。90%基础培养基+10%胎牛血清(fetal bovine serum,FBS)+1%双抗配制成完全培养基,进行培养、传代,将细胞置于37℃、5%二氧化碳培养箱中培养。
1.3 主要试剂及仪器
基础培养基、FBS、双抗(美国Gibco 公司),BCA蛋白定量试剂盒、SP 检测试剂盒(北京索莱宝有限公司),放射免疫分析(radio immunoprecipitation assay,RIPA)裂解液(上海碧云天生物技术有限公司),兔抗人HAPLN3 多抗(北京博奥森生物技术有限公司),β-tubulin 抗体(美国Affinity Biosciences 公司),山羊抗兔IgG-HRP(美国Abeam 公司),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)Mix 试剂盒(武汉赛维尔生物科技有限公司),RNA 试剂盒(上海奕杉生物科技有限公司),LipofectamineTM2000 试剂盒(美国Invitrogen 公司),CCK-8(日本同仁化学研究所),快速封闭液(英国Genefist 公司),含干扰序列si-HAPLN3 和si-NC 质粒(上海吉凯基因公司)。
二氧化碳细胞培养箱(中国上海力申科学仪器有限公司),凝胶成像系统、qRT-PCR 仪、电泳槽、转膜仪(美国Bio-Rad 公司),酶标仪(美国Bio Tek Instruments 公司)。
1.4 方法
1.4.1 差异表达、生存分析及预后模型构建使用R 软件分析HAPLN3 在肿瘤组与正常组中的mRNA差异表达,并进一步分析在G3 组、G4 组及正常组中mRNA差异表达,“ggplot2”R软件绘制箱线图。“survival”“survminer”R 软件绘制生存曲线,研究不同表达量HAPLN3 对ccRCC 生存率的影响,以及G4 组、G3 组不同亚组间生存差异。采用单变量和多变量Cox 回归分析评估HAPLN3 与5 个主要因素的关系,包括年龄、pT 分期、pN 分期、pTNM 分期、WHO 分级。通过“forestplot”R 软件绘制森林图,显示每个变量的HR、95% CI和P值。使用“rms”R 软件构建列线图,预测1年、3年和5年总体生存率(overall survival,OS),计算出一致性指数(concordance index,C-index),绘制出校正曲线。采用Bootstrap 法自抽样200 次(B=200)验证,C 指数越大,预测价值越高,校正曲线越接近45°斜线,说明预测值与观察值越接近。
1.4.2 免疫细胞浸润及免疫检查点分析采用肿瘤免疫浸润数据库(Tumor Immune Estimation Resource,TIMER)2.0(https://cistrome.shinyapps.io/TIMER2.0/)分析HAPLN3 与肿瘤浸润性免疫细胞(tumorinfiltrating immune cells,TIIC)的相关性。采用“immunedeconv”R 软件中的TIMER 2.0 算法分析ccRCC 中HAPLN3 与6 种常见免疫细胞亚型浸润水平的相关性,使用XCELL 算法评估免疫评分、基质评分及肿瘤微环境。使用“ggplot2”“pheatmap”和“immuneeconv”R 软件评估免疫检查点相关基因在G3 组、G4 组的mRNA 相对表达量,以及HAPLN3 与免疫检查点相关基因的共表达情况。使用JIANG等[10]开发的肿瘤免疫功能障碍和排除(tumor immune dysfunction and exclusion,TIDE)算法预测免疫检查点阻断(immune checkpoint blockade,ICB)疗效,若TIDE 评分高代表接受ICB 治疗后生存期短。
1.4.3 基因富集分析寻找ccRCC 中潜在的HAPLN3 相关信号通路。HAPLN3 表达高表达组和低表达组使用基因集富集分析(Gene Set Enrichment Analysis,GSEA)v3.0(https://www.gsea-msigdb.org/gsea/downloads.jsp)。本研究中P<0.05 和FDR<5%为差异有统计学意义。
1.4.4 免疫组织化学(Immunohistochemistry,IHC)法检测HAPLN3的表达选取2020 年1 月—2021 年8 月在贵州省人民医院泌尿外科行根治性肾切除的50例患者的癌组织和对应的癌旁组织标本。本研究获得医院伦理委员会批准并经患者同意后签署知情同意书。标本进行常规石蜡包埋,切片厚度约4 μm,脱蜡,脱水,抗原修复,封闭,HAPLN3 一抗(1∶2 000)孵育过夜,羊抗兔IgG 二抗(1∶200)37℃孵育30 min,DAB 显色,苏木精复染,脱水,透明封片。显微镜下随机选取5 个视野,由2 位病理科医师独立进行评价。染色强度:无着色为0 分,淡黄色为1 分,黄褐色为2 分,深褐色为3 分。阳性细胞比例:<5%为0 分;5%~25%为1 分;>25%~50%为2 分;>50%~75%为3 分;>75%为4 分。相乘得出最终结果,0 分为阴性(-),1~4 分为弱阳性(+),5~8 分为阳性(++),9~12 分为强阳性(+++)。根据IHC 染色结果分为阴性表达(阴性和弱阳性)和阳性表达(阳性和强阳性)。
1.4.5 Western blotting检测HAPLN3 蛋白的表达取培养好的细胞,RIPA 裂解,离心后收集上清液。根据BCA 蛋白定量试剂盒说明书进行操作测定蛋白浓度。配置5%浓缩胶、10%分离胶进行上样电泳和转膜,快速封闭液封闭10 min,稀释β-tubulin、HAPLN3 后4℃孵育过夜。TBST 洗涤3 次,稀释二抗,室温孵育1 h,TBST 洗涤3 次,显影,采用Image J软件计算蛋白条带灰度值,进行半定量分析。目的蛋白相对表达量=目的蛋白条带灰度值/内参条带灰度值。
1.4.6 qRT-PCR检测HAPLN3 mRNA的表达采用RNA 试剂盒提取细胞RNA,然后在260 nm 波长处测定吸光度值和RNA 浓度,将RNA 逆转录成cDNA。按照qRT-PCR Mix 试剂盒说明书配置20 μL反应体系:2×Universal Blue SYBR Green qPCR Master Mix 10 μL,正反向引物各0.5 μL,模板DNA 1 μL,补充ddH20 至20 μL。反应条件:95℃预变性30 s,95℃变性15 s,60℃退火30 s,72℃延伸30 s,共40 个循环,熔解曲线按仪器默认条件。以β-actin 为内参,计算HAPLN3 mRNA 相对表达量。HAPLN3正向引物:5'-AGGAGACCCTGTTCACCTACC-3',反向引物:5'-ACAGCTTCCACCATTTGACAC-3',引 物长 度 111 bp;β -actin正向引物 :5'-TCCTCTCCCAAGTCCACACA-3',反向引物:5'-GCACGAAGGCTCATCATTCA-3',引物长度129 bp。引物序列由上海生工生物工程有限公司设计合成。
1.4.7 细胞转染及CCK-8 细胞增殖实验取对数生长期OS-RC-2、ACHN 细胞,根据LipofectamineTM2000 试剂盒说明书,分别转染si-HAPLN3 和si-NC。转染完成后qRT-PCR 检测siRNA 沉默效率。将构建成功的细胞胰酶消化后计数,等密度均匀接种于96 孔板,100 μL/孔,细胞4 000 个/孔,每组设置4 个复孔,分别于0 h、24 h、48 h、72 h 加入CCK-8 试剂,孵育2 h 后用酶标仪测定450 nm 波长处的光密度(optical density,OD),计算各组细胞存活率。
1.5 统计学方法
数据分析采用Rv 4.0.3 和GraphPad Prism v8.02统计软件。计数资料以率(%)表示,比较用χ2检验;正态分布的计量资料以均数±标准差()表示,比较用t检验或方差分析,进一步两两比较用LSD-t检验;非正态分布的计量资料以中位数和四分位数M(P25,P75)表示,比较用秩和检验,进一步两两比较用Dunn'st检验;采用Kaplan-Meier 法绘制生存曲线,比较用Log-rank χ2检验;相关性分析用Spearman 法;影响因素的分析用单因素和多因素Cox风险比例模型。P<0.05 为差异有统计学意义。
2 结果
2.1 各组HAPLN3 mRNA相对表达量比较及生存分析
肿瘤组与正常组HAPLN3 mRNA 相对表达量分别为3.138(2.541,3.748)和1.565(1.137,2.400),经秩和检验,差异有统计学意义(H=14153.000,P=0.000),肿瘤组高于正常组。
G4 组、G3 组、正常组HAPLN3 mRNA 相对表达量分别为4.081(3.281,4.755)、3.591(2.923,4.182)和1.565(1.137,2.400),经秩和检验,差异有统计学意义(H=208.342,P=0.000)。进一步两两比较结果:G4 组HAPLN3 mRNA 相对表达量高于G3 组、正常组(P<0.05),G3 组HAPLN3 mRNA 相对表达量高于正常组(P<0.05)。
生存曲线结果显示,HAPLN3 高表达组与低表达组OS 比较,经Log-rank χ2检验,差异有统计学意义(χ2=8.673,P=0.003),HAPLN3 高表达组OS 低于低表达组,提示HAPLN3基因高表达与ccRCC 患者预后不良有关。G4 组与G3 组OS 比较,经Log-rank χ2检验,差异有统计学意义(χ2=33.063,P=0.000),G4 组OS 组低于G3 组,提示高级别ccRCC 可能预后更差。见图1。
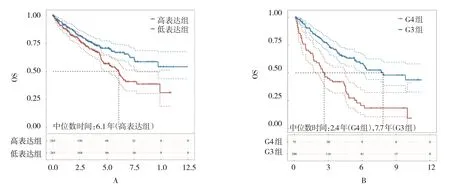
图1 各组Kaplan-Meier法绘制生存曲线
2.2 临床特征的单因素和多因素分析
预后模型构建以TCGA 数据库下载的肾癌患者年龄、临床分期、病理分级及HAPLN3 表达为自变量,总生存情况为因变量,通过单因素及多因素Cox回归分析筛选肾癌预后的独立危险因素。单因素Cox 回归分析结果表明,HAPLN3 高表达[=1.548(95%CI:1.325,1.801)]、高龄[=1.029(95%CI:1.016,1.042)]、高pT 分期[=1.923(95%CI:1.632,2.265)]、高pN分期[=3.425(95% CI:1.818,6.456)]、高pTNM分期[=1.867(95% CI:1.638,12.12)]、高Grade分级[=2.291(95% CI:1.870,2.806)] 是ccRCC 患者不良预后的影响因素(均P=0.000)。
列线图结果表明,用HAPLN3 表达量、年龄、pTNM 分期、Grade 分级构建的预后模型可以较好地预测ccRCC 患者的1 年、3 年、5 年OS,C 指数为0.779(95%CI:0.729,1.000)(P=0.000)。见图2。

图2 HAPLN3联合相关临床特征构建的列线图及校正曲线
2.3 HAPLN3 mRNA 相对表达量与免疫细胞亚型浸润水平的相关性
HAPLN3 mRNA 相对表达量与B 淋巴细胞、CD4+T 淋巴细胞、CD8+T 淋巴细胞、中性粒细胞、巨噬细胞、树突状细胞浸润呈正相关(rs=0.284、0.532、0.584、0.617、0.323 和0.620,均P=0.000),提 示HAPLN3 可能参与多种ccRCC 免疫细胞浸润调节。见图3。
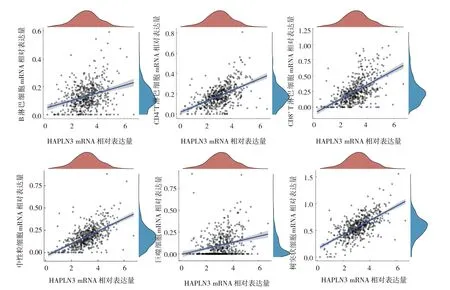
图3 HAPLN3 mRNA相对表达量与免疫细胞亚型浸润水平的相关性
2.4 HAPLN3 与免疫相关基因共表达分析及ccRCC免疫检查点分析
G4组与G3 组CD274、HAVCR2、PDCD1LG2、SIGLEC15 mRNA 相对表达量比较,经Wilcoxon 检验,差异无统计学意义(P>0.05)。G4 组与G3 组CTLA4、LAG3、PDCD1、TIGIT mRNA 相对表达量比较,差异有统计学意义(P<0.05),G4 组高于G3 组,提示高级别ccRCC 更易形成免疫逃逸。见图4、5 和表1。
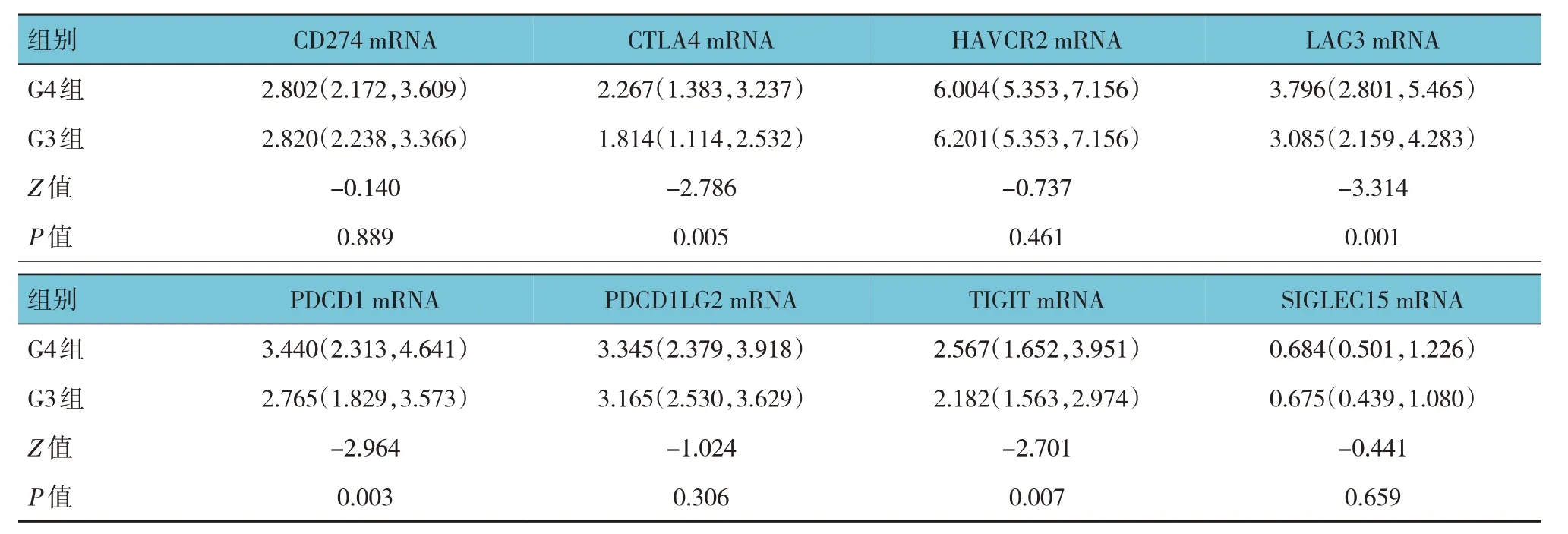
表1 两组疫检查点相关基因mRNA相对表达量比较 [M(P25,P75)]
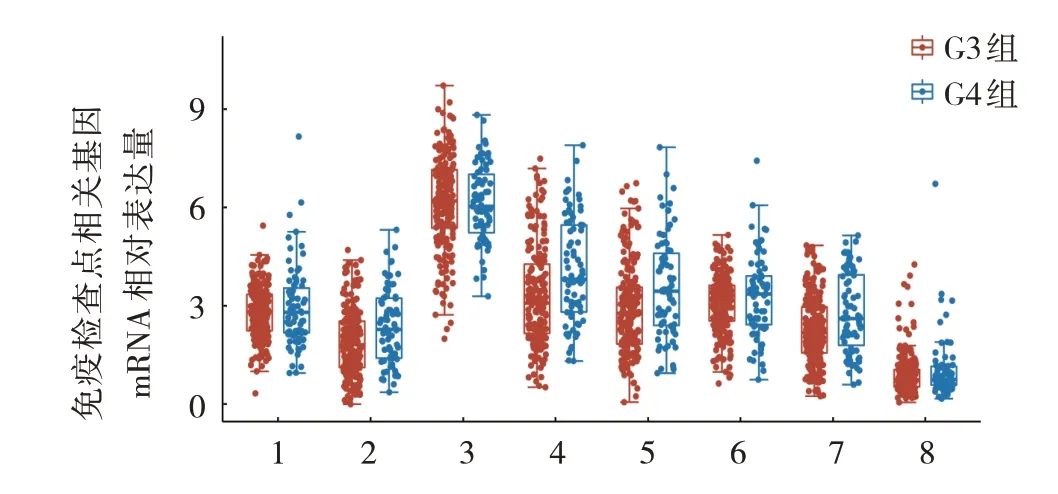
图4 两组免疫检查点相关基因mRNA相对表达量比较

图5 两组免疫检查点分析及免疫检查点ICB治疗TIDE评分
通过TIDE 算法得出G4 组、G3 组TIDE 评分分别为0.805(-0.148,1.385)分和0.260(-0.495,1.170)分,经Wilcoxon 检验,差异有统计学意义(Z=-2.482,P=0.013),G4 组高于G3 组,提示高级别ccRCC 患者行ICB 治疗效果更差。免疫抑制基因共表达分析结果表明,几乎所有免疫抑制基因也都与HAPLN3阳性共表达,上述结果提示HAPLN3可能是G4 组ccRCC潜在的免疫治疗靶点。见图6。
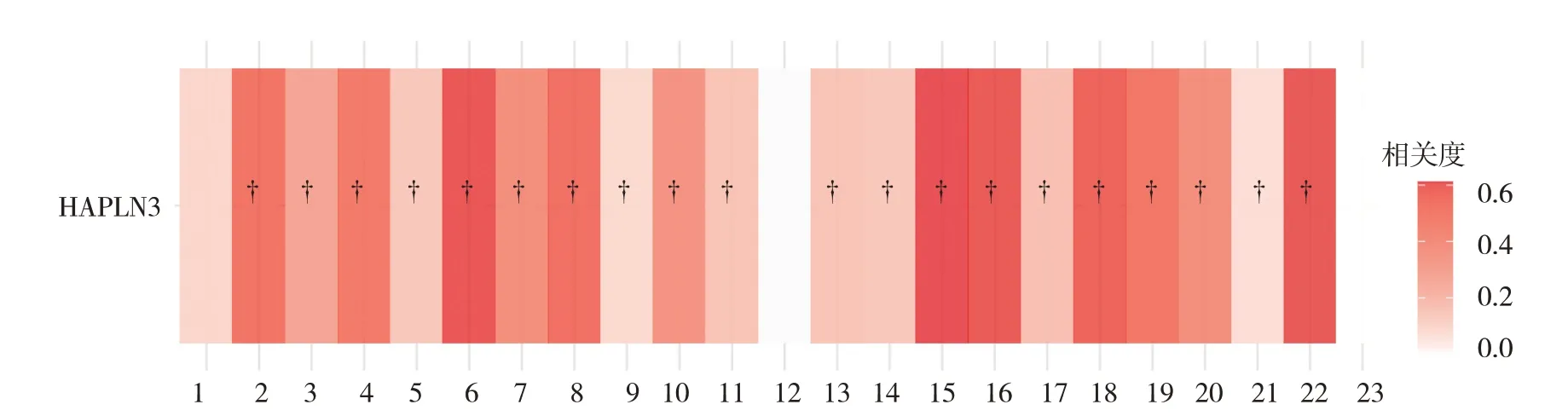
图6 HAPLN3与免疫抑制基因共表达情况
2.5 基于GSEA数据库完善ccRCC中HAPLN3通路富集分析
HAPLN3 高表达在多个免疫相关通路富集,包括细胞因子受体相互作用,NK 细胞介导的细胞毒性通路、趋化因子信号通路、JAK-STAT 信号通路、黏附分子Cam、T 细胞受体(T cell receptor,TCR)信号通路、B 细胞受体(B cell receptor,BCR)信号通路、MAPK 信号通路、Toll样受体(Toll-like receptors,TLR)信号通路、Notch 信号通路、Wnt 信号通路等。这些信号通路的发现表明HAPLN3 可能参与ccRCC的免疫相关通路,而TCR 信号通路尤其值得关注。见表2。
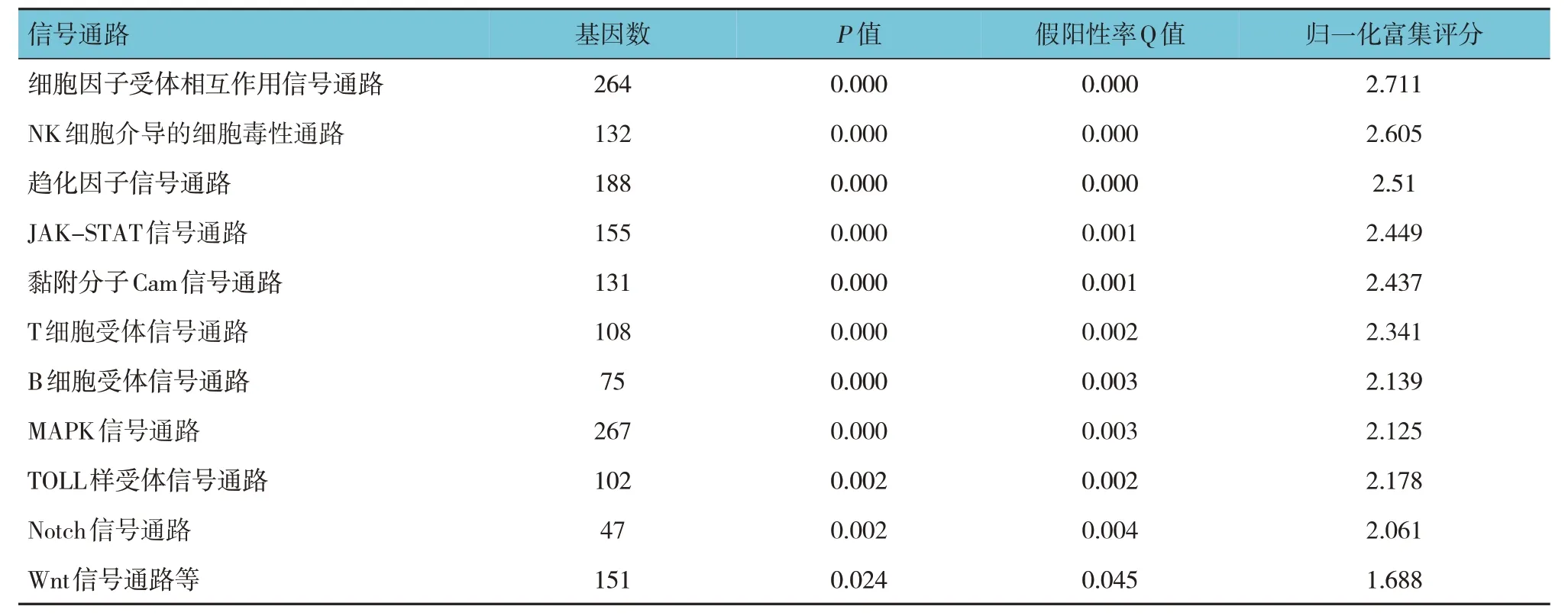
表2 HAPLN3在ccRCC相关通路富集分析
2.6 癌组织与癌旁组织HAPLN3蛋白的表达
HAPLN3 主要定位于细胞质,呈棕黄色(见图7)。癌组织、癌旁组织HAPLN3 阳性表达率分别为58%(29/50)和36%(18/50),经χ2检验,差异有统计学意义(χ2=4.857,P=0.028),癌组织HAPLN3 阳性表达率高于癌旁组织。
2.7 HK-2、OSRC-2、ACHN细胞 HAPLN3 mRNA和蛋白相对表达量比较
HK-2、OSRC-2、ACHN细胞HAPLN3 mRNA 相对表达量分别 为(1.00±0.11)、(1.30±0.08)和(1.75±0.13),经方差分析,差异有统计学意义(F=33.930,P=0.000);OSRC-2、ACHN细胞HAPLN3 mRNA 相对表达量高于HK-2 细胞(P<0.05)。
HK-2、OSRC-2、ACHN 细胞HAPLN3 蛋白相对表达量为(1.00±0.18)、(2.84±0.11)和(4.02±0.21),经方差分析,差异有统计学意义(F=235.3,P=0.000);OSRC-2、ACHN 细胞HAPLN 蛋白相对表达量高于HK-2 细胞(P<0.05)。见图8。

图8 HK-2、OSRC-2、ACHN细胞HAPLN3蛋白的表达
2.8 沉默HAPLN3对肾透明细胞癌增殖的影响
si-NC 组、si-HAPLN3 组OS-RC-2 细胞HAPLN3 mRNA相对表达量分别为(1.00±0.12)和(0.42±0.09),经t检验,差异有统计学意义(t=6.601,P=0.002),si-HAPLN3 组低于si-NC 组,说明细胞转染成功。
si-NC 组、si-HAPLN3 组ACHN细胞HAPLN3 mRNA 相对表达量分别为(1.00±0.14)和(0.44±0.08),经t检验,差异有统计学意义(t=5.847,P=0.004),si-HAPLN3 组低于si-NC 组,说明细胞转染成功。
si-NC 组、si-HAPLN3 组不同时间点OS-RC-2、ACHN 细胞的OD 值比较,采用重复测量设计的方差分析,结果:①不同时间点OS-RC-2、ACHN 细胞的OD 值有差异(F=481.158 和292.321,均P=0.000);②两组OS-RC-2、ACHN 细胞的OD 值有差异(F=27.471 和255.219,均P=0.002);③两组OS-RC-2、ACHN 细胞的OD 值变化趋势有差异(F=20.799 和11.301,P=0.017 和0.040)。见表3。
表3 两组不同时间点OS-RC-2、ACHN细胞的OD值比较()
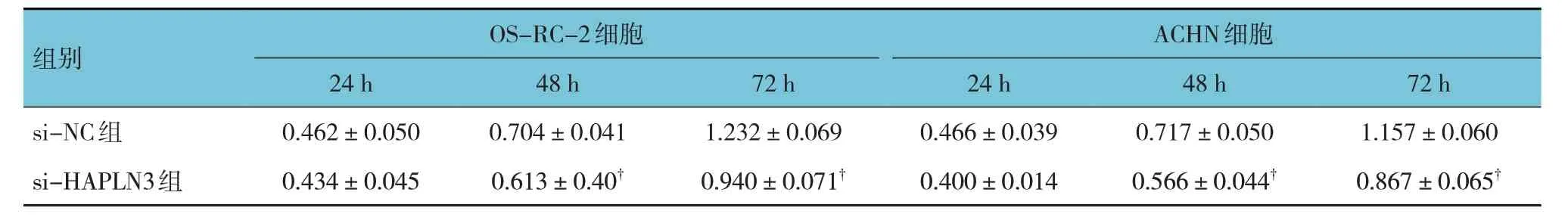
表3 两组不同时间点OS-RC-2、ACHN细胞的OD值比较()
注:†与si-NC组比较,P<0.05。
3 讨论
HAPLN3 作为透明质酸和蛋白多糖链接蛋白基因家族成员,是乳腺癌、前列腺癌及黑色素瘤等多种肿瘤的预后标志物[11-13]。尽管目前还没有研究报道HAPLN3 表达与ccRCC 的相关性,但多项文献证实透明质酸和蛋白多糖在不同程度上影响ccRCC 的进展、转移及预后[14],所以HAPLN3 在ccRCC 中的表达及其作用值得探究。
基于TCGA 数据库,笔者发现HAPLN3 在ccRCC中的表达高于正常肾脏。其结果在组织水平经IHC染色验证,在细胞水平经qRT-PCR 和Western blotting 实验验证,并通过CCK-8 法进一步验证沉默HAPLN3的ccRCC 细胞增殖能力下降,提示该基因可能与ccRCC 增殖有关。随后笔者通过TCGA 数据库分析HAPLN3 在不同WHO 分级亚组的表达,发现WHO 分级G4 组高于G3 组,提示HAPLN3 表达上调可能导致ccRCC 向更差的组织学分级进展,遗憾的是本实验未收集到G4 组标本,后期需加大病例数验证不同组织学分级间HAPLN3 的表达。生存分析结果表明,HAPLN3 高表达较低表达ccRCC 患者的OS低,提示HAPLN3 可能与ccRCC 患者预后不良有关。通过单因素和多因素Cox 回归分析发现HAPLN3、年龄、pTNM、Grade 分级是ccRCC 患者不良预后的独立影响因素。
免疫靶向治疗逐渐成为晚期肾癌新的治疗方式[15],且细胞外基质与免疫微环境关系密切[16],故选用TIMER 2.0 数据库来研究HAPLN3 表达与免疫细胞的相关性,结果表明HAPLN3 mRNA 相对表达量与B 淋巴细胞、CD4+T 淋巴细胞、CD8+T 淋巴细胞、中性粒细胞、巨噬细胞、树突状细胞浸润呈正相关,提示HAPLN3 可能参与ccRCC 免疫细胞浸润调节。进一步分析发现HAPLN3与多种免疫检查点呈阳性共表达,包括CTLA4、LAG3、PDCD1 和TIGIT,这些免疫检查点在近年来是晚期ccRCC 的新兴治疗研究热点[17],故后续探究HAPLN3与明星免疫检查点的关系很有意义。结合HAPLN3 在ccRCC 不同WHO 分级中的差异表达、免疫检查点分析及TIDE 评分,笔者猜测HAPLN3 表达上调影响免疫抑制基因的功能,从而造成组织学分级较差的ccRCC 不能在ICB治疗中获得较好的疗效,提示HAPLN3 可能成为高级别ccRCC 潜在的免疫治疗靶点,以及成为ICB 治疗的预测指标。
GSEA 数据库分析结果显示,HAPLN3 在ccRCC中与TCR 信号通路、BCR 信号通路、NK 细胞介导的细胞毒性通路、TLR 信号通路等免疫相关信号通路富集。KRISHNA等[18]单细胞测序TCR 轨迹分析结果表明,ICB 治疗在有反应与耐药患者之间存在不同的T 淋巴细胞分化途径,然而暂无BCR 与肾癌进展的相关研究。有研究表明,ccRCC 中有NK 细胞浸润,但是随着肿瘤进展,可能出现功能障碍[19]。TLR是连接非特异性免疫与特异性免疫的桥梁。MORIKAWA等[20]研究表明,TLR3 在ccRCC中过表达,TLR3 通路可能代表CCRCC 新的治疗靶点。另外本研究结果表明,HAPLN3基因在细胞因子受体相互作用信号通路、趋化因子信号通路、JAK-STAT信号通路、黏附分子Cam 信号通路、MAPK 信号通路、Notch 信号通路、Wnt 信号通路等癌症相关通路富集。
本研究结果表明,HAPLN3基因在ccRCC 细胞中高表达,且与肿瘤细胞增殖有关,通过该基因构建的临床预后模型可较好地预测患者1 年、3 年和5 年总生存率。HAPLN3基因在ccRCC 中与免疫细胞浸润、免疫相关检查点存在相关性,并且可能通过多种肿瘤免疫机制促进ccRCC 的发生、发展。HAPLN3 有作为ccRCC 免疫治疗靶点的潜在价值。
