静脉注射激素对合并2型糖尿病的重度慢性阻塞性肺疾病急性加重期患者疗效及安全性
2022-11-30彭妙官邓雪峰
彭妙官 邓雪峰
1广州医科大学附属第三医院内分泌科(广州 510140);2广州医科大学附属第一医院老年科(广州 510120)
我国一项2012年6月至2015年5月期间在10个省、自治区和直辖市纳入50 991例的横断面研究显示,40岁以上人群慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)患病率为 13.7%[1]。COPD已成为我国重要的公共卫生问题[2]。重度慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)是指患者病情急剧恶化,需要改变治疗方案[3],方案中常包含糖皮质激素。糖皮质激素可升高血糖,但AECOPD的治疗中,激素尤其是静脉注射激素,能有效缓解病情。中-重度COPD患者接受静脉注射激素能减少气管插管和机械通气等情况[4]。然而,无论口服激素还是静脉途径应用激素,均可能导致高血糖等不良事件[5]。激素是双刃剑,既能有效缓解AECOPD病情,也会导致高血糖等副作用。COPD患者常伴发2型糖尿病(type 2 diabetes,T2DM)[6],高血糖状态又会导致 AECOPD 预后更差[7]。不同指南或共识对COPD激素治疗的给药途径、剂量和疗程存在不同看法。在合并T2DM的AECOPD患者中应用静脉注射激素的疗效及安全性更一直是内分泌科及呼吸科共同关注且颇具争议的热点话题。拟开展研究,在合并T2DM的重度AECOPD患者中对比口服激素和静脉注射激素的疗效和安全性。
1 资料与方法
1.1 研究对象COPD的诊断及气流受限严重程度分级参照《2021版慢性阻塞性肺疾病全球倡议指南》,即具有慢性咳嗽、咳痰及呼吸困难等临床症状,具有吸烟或职业暴露等危险因素,吸入支气管扩张剂后经肺功能检测,FEV1/FVC<70%可诊断为COPD。重度AECOPD的判断标准基于使用支气管扩张剂后的FEV1值,以测定FEV1(%predicted)进行气流受限严重程度分级,FEV1(%predicted)30~49定义为重度[8]。T2DM参照WHO1999年的
诊断标准[9]。研究对象为2013年1月至2018年8月住院的重度AECOPD患者。纳入标准:(1)符合重度AECOPD的标准;(2)目前服用2种及以上口服降血糖药物而血糖控制不良的T2DM患者,入院时任何一次空腹血糖≥11.1 mmol/L或糖化血红蛋白>9%;(3)患者自愿参加研究,签署知情同意书。排除标准:(1)T2DM以外的其他类型糖尿病;(2)对研究所用的药物(糖皮质激素)过敏或无法耐受;(3)糖尿病严重的急慢性并发症(包括DKA,HHS,乳酸性酸中毒等);(4)入院时已使用胰岛素治疗者;(5)研究者判断不适合入选的其他情况:活动性消化性溃疡、新近胃肠吻合术、肾上腺皮质功能亢进、血压控制不佳(血压>180/100 mmHg)、孕妇、癫痫及患有严重精神病的患者。排除不愿意参加研究、拒绝随访的患者,9例因依从性问题退出研究,最终纳入122例合并T2DM的AECOPD患者,按随机数字表法分为静脉注射激素治疗(观察组,n=67)和口服激素治疗(对照组,n=55),观察组男57例,女10例,平均年龄(69.7±5.0)岁,体质量指数(23.5±3.9)kg/m2,糖尿病平均病程(9.2±2.7)年;对照组男47例,女8例,平均年龄(69.5± 4.2)岁,体质量指数(23.3±3.2)kg/m2,糖尿病平均病程(9.2±2.1)年。本研究经医院医学伦理委员会审查并批准。
1.2 治疗方法观察组接受5 d的静脉注射甲泼尼松龙(每天40 mg)后改口服泼尼松20 mg/d,逐步减量,总疗程<14 d。对照组使用口服醋酸泼尼松40 mg/d,7 d后逐步减量至停药,总疗程<14 d。所有患者均给予综合治疗,包括氧疗、支气管舒张治疗、抗感染等;针对高血糖,给予胰岛素治疗,方案为睡前皮下注射甘精胰岛素+三餐前皮下注射门冬胰岛素。甘精胰岛素的调整方法参照《成人T2DM基础胰岛素临床应用中国专家指导建议(2020版)》[10],门冬胰岛素的调整参考《速效胰岛素类似物临床应用专家指导意见》[11]。设置血糖控制目标为空腹:4.4~7.0 mmol/L,餐后2 h:7.8~10.0 mmol/L。出院后根据患者胰岛功能调整为口服降血糖方案、基础胰岛素加口服降血糖(每天胰岛素总量<30 U者,出院时给予口服降血糖方案>30 U者,给予基础胰岛素加口服降血糖)。
1.3 观察指标
1.3.1 疗效评价指标采用改良英国医学研究学会呼吸困难指数(modified British medical research council,mMRC)和呼气峰流量(PEF)改善程度进行疗效评价,把疗效评价分为四类:无效、好转、显效与临床控制。mMRC分级如下:0级,剧烈活动出现呼吸困难;1级,平地快步行走/爬缓坡出现呼吸困难;2级,平地快步行走/爬缓坡比同龄人慢,需要休息;3级,平地行走100 m或数分钟后需停下喘气;4级,因严重呼吸困难无法离家/穿、脱衣服时即出现呼吸困难。0~4级分别对应0~4分。mMRC主要用于评估COPD患者呼吸困难的程度,0~1分视为症状少,≥2分为症状多。临床控制:出院前上述症状基本缓解,mMRC评分0~1分,PEF改善程度≥35%;显效:上述症状明显减轻,mMRC评分0~1分,25%≤PEF改善程度≤35%;好转:症状有所改善,mMRC评分0~1分,15%≤PEF改善程度≤24%;无效:症状未改善,mMRC评分≥2分,甚至出现加重,PEF改善量<15%。总有效率=好转率+显效率+临床控制率。
1.3.2 炎症因子水平早晨空腹采血送检验科行降钙素原(PCT)、超敏C反应蛋白(hs-CRP)检测。采用 Human IL1-β ELISA KIT、Human IL18 ELISA KIT(Solarbio,美国)试剂盒检测白细胞介素1β(IL-1β)、白细胞介素18(IL-18)。
1.3.3 肺功能指标肺功能观察采用肺功能仪(MS Diffusion型,德国耶格),包括第1秒用力呼气容积(FEV1)、第1秒用力呼气容积与用力肺活量比值(FEV1/FVC)、呼气峰流量(PEF)。
1.3.4 糖代谢指标患者入院时及出院前一天采血送医院检验科检测空腹血糖(FPG)、服馒头餐(100 g面粉做的馒头)后2 h血糖(2HPG)、糖化血红蛋白(HbA1c)。
1.3.5 不良反应的观察指标包括低血糖症(血糖<3.9 mmol/L)、消化道出血、上腹不适、呼吸道真菌感染以及恶心、呕吐等。出院后3个月,对患者进行回访,观察其不良反应。出院标准:(1)症状有所改善;(2)临床稳定24 h以上。
1.4 统计学方法使用SPSS 25.0软件进行分析,计量资料符合正态分布时以均数±标准差表示,治疗前后各指标比较采用配对t检验。组间的比较采用独立样本t检验。计数资料以例(%)表示,采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床特征研究纳入122例合并T2DM的重度AECOPD患者,其中男104例,女18例。两组患者的性别、平均年龄、体质量指数、糖尿病病程之间差异无统计学意义(性别:χ2=0.003,P=0.953;平均年龄:t=1.654,P=0.098;体质量指数t=1.630,P=0.103;糖尿病病程:t=-0.284,P=0.776)。观察组住院时长(11.2±2.0)d,胰岛素用量(84.42±3.22)U/d,对照组住院时长(14.1±2.2)d,胰岛素用量(50.61±2.84)U/d,两组之间住院时长和每天胰岛素用量均差异有统计学意义(住院时长:t=-27.146,P<0.001;每天胰岛素用量t=470.790,P< 0.001),见表1。
表1 临床特征Tab.1 Clinical features ±s
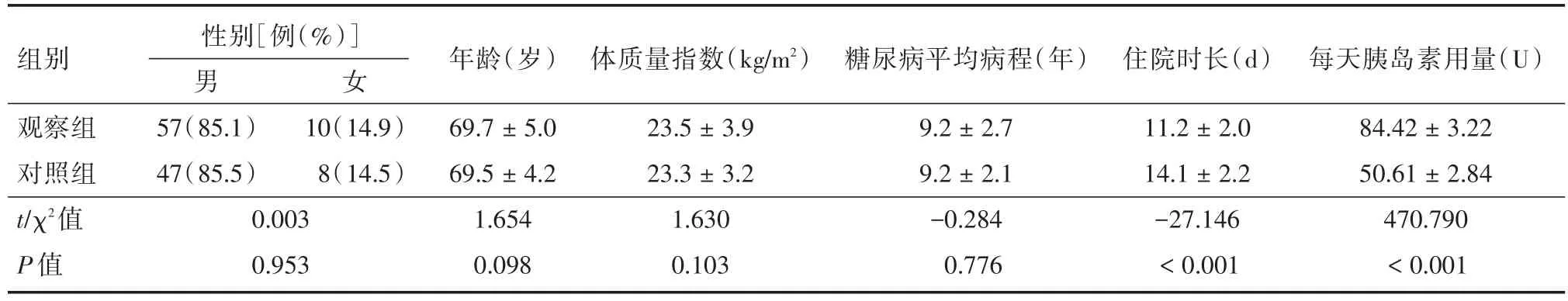
表1 临床特征Tab.1 Clinical features ±s
组别观察组对照组t/χ2值P值性别[例(%)]男57(85.1)47(85.5)0.003 0.953女 年龄(岁)69.7±5.0 69.5±4.2 1.654 0.098体质量指数(kg/m2)10(14.9)8(14.5)23.5±3.9 23.3±3.2 1.630 0.103糖尿病平均病程(年)9.2±2.7 9.2±2.1-0.284 0.776住院时长(d)11.2±2.0 14.1±2.2-27.146<0.001每天胰岛素用量(U)84.42±3.22 50.61±2.84 470.790<0.001
2.2 临床疗效的比较观察组总有效率为97.0%,对照组总有效率为87.3%,两组相比,差异有统计学意义(χ2=4.196,P=0.041),见表2。
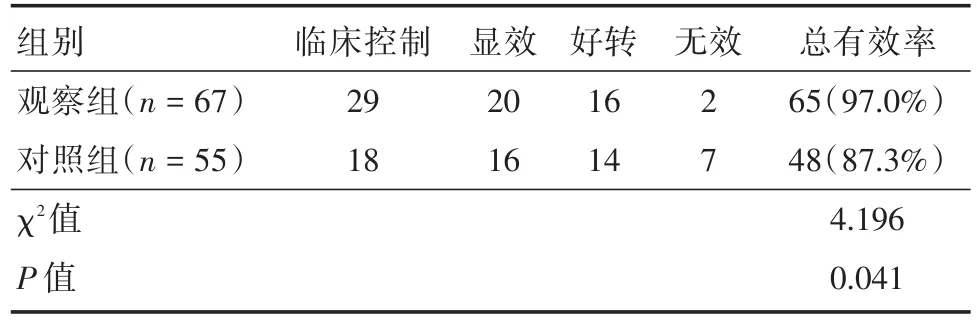
表2 两组患者疗效的比较Tab.2 Comparison ofefficacy between two groups 例
2.3 炎症指标入院时(基线时)两组患者IL-1β、IL-18、PCT和hs-CRP均差异无统计学意义(P>0.05)。出院时与入院时相比:两组患者治疗后IL-1β、IL-18、PCT和hs-CRP均比入院时降低,差异有统计学意义(观察组IL-1β:t=160.089,P<0.001;IL-18:t=387.181,P< 0.001;PCT:t=76.221,P<0.001;hs-CRP:t=319.199,P< 0.001;对照组 IL-1β:t=52.692,P< 0.001;IL-18:t=165.306,P<0.001;PCT:t=66.847,P< 0.001;hs-CRP:t=283.721,P<0.001)。见表3。
表3 炎症指标的比较Tab.3 Comparison of inflammatory markers ±s
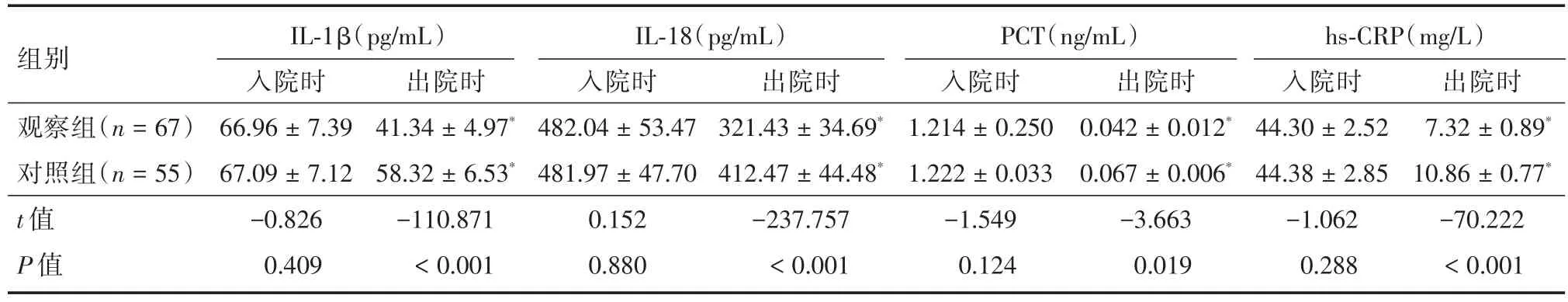
表3 炎症指标的比较Tab.3 Comparison of inflammatory markers ±s
注:*与入院时相比,差异有统计学意义,P<0.001
组别观察组(n=67)对照组(n=55)t值P值IL-1β(pg/mL)入院时66.96±7.39 67.09±7.12-0.826 0.409出院时41.34±4.97*58.32±6.53*-110.871<0.001 IL-18(pg/mL)入院时482.04±53.47 481.97±47.70 0.152 0.880出院时321.43±34.69*412.47±44.48*-237.757<0.001 PCT(ng/mL)入院时1.214±0.250 1.222±0.033-1.549 0.124出院时0.042±0.012*0.067±0.006*-3.663 0.019 hs-CRP(mg/L)入院时44.30±2.52 44.38±2.85-1.062 0.288出院时7.32±0.89*10.86±0.77*-70.222<0.001
2.4 血气分析指标入院时两组患者pH值、动脉氧分压(PaO2)、动脉二氧化碳分压(PaCO2)比较差异均无统计学意义(pH值:t=1.740,P=0.082;PaO2:t=0.769,P=0.442;PaCO2:t=0.130,P=0.897);出院时两组患者的pH值均有所回升,组间比较差异无统计学意义(t=-1.183,P=0.237)。治疗后出院时,观察组PaO2高于对照组(t=72.383,P< 0.001),PaCO2显著低于治疗前,差异有统计学意义(t=-33.952,P<0.001)。见表4。
表4 动脉血气分析指标的比较Tab.4 Comparison of artery blood gas analysis±s
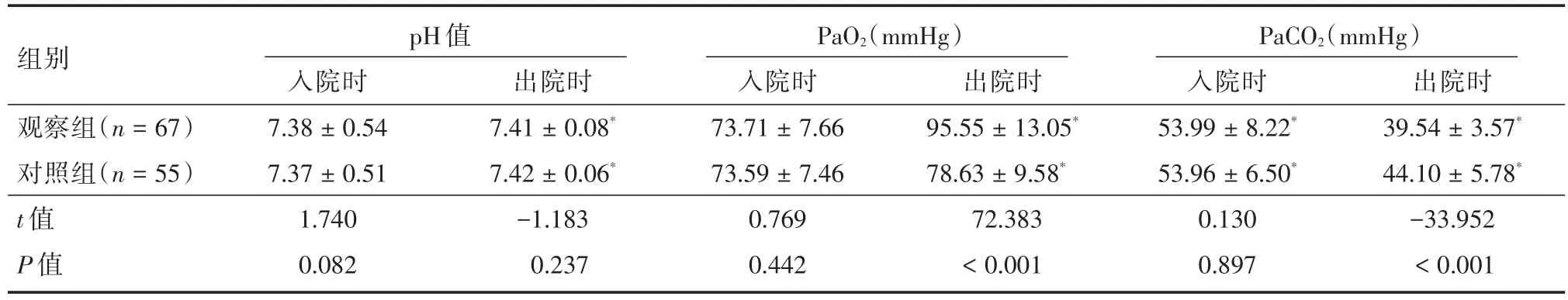
表4 动脉血气分析指标的比较Tab.4 Comparison of artery blood gas analysis±s
注:*对比入院时,治疗后出院时,两组患者PaO2高于治疗前,差异有统计学意义(观察组:t=-103.871,P<0.001;对照组:t=-26.575,P <0.001);两组患者的PaCO2显著低于治疗前,差异有统计学意义(观察组:t=84.391,P <0.001;对照组:t=57.850,P <0.001)
pH值组别观察组(n=67)对照组(n=55)t值P值入院时7.38±0.54 7.37±0.51 1.740 0.082出院时7.41±0.08*7.42±0.06*-1.183 0.237 PaO2(mmHg)入院时73.71±7.66 73.59±7.46 0.769 0.442出院时95.55±13.05*78.63±9.58*72.383<0.001 PaCO2(mmHg)入院时53.99±8.22*53.96±6.50*0.130 0.897出院时39.54±3.57*44.10±5.78*-33.952<0.001
2.5 肺通气功能指标两组患者入院时FEV1、FEV1/FVC、PEF的差异无统计学意义(FEV1:t=-1.183,P=0.238;FEV1/FVC:t=0.292,P=0.770;PEF:t=-1.402,P=0.163)。出院时,观察组与对照组相比,FEV1、FEV1/FVC、PEF的差异均有统计学意义(FEV1:t=12.256,P< 0.001;FEV1/FVC:t=93.978,P< 0.001;PEF:t=11.287,P< 0.001)。
2.6 糖代谢指标入院时、出院时及出院3个月时对患者进行回访,观察组与对照组之间FPG、2HPG、HbA1c的比较,差异无统计学意义(入院时FPG:t=1.235,P=0.217;2HPG:t=1.756,P=0.079;HbA1c:t=0.229,P=0.819;出院时FPG:t=1.235,P=0.217;2HPG:t=0.040,P=0.968;HbA1c:t=1.620,P=0.106;出院 3个月时 FPG:t=-1.155,P=0.249;2HPG:t=0.775,P=0.438;HbA1c:t=1.779,P=0.076)。见表6。
表5 肺通气功能指标的比较Tab.5 Comparison of lung ventilatory function ±s

表5 肺通气功能指标的比较Tab.5 Comparison of lung ventilatory function ±s
注:*对比入院时,治疗后出院时,两组FEV1、FEV1/FVC、PEF治疗后均上升,差异有统计学意义(观察组FEV1:t=-19.177,P<0.001;FEV1/FVC:t=-137.154,P < 0.001;PEF:t=-18.008,P < 0.001。对照组FEV1:t=-8.578,P < 0.001;FEV1/FVC:t=-33.855,P < 0.001;PEF:t=-3.948,P < 0.001)
组别观察组(n=67)对照组(n=55)t值P值FEV1(L)入院时1.58±0.40 1.64±0.35-1.183 0.238出院时2.74±0.51*1.88±0.67*12.256<0.001 FEV1/FVC(%)入院时59.13±4.46 59.09±5.64 0.292 0.770出院时80.34±8.74*63.95±6.10*93.978<0.001 PEF(L/S)入院时1.71±0.36 1.81±0.57-1.402 0.163出院时2.67±0.47*2.08±0.37*11.287<0.001
表6 两组患者糖代谢相关指标的比较Tab.6 Comparison of glucose metabolism related indexes between groups ±s
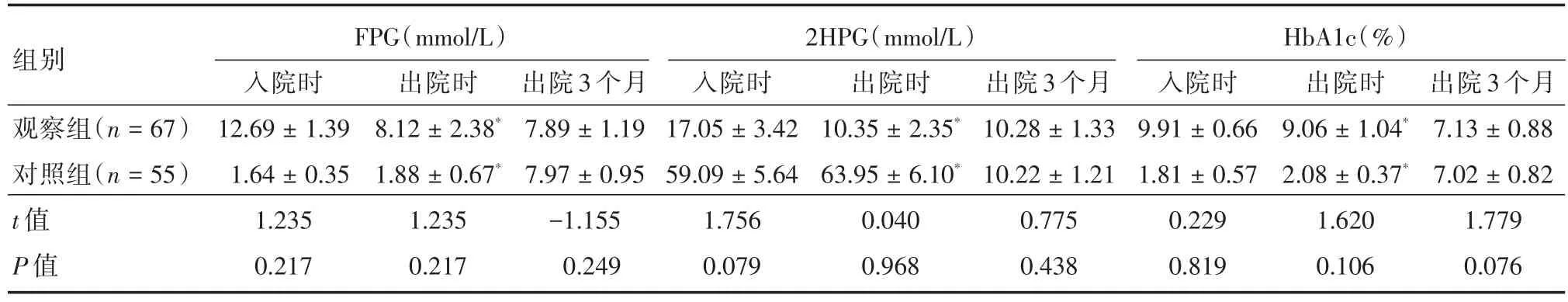
表6 两组患者糖代谢相关指标的比较Tab.6 Comparison of glucose metabolism related indexes between groups ±s
注:*对比入院时,两组出院时FPG、2HPG、HbA1c均下降,差异有统计学意义(观察组FPG:t=44.471,P < 0.001;2HPG:t=44.223,P <0.001;HbA1c:t=17.571,P < 0.001;对照组FPG:t=68.849,P < 0.001;2HPG:t=41.894,P < 0.001;HbA1c:t=9.459,P < 0.001)
组别观察组(n=67)对照组(n=55)t值P值FPG(mmol/L)入院时12.69±1.39 1.64±0.35 1.235 0.217 HbA1c(%)2HPG(mmol/L)入院时17.05±3.42 59.09±5.64 1.756 0.079出院时8.12±2.38*1.88±0.67*1.235 0.217出院3个月7.89±1.19 7.97±0.95-1.155 0.249出院时10.35±2.35*63.95±6.10*0.040 0.968出院3个月10.28±1.33 10.22±1.21 0.775 0.438入院时9.91±0.66 1.81±0.57 0.229 0.819出院时9.06±1.04*2.08±0.37*1.620 0.106出院3个月7.13±0.88 7.02±0.82 1.779 0.076
2.7 不良反应指标两组患者在治疗前后和出院后3月均无发生低血糖症(血糖<3.9 mmol/L)、消化道出血、上腹不适、呼吸道真菌感染以及恶心、呕吐,两组均无出现血钠、血钾及肌酸激酶异常,两组患者均无出现神经、精神异常症状。
3 讨论
AECOPD患者T2DM患病率高于普通人群,在澳大利亚,AECOPD住院患者的T2DM诊断率约为22%[12],瑞士为 18%[13],中国台北为 22%[14],印度甚至高达40%[15]。中国医科大学附属第一医院呼吸与危重医学科纳入196例AECOPD住院患者,T2DM的总体患病率为26%[16]。合并症T2DM的存在不应改变AECOPD的治疗,T2DM本身也应接受积极治疗[8]。同时,需要意识到缓解AECOPD措施中的糖皮质激素会加重糖代谢紊乱。T2DM与AECOPD两种疾病本身之间的关系密切,相互加重,高血糖对肺功能可产生不利影响[17],是AECOPD预后相关独立危险因子[18]。良好的血糖控制是改善AECOPD患者预后的重要因素。对于AECOPD,不同的指南或共识推荐口服糖皮质激素30~50 mg/d,不超过14 d,并逐步减量。慢阻肺全球策略(2021 GOLD报告)和中华医学会呼吸分会慢阻肺诊治指南(2021年修订版)推荐应用泼尼松40 mg/d,治疗 5 d[19]。对于激素的使用疗程,已有不少的循证医学证据,REDUCE研究表明,口服激素的5 d治疗效果,不亚于14 d,而且还缩短了住院时间[20]。本研究激素的使用时长参考了该结论。临床实践中,针对AECOPD,是优先采取口服激素治疗,还是静脉注射激素治疗并无定论,总体而言,使用小剂量、短疗程是常用的方法,近来也有研究建议血嗜酸性粒细胞作为指导使用糖皮质激素的指标[21]。口服激素与静脉注射激素在一些研究中体现出类似的疗效[22],但这些研究纳入的研究对象偏向于轻症患者。在重度COPD患者中,相对于静脉注射激素治疗,口服激素治疗可能出现病情恶化,需气管插管和机械辅助通气,选用静脉注射激素可能更为适宜[7]。激素是有效缓解AECOPD病情的手段。然而,糖皮质激素会加重胰岛素抵抗,升高血糖。口服激素与静脉激素治疗均能改善AECOPD患者的临床结局,但会增加不良事件的发生几率[23]。芬兰的调查研究显示,治疗方案包含吸入β2受体激动剂和口服糖皮质激素的AECOPD患者,高血糖患病率高达82%[24]。全国多中心研究显示,AECOPD住院患者约90.17%应用激素,其中雾化和全身联合激素占40.51%,单独使用雾化激素占38.00%,全身单独使用激素占15.45%[21]。AECOPD激素治疗一直是学术界争论的热点话题,激素对血糖的影响是不容忽视的临床问题,如何应对激素导致血糖波动,是不容忽视的问题。在合并T2DM的AECOPD患者中应用静脉和口服激素的疗效及安全性尚缺乏相关的研究。本研究针对上述科学问题开展研究,结果提示:静脉注射激素治疗合并T2DM的AECOPD能够提高治疗有效率,改善PaO2水平,改善肺功能。
本研究中选用的静脉注射激素甲强龙(甲泼尼龙琥珀酸钠)与口服激素强的松(醋酸泼尼松龙)均属于中效糖皮质激素,但静脉注射激素在治疗效果上显示更优,可能因为静脉给药可更快地达到血药浓度;AECOPD患者经常合并肺动脉增高,右心功能衰竭,导致肝功能不全,静脉注射激素甲泼尼龙属于活性药物,不需要经过肝脏代谢为活性产物,口服激素强的松需要经过肝脏代谢为活性产物,因此对于AECOPD合并肝功能不全的情况下,选择静脉注射激素更有效;静脉注射激素甲泼尼龙的化学结构含有的甲基,能减少水钠潴留等不良反应发生;甲强龙是唯一可用于冲击疗法的激素,因为它与激素受体的结合率显著高于其它糖皮质激素药物(约是醋酸泼尼松的23倍),起效时间更快,可以迅速抑制酶的活性,并使激素特异性受体达到饱和[19],可快速控制症状而不增加不良反应的发生率。本研究在同步使用胰岛素控制血糖的情况下,未发现血糖大幅度波动及血糖恶化的情况,提示静脉注射激素对于伴发T2DM的重度AECOPD患者的血糖是可控的。
从病理生理角度分析,激素可能通过抑制机体炎症反应而缓解重度AECOPD的病情。AECOPD患者合并T2DM时,高血糖状态可刺激机体出现炎症反应,体内炎症因子水平升高可导致肺功能损伤[25]。糖皮质激素可抑制机体固有免疫系统和适应性免疫系统而产生强效的抗炎作用,减少一系列炎症因子的产生,包括IL-1、IL-6、TNF-ɑ等[26]。糖皮质激素能够抑制炎症初期的白细胞游走和淋巴细胞浸润,减轻炎症反应[27],抑制IL-1等细胞因子[28]。AECOPD患者应用全身激素能够减轻气道乃至全身炎症反应,促进病情康复,改善肺功能及提升氧合指数,缓解症状,缩短住院时长[29]。本研究发现,AECOPD患者接受静脉注射激素或口服激素均使IL-1β、IL-18、PCT和hs-CRP等炎症相关指标下调,而静脉注射激素治疗者下降更为明显。提示激素可能通过抑制炎症因子而改善肺功能状态。本研究静脉注射激素组降低炎症因子更为显著,与静脉注射激素改善AECOPD患者肺功能的结论一致。
本研究存在一定的局限性,例如激素给药途径仅仅对比了口服激素与静脉注射激素,未单独与吸入激素(ICS)进行对比;血糖指标选取了血浆葡萄糖作为观察指标,而未引入动态血糖监测系统及血糖管理的“新”目标——目标范围内时间(time in range,TIR);治疗T2DM未采用持续皮下胰岛素输注(CSII),也未对比多次胰岛素皮下注射和CSII的效果差异;所观察的不良反应事件较少,没有包括骨密度检查,缺乏远期(3个月以后)随访指标等。将来需深入探讨CSII在合并T2DM的重度AECOPD中的控糖效果,通过TIR评估血糖管理目标,并评估不良事件及远期疗效。
综上所述,合并T2DM并非AECOPD应用静脉注射激素的绝对禁忌证,在同步使用胰岛素控制血糖的基础上,在重度患者中应用静脉注射激素并未引起血糖大幅度升高。
