HBV pgRNA表达水平与慢性乙型肝炎患者核(苷)酸类似物治疗反应性的相关性
2022-11-30朱雪丽林照坤王丽芸
朱雪丽 林照坤 王丽芸
海南医学院第一附属医院感染科(海口 570102)
慢性乙型病毒性肝炎(chronic hepatitis B,CHB)是目前呈世界性流行的感染性疾病之一,而我国一般人群中CHB流行率为5%~6%,是全世界CHB流行率靠前的国家之一[1-2]。目前CHB患者早期开展核(苷)酸类似物(nucleotide analogs,NAs)治疗是国内外多个指南中共同推荐治疗方式之一,这一方式对改善CHB患者预后,延长生存周期有积极的意义[3-4]。但也有相关研究结果显示,部分患者可能由于感染乙肝病毒的特殊性或自身基因作用下导致对NAs反应效果欠佳,需要尽早进行其他抗病毒治疗方式避免病毒大量复制带来的严重后果[5]。由于目前临床上NAs类药物种类繁多,如果针对所有NAs药物进行耐药相关基因检测价格高昂;而通过临床药物治疗反应来确定药物疗效不佳又耗时较长,以上两种方案对于制定特殊种类CHB患者治疗方案参考方式可行性不高,故临床上急需一类临床指标对CHB患者NAs治疗效果进行预测[6]。HBV前基因组RNA(HBV pre-genomic RNA,HBV pgRNA)是HBV共价闭合环状DNA(Covalently closed circular DNA,cccDNA)复制启动的首个RNA,对于体内cccDNA活性具有较好的反应作用,已经有研究指出HBV pgRNA与CHB患者体内HBsAg及HBeAg改变情况存在相关性[7]。故本次研究将其运用于评价HBV患者NAs治疗反应,旨在为寻找更加便捷的CHB患者治疗方案评价方法。
1 资料与方法
1.1 一般资料选择2020年1月至2021年6月在我院门诊确诊的CHB患者作为研究对象。纳入标准:(1)符合《慢性乙型肝炎防治指南(2019年版)》中对于CHB的诊断标准,同时达到NAs治疗相关标准[8];(2)年龄≥ 18周岁;(3)患者及家属签署知情同意书,并确定不会接受其他治疗方案;(4)首次接受抗CHB治疗。排除标准:(1)合并有肝硬化;(2)合并其他短期内不可治愈的肝脏疾病(如:自身免疫性肝炎、脂肪性肝病及其他类型病毒性肝炎等);(3)合并恶性肿瘤疾病;(4)需要长期口服可能造成肝肾功能损伤的药物;(5)预计生存期限达不到治疗周期;(6)依从性较差,不能完成病毒控制方案。符合上述条件并报我院伦理委员会审核通过后共计纳入CHB患者237例。其中平均年龄(37.49±6.54)岁;男135例,女102例。
1.2 方法
1.2.1 NAs治疗方案参考《慢性乙型肝炎临床治愈(功能性治愈)专家共识》中相关治疗标准,建议对首次开始NAs治疗方案患者选择药物为恩替卡韦(entecavir,ETV)、富马酸替诺福韦酯(tenofovir disoproxil fumarate,TDF)及富马酸丙酚替诺福韦(tenofovir alafenamide fumarate,TAF),并针对可能发生NAs应答不佳方案评价标准,本研究治疗周期为24周[9]。
1.2.2 治疗期间复诊方法要求患者每4周到院复查一次丙氨酸氨基转移酶(ALT)、乙型肝炎病毒DNA定量、HBsAg定性及HBeAg定性。
1.2.3 HBV pgRNA检测所有患者抽取清晨空腹静脉血后分离血清,而后使用DP438型磁珠法病毒RNA提取试剂盒(北京天根生化科技有限公司生产)对血清内HBV-RNA进行提取,而后使用K1622型cDNA逆转录试剂盒(ThermoFisher公司生产)对其中的HBV pgRNA片段(引物序列:5'-ATTCTCAGACCGTAGCACACGACACCGAGATTGAGATCTTCTGCGCGAC-3')转录为cDNA,最后使用Prism 7500序列检测系统(ABI公司生产)和Taq-Man探针通过实时荧光定量PCR对样本内的HBV pgRNA浓度进行检测。其中,HBV pgRNA对比引物序列(F:5'-ATTCTCAGACCGTAGCACACGACACCGAGATTGAGATCTTCTGCGCGAC-3';R:5'-AYAGACCATCAAATGCCC-3');HBV pgRNA检测引物及探针序列(F:5'-AYAGACCATCAAATGCCC-3',R:5'-ATTCTCAGACCGTAGCACACGACACCGAGATTGAGATCTTCTGCGCGAC-3',探针:5'-FAMCTTATCAACACTTCCGGARACTGTTGTTAGACBHQ1-3');PCR反应混体系(20 μL):10 μL 预混液,1 μL cDNA,1 μL 引物,0.25 μL TaqMan探针,而后加蒸馏水配齐;反应过程:预变性(45℃,10 min),然后以变性(95℃,15 s),退火(60℃,1 min),延伸(72℃,20 s)进行40个循环。
1.3 观察指标及评价标准
1.3.1 NAs治疗反应性评价标准根据《慢性乙型肝炎临床治愈(功能性治愈)专家共识》中相关标准[9],结合临床实践经验暂定NAs反应性为病毒学完全应答、部分应答和应答不佳三个标准,具体如下:(1)病毒学完全应答(以下简称完全应答)治疗结束后血清HBV-DNA达到检测下限;(2)病毒学部分应答(以下简称部分应答)治疗结束后血清HBV-DNA较基线下降幅度>2 lg IU/mL,但仍然可以检测到;(3)病毒学应答不佳(以下简称应答不佳)治疗结束后血清HBV-DNA较基线下降幅度<2 lg IU/mL。
1.3.2 临床资料包括:年龄、性别构成、BMI、饮酒史、NAs方案、高血压、糖尿病。
1.3.3 实验室检查资料均为基线指标,包括:ALT、天门东氨酸转移酶(AST)、总胆红素(TBiL)、HBsAg定量、HBeAg定量、HBeAb定量、HBcAb定量、HBV-DNA、肝纤维化 4因子指数(FIB-4)、HBV pgRNA。
1.4 统计学方法数据处理采用SPSS 25.0软件。计数资料以例(%)表示,组间比较采用χ2检验,等级资料采用Kruskal-WallisH检验;计量资料以()表示,符合正态分布的三组间比较采用方差分析,两组间比较采用独立样本t检验,不符合正态分布的组间比较采用Mann-WhitneyU检验;通过logistic回归分析治疗反应的影响因素,预测价值通过构建ROC曲线进行,使用曲线下面积(Area under the curve,AUC)对预测价值进行表示;P<0.05时差异有统计学意义。
2 结果
2.1 分组情况及各组患者一般资料比较截止2021年12月所有患者治疗期满,共计207例患者完成本次研究规定的治疗及随访方案,完成率为87.34%,其中87例(42.28%)患者达到完全应答,79例(38.16%)达到部分应答,41例(19.81%)患者为应答不佳,故最终分组为完全应答(n=87)、部分应答(n=79)及应答不佳(n=41)。比较三组患者一般资料,差异无统计学意义(P>0.05),见表1。
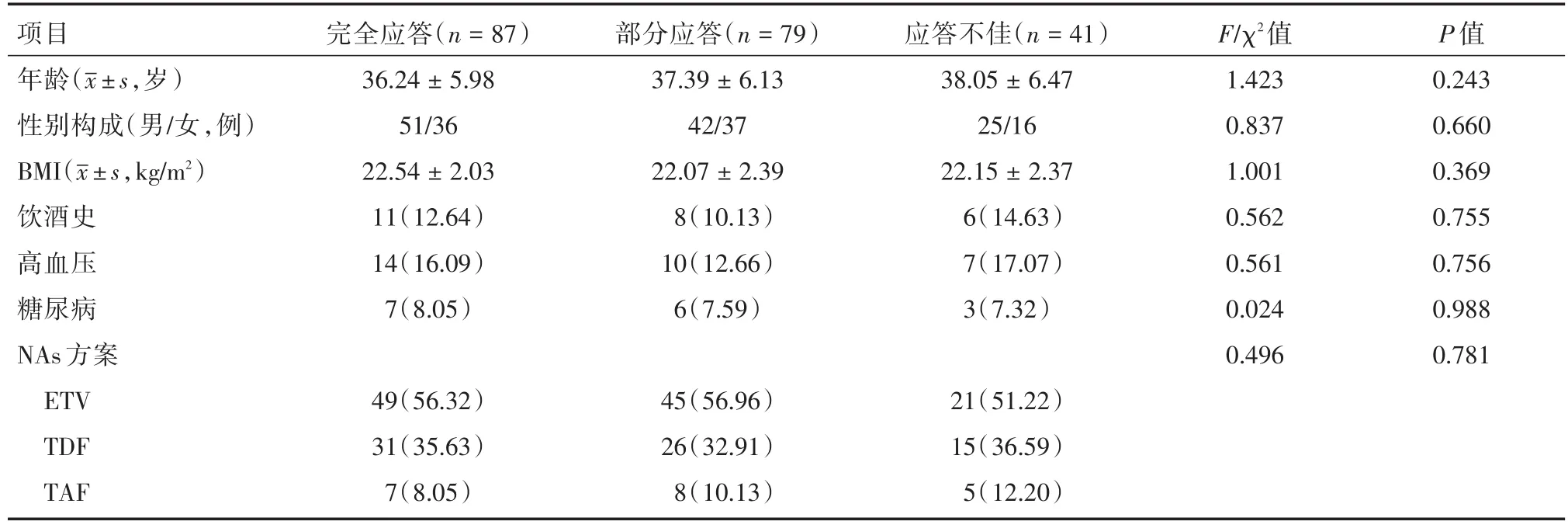
表1 三组患者一般资料比较Tab.1 Comparison of general data of three groups of patients 例(%)
2.2 三组患者实验室检查资料比较三组患者间HBV-DNA、HBV pgRNA、HBsAg、HBeAg及HBeAb差异有统计学意义(P<0.05);组间比较结果显示:应答不佳组患者HBV-DNA、HBV pgRNA、HB-sAg、HBeAg均高于其他两组,而HBeAb低于其他两组,差异有统计学意义(P<0.05);部分应答组HBV pgRNA高于完全应答组,差异有统计学意义(P<0.05);而部分应答组和完全应答组患者HBVDNA、HBsAg、HBeAg及HBeAb比较差异无统计学意义(P>0.05),见表2。
表2 三组患者实验室检查资料比较Tab.2 Comparison of laboratory examination data of three groups of patients±s

表2 三组患者实验室检查资料比较Tab.2 Comparison of laboratory examination data of three groups of patients±s
注:与完全应答组比较,*P<0.05,与部分应答组比较,#P<0.05
项目ALT(U/L)AST(U/L)TBiL(μmol/L)HBV-DNA(lg UI/mL)FIB-4 HBV pgRNA(lg拷贝/mL)HBsAg(lg UI/mL)HBeAg(S/CO)HBeAb(S/CO)HBcAb(S/CO)完全应答(n=87)77.34±12.78 34.15±7.53 22.37±5.98 6.04±1.01 0.97±0.23 4.23±0.97 2.74±0.63 1.07±0.25 4.04±0.78 0.53±0.19部分应答(n=79)79.63±13.24 35.04±7.67 23.04±4.32 6.54±1.27 0.99±0.21 4.74±1.01*2.89±0.54 1.15±0.23 3.89±0.65 0.47±0.21应答不佳(n=41)79.57±16.03 36.21±8.43 23.43±6.13 6.94±1.34*#0.98±0.14 5.21±1.09*#3.04±0.63*#1.24±0.27*#3.61±0.52*#0.51±0.24 F/χ2值0.698 1.022 0.619 8.710 0.193 14.045 3.947 7.313 6.997 1.746 P值0.499 0.369 0.539<0.001 0.825<0.001 0.021 0.001 0.001 0.177
2.3 治疗反应的相关因素分析以NAs治疗反应为因变量,以单因素分析P<0.05的指标作为自变量进行有序logistic回归分析,结果显示:HBVDNA、HBV pgRNA、HBsAg、HBeAg是影响治疗反应的独立危险因素,而HBeAb是影响治疗反应的独立保护因素(P<0.05),见表3。
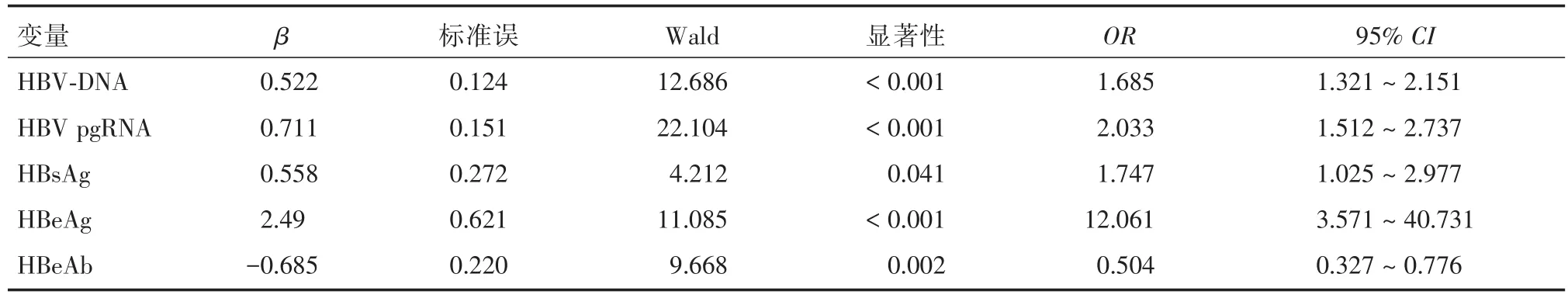
表3 治疗反应的相关因素分析Tab.3 Analysis of related factors of treatment response
2.4 各指标对治疗反应预测价值分析将反应为完全及部分应答患者归为有反应,而应答不佳患者归为无反应,而后以logistic回归分析存在差异的指标作为预测指标建立预测治疗反应的ROC曲线,结果显示HBV pgRNA对NAs治疗反应预测的AUC明显优于其余四个指标(P<0.05),见表4、图1。

表4 各指标对治疗反应预测价值Tab.4 The predictive value of each index on treatment response
3 讨论
通过人体免疫学及病毒学生物标志物对治疗起始、临床治愈或治疗失败进行预测是目前临床上针对CHB患者亟待解决的问题[10]。现有的CHB患者生物学标志物中,HBsAg定量、HBeAg定量、HBV-DNA、HBV-cccDNA及HBV pgRNA已经被证实与CHB患者相关抗体-抗原血清学转换、病毒载量及病情密切相关的指标,故在上述指标中寻找预测CHB治疗效果参照物的可行性较好[11-12]。
本次研究结果中,三组患者间HBV-DNA、HBV pgRNA、HBsAg、HBeAg及HBeAb存在显著差异,但是组间比较分析显示,仅HBV pgRNA在完全应答与部分应答组患者间存在差异。主要原因可能是由于HBV pgRNA是反应HBV病毒载量及活动性效果最佳的指标。在本次研究中,所采用的基线HBV抗原、抗体指标在治疗前对完全应答及部分应答的CHB患者比较上并无显著差异,说明在治疗前血清抗原、抗体指标对于疗效的评价作用有限。同时过长期临床实践发现,CHB相关抗原-抗体在经过治疗后发生转换的概率较低,在AGARWAL等[13]的研究中,经过48周单药NAs治疗后,仅有1%的患者发生HBsAg血清学转换,HBeAg转换率也仅在10%,故通过抗原-抗体相关指标进行疗效评价有着花费时间长、效率低的特点,对于NAs反应的预测效果可能不佳。而对于三组患者基线HBV-DNA的研究结果也提示,此指标在完全应答组与部分应答组比较无显著差异。既往研究中指出,HBV-DNA虽然是反应CHB患者HBV病毒载量的主要指标,绝大部分患者在HBV-DNA持续转阴较长时间后,并不会出现HBsAg转阴达到临床治愈的情况,这充分说明HBV-DNA指标对于CHB患者病情的反应存在缺陷[14-15]。通过研究发现,HBV病毒进入肝细胞后会形成HBV-cccDNA,而HBV-cccDNA是诱导HBV病毒复制的核心因素[16]。目前临床常用的NAs对于HBV-cccDNA的作用几乎不存在,其含量升高会导致HBV病毒大量复制,从而降低NAs对HBV病毒杀伤效果[17]。由此可见虽然目前临床上将HBV-DNA作为病毒学疗效的评价标准,但此指标的基线值对于CHB患者病毒量反应的效能会因为HBV-cccDNA存在而发生偏倚,这也是目前临床CHB治疗过程中病毒学复发、临床复发率居高不下的重要原因。
在多因素分析中,HBV-DNA、HBV pgRNA、HBsAg、HBeAg及HBeAb均是影响NAs治疗反应情况的独立影响因素,但在ROC曲线结果显示,HBV pgRNA预测的AUC明显高于其他4个指标。HBV-DNA及其他3个抗原、抗体指标对CHB患者疗效分析的局限性在前一段已经叙述,故在此不再赘述。而分析HBV pgRNA对CHB患者预测的优势主要有以下几个方面:首先,HBV pgRNA是HBV-cccDNA启动时复制的第一个片段,对于之后的HBV-DNA含量存在着明显的影响,其对与HBV的特异性较好[18-19];其次,HBV-cccDNA作为共存于人体的基因片段,其本身活性对于HBV-DNA含量存在影响,而HBV pgRNA由于其位置、特异性等因素,是HBV-cccDNA活性反应较好的指标之一,故其基线水平对于疾病发展过程中HBV-DNA复制情况也具有较好的反应[20-21]。通过以上研究不难发现HBV pgRNA由于其特异性及对HBV-cccDNA活性的区分作用,可以避免NAs治疗过程中未激活HBV-cccDNA及NAs敏感HBV-DNA对疗效的影响从而更好的判断NAs对CHB患者的治疗效果。
本次研究由于经费及时间限制,为单中心、小样本量研究,同时未将HBV-cccDNA指标纳入本次研究,故结果分析尚存在一定偏倚;再者为避免肝纤维化导致NAs治疗效果不明显的可能性,将合并肝纤维化及硬化患者排除了本次研究,导致对于所有CHB患者NAs反应预测存在一定局限性;最后由于目前临床研究对于HBV pgRNA检测方法尚未有统一性指导文件,故本次研究参考NCBI中Gene后采用的最原始的HBV pgRNA检测方式,导致推广到临床应用上存在实际困难。以上不足在今后的研究中会进一步改进,但不妨碍通过本次研究得出HBV pgRNA与CHB患者NAs治疗后反应显著相关的结论。
