不同农用酵素的微生物多样性和群落结构
2022-11-29范鹤龄朱清孙雪冰张丽李长江陈萍黄小龙张荣萍
范鹤龄,朱清,孙雪冰,张丽,李长江,陈萍,黄小龙,张荣萍*
(1.海南大学热带作物学院,海口 570228;2.海南大学园艺学院,海口 570228;3.海南大学生命科学与药学院,海口 570228)
微生物是土壤生物系统中最大的种群,直接驱动着土壤养分的转化和循环,在平衡土壤肥力、提高作物抗逆性、优化土壤生态环境质量等方面发挥着重要作用[1]。土壤微生物在陆地生态系统的生物地球化学循环中还起着重要作用[2]。微生物群落结构的多样性影响着土壤物质循环和养分转化,其丰富度和多样性可影响作物生长发育[3]。土壤中细菌越多、真菌数量越少,土壤生态系统越好,群落结构越稳定,土壤的抗病能力越强[4]。目前,大量施用化肥会导致土壤pH下降,从而导致细菌群落丰度下降[5];且现在的集约化农业也使土壤生物多样性下降,增加了虫害爆发风险,严重威胁农业的可持续发展[6]。长期施用农药会造成土壤脱水并破坏植物组织,过量的肥料也会污染环境[7]。而施用生物有机肥可以使土壤营养元素含量增加,提升土壤健康状态,重塑微生物群落结构和多样性[8]。生物有机肥还可以促进作物对氮磷钾的吸收,减少病虫害发生,从而减少杀虫剂的使用,通过改善土壤和作物品质等来推进农业可持续发展[9]。
在生物有机肥的制作中,对比自然发酵,添加微生物菌剂有利于增加肥料中的有益菌。将微生物菌剂加入有机肥料中进行混合堆肥可以提高作物产量[10]。农用酵素是以植物为主要原料、添加或不添加辅料、经微生物发酵制得的酵素产品,含有特定生物活性成分,可用于种植业、养殖业和土壤改良等[11]。目前农用酵素已作为基肥、叶面肥、滴灌肥、生物农药和分解菌剂等广泛应用于农业生产[12]。细菌和真菌中的许多菌群已经被证实为有益菌群,如细菌中厚壁菌门(Firmicutes)里的芽孢杆菌属(Bacillus)和变形菌门(Proteobacteria)中的沙雷氏菌属(Serratia)、寡养单胞菌属(Stenotrophomonas)、固氮螺菌属(Azospirillum)、根瘤菌属(Rhizobium)、假单胞菌属(Pseudomonas)及放线菌门(Actinobacteria)中的链霉菌属(Streptomyces);真菌中子囊菌门(Ascomycetes)里的白粉寄生孢属(Ampelomyces)、盾壳霉属(Coniothyrium)和木霉菌属(Trichoderma)等,它们通过一系列复杂的反应来促进土壤养分含量、抑制病原菌,进而促进作物生长[13]。农用酵素包含固态和液态2种形式,榕树叶、青蒿茎叶、枇杷叶和木麻黄叶等制作的液态农用酵素对辣椒和黄瓜生长及其土壤有显著的改良促进作用[14];花生秸秆和玉米秸秆制作的固态农用酵素能够使辣椒在低温胁迫下保证产量[15]。然而,国内外对农用酵素中微生物多样性及群落结构鲜有报道。因此,本研究从农用酵素的原材料和制作方式出发,利用高通量测序技术和生物信息分析技术,阐明不同农用酵素的微生物多样性和群落结构特征,为农用酵素的高效利用和深入开发提供理论依据。
1 材料与方法
1.1 试验材料
设计液态和固态2种发酵方式,选用不同的植物秸秆作为原材料,具体材料种类详见表1。岛本酵素菌:粉剂,由昆明邦特生物工程技术有限公司生产,有效活菌≥0.50亿·g-1。枯草芽孢杆菌和哈茨木霉菌:由山东绿陇生物技术有限公司生产,有效活菌数400亿·g-1。酵素制作方法参考岛本农法[16],其中液态农用酵素的制作为:原材料6 kg(干重,通过计算不同原材料的含水量,以其干物质量计算),麦麸1.5 kg,酵素菌1.5 kg,水100 L,有氧发酵10 d;固态农用酵素的制作为:原材料200 kg(干重,通过计算不同原材料的含水量,以其干物质量计算),麦麸50 kg,羊粪40 kg,红糖1 kg,酵素菌5 kg,保湿有氧发酵90 d。每种酵素重复3次。以上原材料均使用农业生产中的废弃秸秆或者自然生长的杂草,以实现农业的可持续发展。2种类型的酵素均等待发酵完全后进行取样混合后送测。

表1 农用酵素的剂型和原材料Table 1 Form and raw materials of agricultural Jiaosu
1.2 试验方法
1.2.1 样品制备取制作好的发酵产物3~5 g,液氮速冻30 min,然后放至-80℃冰箱冷冻,用于后续高通量测序。
1.2.2 样品测序过程用微生物DNA提取试剂盒提取微生物DNA。然后采用引物SSU0817F(5’-TTAGCATGGAATAATRRAATAGGA-3’)和1196R(5’-TCTGGACCTGGTGAG TTTCC-3’)对真菌ITS1区进行扩增;采用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)对细菌16s rDNA V3~V4区进行扩增。PCR采 用20μL体系,包括5×FastPfu Buffer 4μL,dNTPs(2.5 mmol·mL-1)2μL,前后引物各0.8μL(5μmol·μL-1),FastPfu Polymerase 0.4μL,BSA 0.2μL,DNA 10 ng,最后用ddH2O补至20μL。PCR程序:95℃3 min;95℃30 s,55℃30 s,72℃45 s,细菌进行28个循环,真菌进行36个循环;72℃10 min,10℃保温。PCR结束后选取大小正确含量合适的PCR产物由上海美吉生物医药科技有限公司测序。
1.3 数据分析
本试验数据通过测序获得,并在其微生物多样性云分析平台进行分析。操作分类单元(operational taxonomic units,OTU)聚 类 使 用Uparse 7.0.1090;OTU统计使用Usearch 7.0;Alpha多样性分析使用Mothur1 30.2;在NCBI(https://www.ncbi.nlm.nih.gov)查询微生物分类关系。
2 结果与分析
2.1 农用酵素样品的高通量测序数据
对原始数据进行筛选得出优化序列,在97%的相似水平下进行序列统计。由图1和表2可知,菌剂中细菌和真菌的序列长度分别为401~460和381~420 bp;液态农用酵素中细菌和真菌的序列长度分别为421~460和381~420 bp;固态农用酵素中细菌和真菌的序列长度分别为421~460和381~420 bp。

表2 不同农用酵素的高通量测序数据Table 2 High-throughput sequencing data of different Jiaosu for agriculture
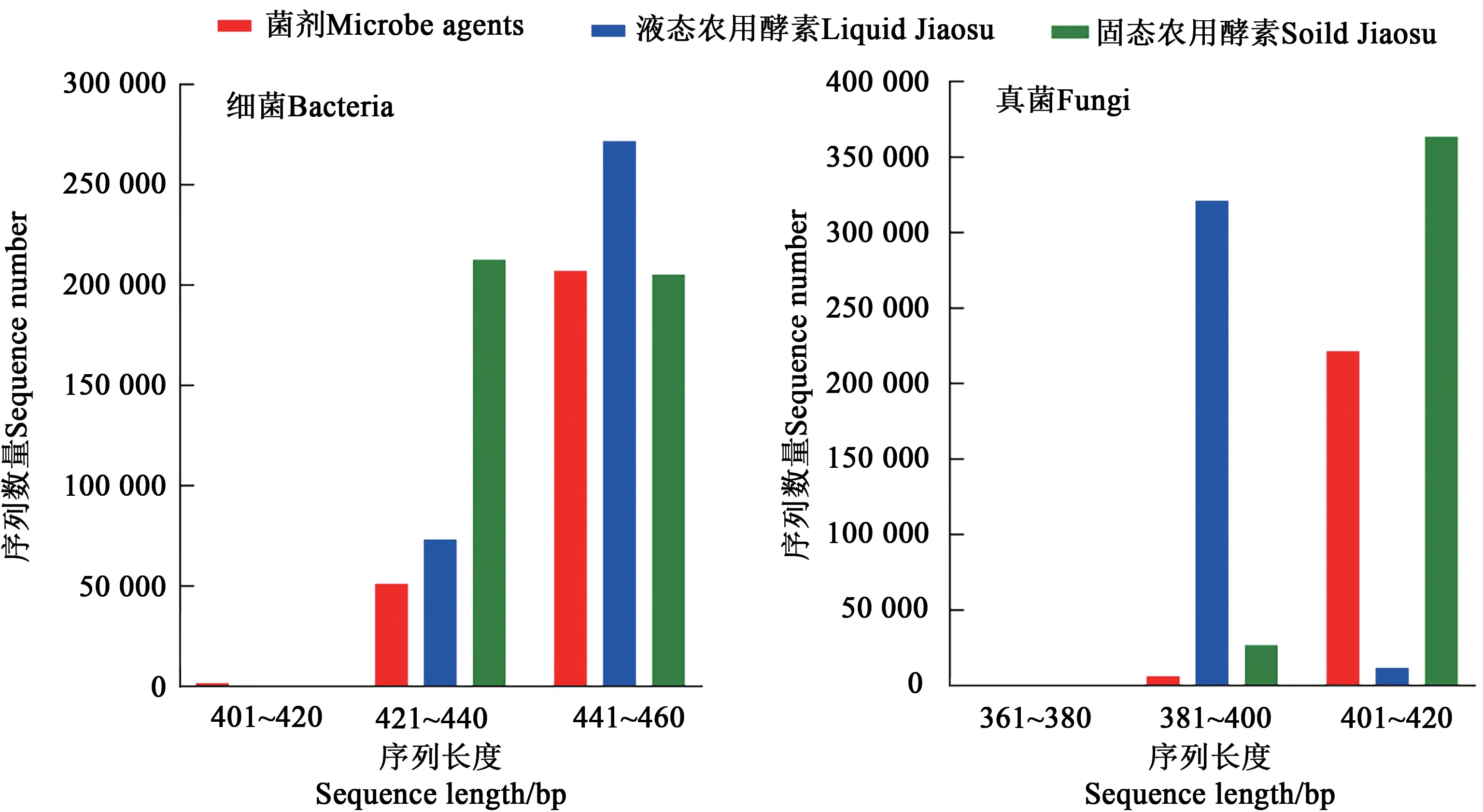
图1 优化后农用酵素菌群的序列长度Fig.1 Length distribution of the optimized sequence of Jiaosu for agriculture
2.2 农用酵素样品的稀释性曲线
OTU稀释曲线是从不同处理中随机抽取一定数量的个体,然后统计这些个体代表的物种的数目,并且以个体数和物种数来构建曲线,比较不同处理间物种的丰富度[17]。在OTU稀释曲线中,当曲线急速上升时,表明有大量物种被发现;当曲线趋近于平缓时,表明酵素有机肥中的物种不会随着测序数量的增加而增加[18]。从图2可以看出,高通量测序深度合理,可以反映样品中物种组成,较准确反映农用酵素中微生物的丰富度和多样性。
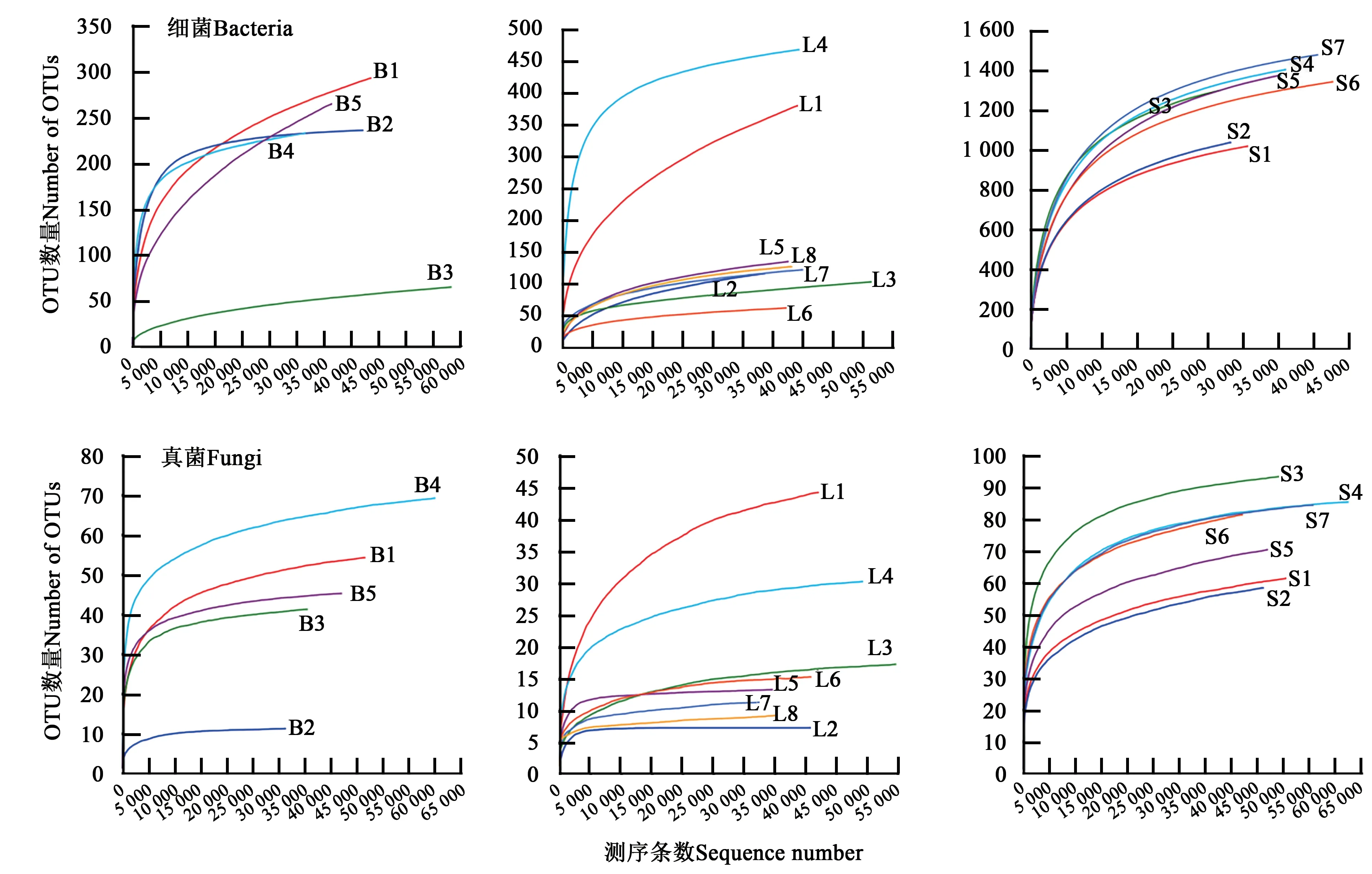
图2 农用酵素菌群的稀释曲线Fig.2 Dilution curve of microbial community of Jiaosu for agriculture
2.3 不同农用酵素的微生物物种丰度和多样性比较
由图3可知,固态农用酵素中细菌和真菌的OTU数量极显著高于液态农用酵素和微生物菌剂;液态农用酵素中细菌的OTU数量与菌剂差异不显著,而真菌的OTU数量显著低于菌剂。由此表明,固态有利于提高农用酵素的微生物物种多样性。
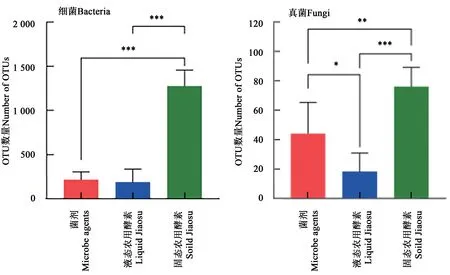
图3 不同剂型的农用酵素的OTU数量Fig.3 Number of OTUs of different dosage forms of Jiaosu for agriculture
Alpha多样性分析可估算环境群落物种的丰度和多样性,其中Shannon指数越大,群落多样性越高[19]。在岛本酵素菌中,细菌的Shannon指数高于羊粪菌,Ace指数高于牛粪菌,Chao 1指数高于牛、羊粪菌;真菌的Ace指数和Chao 1指数高于羊粪菌,但低于牛粪菌。在液态农用酵素中,细菌和真菌的多样性因原材料的不同存在较大差异,细菌和真菌Shannon指数、Simpson指数、Ace指数、Chao 1指数的变异系数分别为55.31%、76.72%、74.96%、74.13%和68.76%、26.02%、69.02%、69.86%;细菌中,L4(木麻黄)的Shannon指数最大,Simpson指数最小;L1(玉米秸秆)的Ace指数和Chao 1指数最高;真菌中,L3(黄蒿)的Shannon指数最大,Simpson指数最小;L1(玉米秸秆)的Ace指数和Chao 1指数最高。在固态农用酵素中,不同酵素中细菌和真菌的多样性指数差别较小,细菌和真菌Shannon指数、Ace指数、Chao 1指数的变异系数分别为4.86%、12.33%、11.91%和19.07%、10.12%、11.29%。综上所述,岛本酵素菌的细菌和真菌多样性高于牛、羊粪菌;固态农用酵素的真菌和细菌多样性均高于液态农用酵素;液态发酵受原材料的影响较大,固态发酵较为稳定,受原材料影响小(表3)。

表3 不同农用酵素的多样性指数Table 3 Diversity index of different Jiaosu for agriculture
2.4 不同农用酵素的微生物群落结构比较
2.4.1 细菌群落结构比较分析在细菌的门水平上,将相对丰度小于1%的归于其他;在细菌的属水平上,将相对丰度小于5%的归于其他。由图4和5可知,不同菌剂、不同剂型和不同材料农用酵素的细菌和真菌的群落结构差异较大。
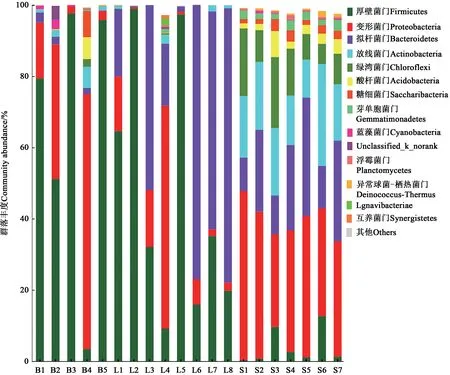
图4 不同农用酵素在门水平上的细菌群落丰度Fig.4 Abundance of bacterial community of different Jiaosu for agriculture at phylum level
对于生物菌剂,在门水平上,B1(酵素菌)、B3(枯草芽孢杆菌)和B5(羊粪菌)中厚壁菌门(Firmicutes)的相对丰度为79.4%、97.7%、95.8%,为优势菌门;B4中变形菌门(Proteobacteria)的相对丰度为71.5%,为优势菌门。在属水平上,B1中芽孢杆菌属(Bacillus)和短芽孢杆菌属(Brevibacillus)的相对丰度较高,分别为42.9%和29.3%;B3中芽孢杆菌占绝对优势,相对丰度为96.4%;B4(牛粪菌)中根霉菌属(Rhizomicrobium)的相对丰度较高,为33.3%;B5中norank_f_Bacillaceae的相对丰度为45.6%。
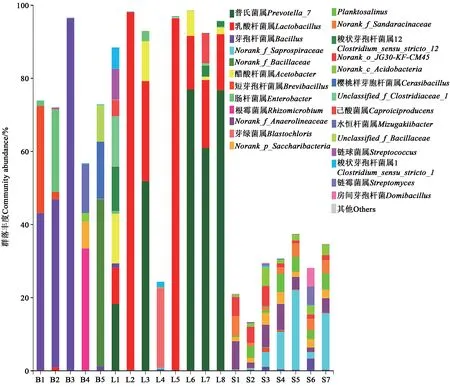
图5 不同农用酵素在属水平上的细菌群落丰度Fig.5 Abundance of bacterial community of different Jiaosu for agriculture at genus level
对于液态农用酵素,不同原材料制成的液态农用酵素间细菌组成差异较大(图4和5)。在门水平,L1、L2、L5的优势菌门为厚壁菌门,相对丰度分别为64.6%、98.9%、97.4%;L3、L6、L7、L8的优势菌门为拟杆菌门(Bacteroides),相对丰度分别为51.9%、77.0%、61.2%、77.0%;L4的优势菌门为变形菌门,相对丰度为62.6%。
对于固态农用酵素,不同固态农用酵素的群落结构具有较高的相似性(图4和5)。在门水平上,厚壁菌门的相对丰度低于12.7%,变形菌门的相对丰度为26.0%~47.5%,拟杆菌门的相对丰度为9.4%~33.3%,放线菌门(Actinobacteria)的相对丰度为10.7%~28.6%,绿弯菌门(Chloroflexi)的相对丰度为5.7%~19.9%,酸杆菌门(Acidobacteria)的相对丰度为1.4%~7.3%,螺旋体菌门(Saccharibacteria)的相对丰度为1.2%~3.3%。
综上所述,在细菌群落结构的组成上,液态农用酵素由于原材料的不同差异较大,固态农用酵素相似度较高,在群落组成上与添加的菌种(酵素菌)组成差异较大。
2.4.2 真菌群落结构比较分析在属和门水平上均将相对丰度小于5%的菌群归于其他。由图6和7可知,在门水平上,L4中unclassified_k_norank的相对丰度较高,为79.3%;其他处理的群落结构相似,均表现为子囊菌门(Ascomycota)的相对丰度较高,达82%以上。在属水平上,B1(酵素菌)中unclassified_f_Trichocomaceae、曲霉菌属(Aspergillus)、unclassified_o_Hy.pocreales、unclassified_p_Ascomycota和unclassified_o_Saccharomycetales的相对丰度较高,分别为7.0%、14.4%、25.2%、1.4%和46.3%;B2(哈茨木霉)中unclassified_o_Hy.pocreales占绝对优势,相对丰度为98.9%,纯度较高;L1、L2、L5、L6、L7、L8中norank_o_Saccharomycetales的相对丰度较高,达73.3%以上;L4中unclassified_k_norank的相对丰度较高,为79.3%;固态农用酵素的真菌群落在属水平上具有较高的相似性,其中,unclassified_f_Trichocomaceae、曲霉菌属(Aspergillus)、unclassified_p_Ascomycota和假埃希氏菌属(Pseudallescheria)的相对丰度分别为9.5%~51.1%、2.9%~28.8%、3.6%~30.7%、1.6%~9.2%。综上所述,农用酵素中真菌的群落结构在门水平上非常相似;在属水平上,不同菌种、不同剂型之间差异较大,同一剂型不同材料间比较相似。
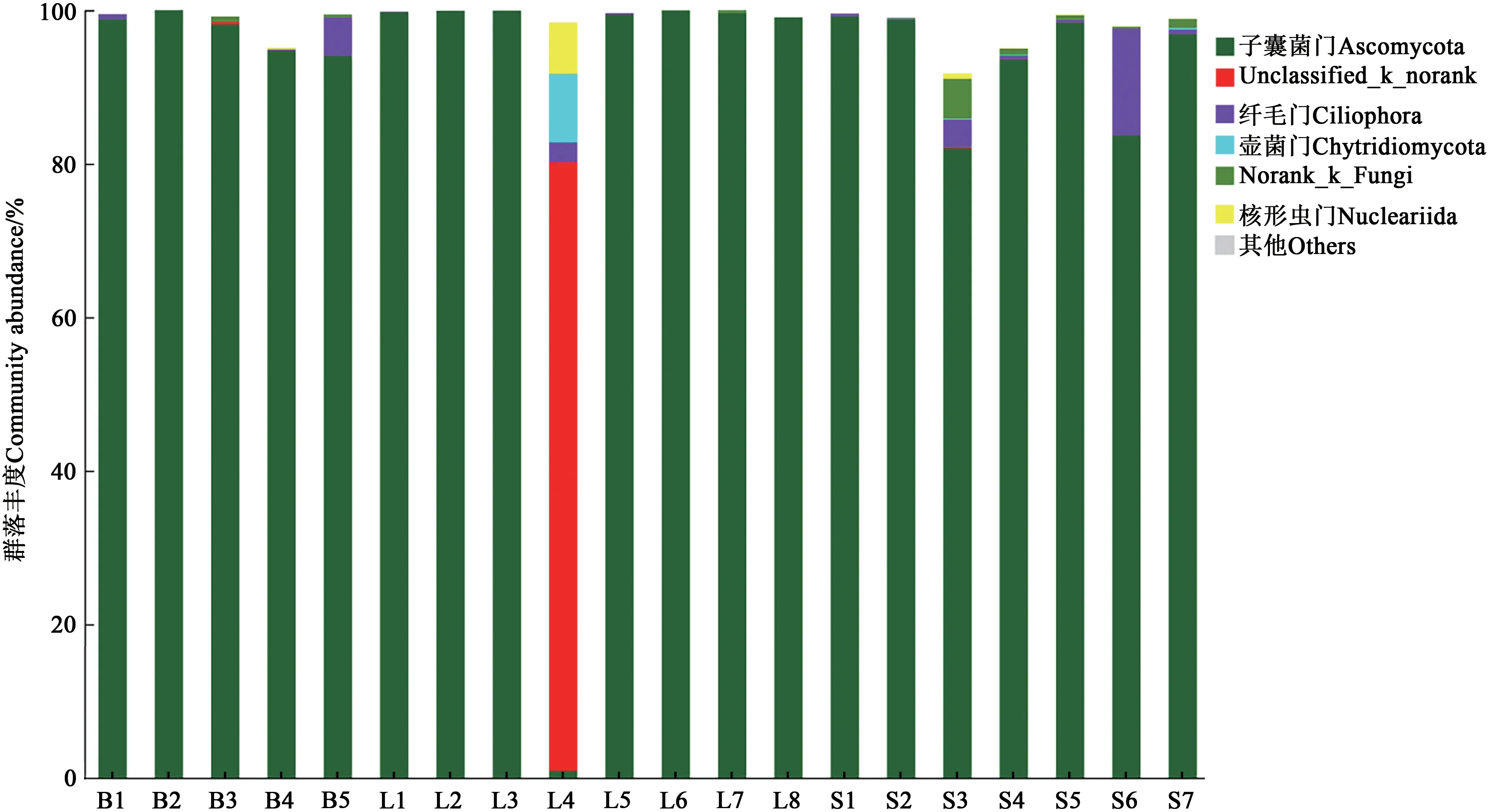
图6 不同农用酵素在门水平上的真菌群落丰度Fig.6 Abundance of fungal community of different Jiaosu for agriculture on phylum level

图7 不同农用酵素在属水平上的真菌群落丰度Fig.7 Abundance of fungal community of different Jiaosu for agriculture on genus level
2.5 不同农用酵素的微生物聚类分析
由图8可知,基于门水平,细菌群落在0.2相似度下被分为5支,固态农用酵素被聚在一起,液态农用酵素被聚在不同的分支;真菌群落在0.4相似度下分为4支,液态农用酵素除L4(木麻黄)外均被聚在一起,固态农用酵素和B4(牛粪菌)、B5(羊粪菌)聚在一起。由此表明,不同固态农用酵素的细菌和真菌具有相似的群落结构;不同液态农用酵素的细菌和真菌群落组成差异较大,均与菌种(酵素菌B1)间的相似度较低,表明原材料对微生物群落结构的影响大于菌种。

图8 不同农用酵素细菌和真菌门水平群落结构相似性聚类分析Fig.8 Cluster analysis of bacterial and fungal community structure similarity in different Jiaosu for agriculture
3 讨论
生物有机肥可以通过对土壤微生物的调节来抑制病原菌。Zhang等[20]研究发现,农用酵素对灰霉病菌有较强的抑制作用,能够作为一种生物农药使用;酵素中厚壁菌门和变形菌门的相对丰度较高,分别为72.8%和15.1%,与本研究酵素菌的细菌群落组成有一定的相似性。Tao等[21]证实生物有机肥对香蕉枯萎病的防治作用是由于生防菌改变了土壤微生物的群落结构。Zhang等[22]研究表明,添加含芽孢杆菌(Bacillus)的生物有机肥能够减轻西瓜的连作障碍,促进西瓜生长。本研究也表明,芽孢杆菌属是酵素菌种的优势菌属。
生物有机肥还可以通过微生物调节土壤理化性质来修复土壤,从而增强作物抗逆性。Lu等[23]研究发现,在盐碱地上将腐烂的稻草和生物有机肥混合施用可降低变形菌门的相对丰度,增加厚壁菌门的相对丰度,从而修复盐碱地。本研究结果表明,液态农用酵素中玉米、蓖麻、青蒿酵素的厚壁菌门相对丰度较高,推测该酵素可以用来修复盐碱地。Azmat等[24]研究发现,加入菌剂的生物肥料和水杨酸共同施用可增强水稻抗旱性。张宇冲等[25]研究发现,施用生物有机肥能增加功能性有益细菌的含量,提高土壤细菌群落多样性与丰富度,从而提升土壤酶活性和土壤肥力。以上研究表明,生物有机肥含有丰富的微生物菌群,能够调节土壤微生物群落结构,修复土壤,促进作物养分吸收利用,增强作物抗逆性,减轻连作障碍等。可见,在生物有机肥中起作用的关键物质是微生物菌群。因此,在生物有机质肥的生产中添加菌剂更加有利于土壤改良和作物生长。本研究从细菌和真菌的多样性和群落组成上阐述了不同农用酵素的群落结构,为农用酵素的高效利用和开发奠定了理论基础。
本研究表明,固态农用酵素的细菌和真菌多样性极显著高于液态农用酵素;液态农用酵素的微生物多样性和群落组成因原材料的不同差异较大;固态农用酵素的微生物多样性和群落组成较为稳定,细菌的优势菌门为变形菌门(Proteobacteria,26.0%~47.5%)、拟 杆 菌 门(Bacteroides,9.4%~33.3%)和放线菌门(Actinobacteria,10.7%~28.6%),真菌的优势菌门为子囊菌门(Ascomycetes)。微生物群落结构和组成均因剂型和材料的不同而存在差异,影响程度为剂型>材料,多样性表现为固态>液态。不同材料的农用酵素对作物及土壤微生物群落改良的作用机理仍有待进一步探索。
