不同管理类型茶园蜘蛛多样性及时空变化
2022-11-29杨涛唐劲驰高文伟农红艳罗平黎健龙
杨涛,唐劲驰,高文伟,农红艳,罗平,黎健龙*
(1.新疆农业大学农学院,乌鲁木齐 830052;2.广东省农业科学院茶叶研究所,广东省茶树资源创新利用重点实验室,广东 英德 510640)
近年,农民为追求产量和经济效益,大量使用化肥、农药,不仅使原有生态系统遭到破坏,还会使害虫产生抗药性、造成农作物农药残留及品质下降、杀死害虫天敌、产生次生害虫等[1-3]。蜘蛛作为茶园生态系统的主要组成部分,对害虫具有重要的调控作用,其种类多、数量大,发生数量占捕食性天敌的80%~90%[4],如对叶蝉有极强的捕食作用[5-6],对茶蚜、茶丽纹象甲、茶尺蠖等具有显著的调控作用[7-9]。因此,针对性地保护蜘蛛多样性,建立生态、健康、持续性景观茶园是学者及茶产业的研究热点之一。近年来,国内外学者就茶园生产管理[10]及蜘蛛生态调控[11]进行了系统性研究;分析了茶园蜘蛛的类群[12]、地域[13]、空间[14]、季节性组成分布[15]及多样性[16-17]等。但不同管理类型对茶园蜘蛛的影响仍处于短期研究。为利用蜘蛛类群建立生态友好型茶园,探究不同生境条件对蜘蛛类群结构及多样性的长期影响以及蜘蛛类群与不同类型茶园间的关系,本研究以“英红九号”为基础,对3类不同防治类型茶园进行为期2年的研究,探讨不同管理方式、不同生境对茶园蜘蛛类群组成、分布、结构及物种多样性的影响,分析不同茶园蜘蛛类群结构和多样性、蜘蛛和叶蝉的季节动态差异,为评价蜘蛛的控害作用、建立以蜘蛛为主的茶园综合防治体系提供理论依据。
1 材料与方法
1.1 样地概况与设计
试验于2015—2016年在广东省农业科学院茶叶研究所(24°18′9″—24°18′15″N,113°23′9″—113°23′16″E;海拔30—40 m)进行。气象数据(图1)由广东省英德市气象局提供。茶园茶树为树龄10年的“英红九号”,采茶时间为3月中旬至10月下旬,每7 d采茶1次。选取1#、2#和3#共3种不同防治类型茶园进行研究。
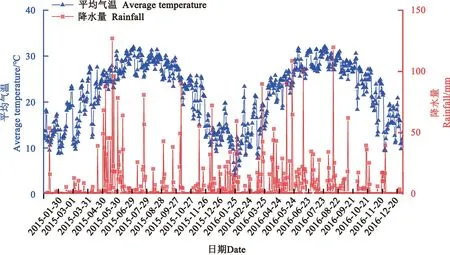
图1 2015—2016年英德市每天平均温度和降水量Fig.1 Average daily temperature and rainfall in Yingde city from 2015—2016
1#茶园为常规无间作茶园。茶园长期不施用农药,内部定期除草,四周杂草较少,中间种植较少的景观树,无缓冲带。
2#茶园均匀间作树龄为10年以上的台湾相思树和落叶乔木。茶园四周生态环境良好,种有较多的景观树,植被覆盖度较深。茶园长期禁止施用化学农药,一直采用以生境治理虫害的生态防治手段;存在明显缓冲带。
3#茶园周围无植被覆盖,定期除草。茶园无间作,长期施用化学农药,一般施药时间为3—10月,每月不定期施化学农药2~3次;无缓冲带。
1.2 采样时间与方法
2015—2016年采用平行跳跃法随机选取10个调查点,即每个小区随机选取2个调查点,且2个调查点之间相隔10 m;每月调查1次,共调查24次。每个调查点调查1个样方,每样方为1 m茶行,将茶行一分为二,随机从每样方的上、中、下层调查2枝梢上蜘蛛和叶蝉的数量;再调查茶园地表,每样方为1 m2。将采集的样本带回实验室进行分类鉴定[4,18]。
1.3 数据统计分析
采用Origin 19.0及Excel 2010进行试验数据的统计与分析。2015—2016年3种类型茶园的蜘蛛按月进行同类样本处理,统计蜘蛛个体数及类群数,并计算Shannon-Wiener多样性指数(H′)、Pielou均匀性指数(J)、Margalef丰富度指数(SR)及Simpson优势度指数(D)[19-21],公式如下。

式中,Pi为群落第i个物种个体数占总个体数比例;H′max为最大理论值;S为蜘蛛群落的总类群数;N为蜘蛛群落全部物种的总个体数。
2 结果与分析
2.1 不同防治茶园蜘蛛群落组成及分布
2015—2016年,3类不同管理类型茶园共采集蜘蛛样本4 439头,隶属12科,包括平腹蛛科、狼蛛科、管巢蛛科、球蛛科、园蛛科、跳蛛科、猫蛛科、圆颚蛛科、皿蛛科、漏斗蛛科、肖蛸蛛科及蟹蛛科(表1)。其中,1#茶园采集到蜘蛛样本1 333头,占总数的30.03%,隶属12科;2#茶园采集到蜘蛛样本2 382头,占总数的53.66%,隶属12科;3#茶园采集到蜘蛛样本724头,占总数的16.31%,隶属10科。
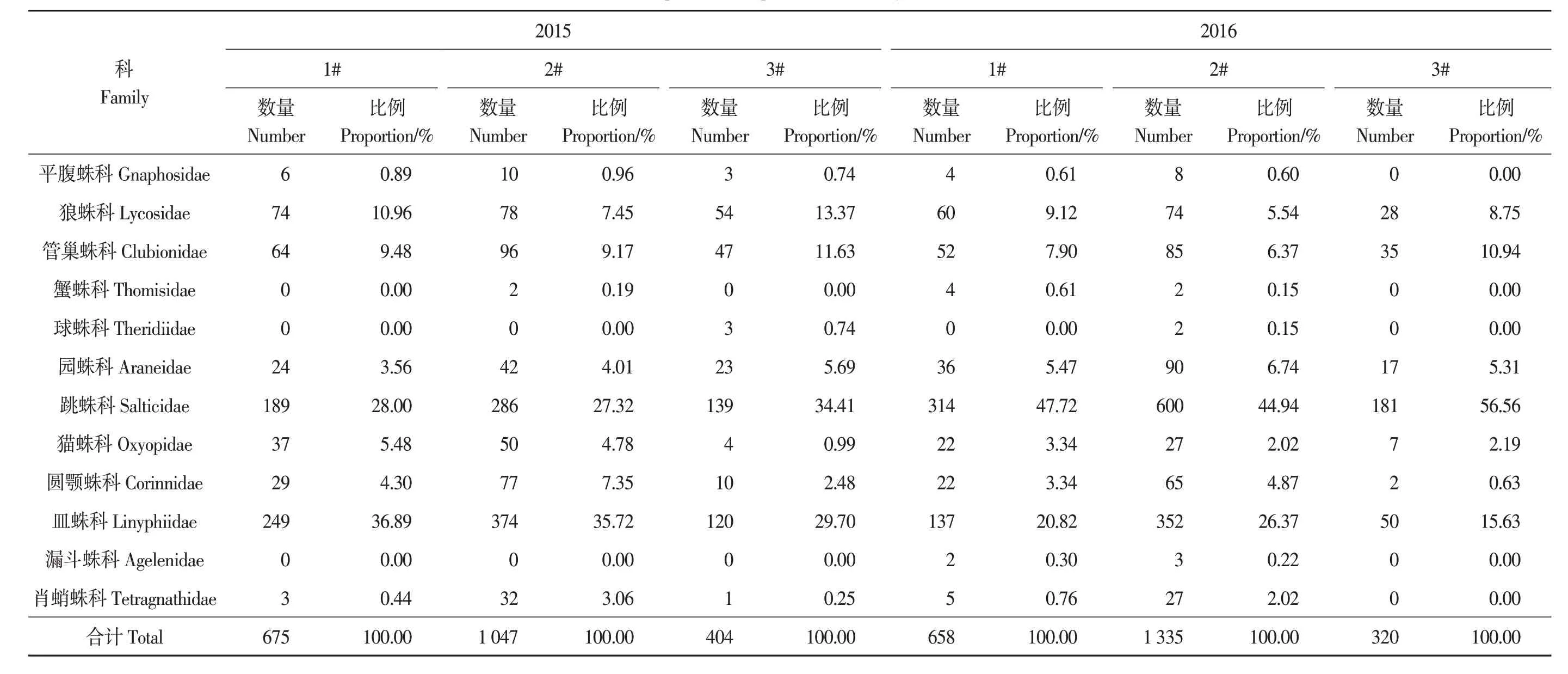
表1 2015—2016年蜘蛛群落组成Table 1 Composition of spiders community in 2015—2016
2015年,3个茶园共采集蜘蛛样本2 126头,隶属11科。其中,1#茶园采集蜘蛛样本675头,占总数的31.75%,隶属9科,占类群数的75.00%;2#茶园采集蜘蛛样本1 047头,占总数的49.25%,隶属10科,占类群数的83.33%;3#茶园采集蜘蛛样本404头,占总数的19.00%,隶属10科,占类群数的83.33%。2016年,3个茶园采集蜘蛛样本2 313头,隶属12科。其中,1#茶园采集蜘蛛样本658头,占总数的28.45%,隶属11科,占类群数的91.67%;2#茶园采集蜘蛛样本1 335头,占总数的57.72%,隶属12科,占类群数的100%;3#茶园采集蜘蛛样本320头,占总数的13.83%,隶属7科,占类群数的83.33%。
2年结果表明,2#茶园蜘蛛数量约为1#茶园的1.6和2.0倍,约是3#茶园的2.6和4.2倍。在蜘蛛类型上,1#茶园的优势类群均为跳蛛科和皿蛛科,在2015和2016年的占比分别为75.85%和68.54%;2#茶园的优势类群为跳蛛科、皿蛛科,在2015和2016年的占比分别为63.04%和71.31%;3#茶园的优势类群为管巢蛛科、跳蛛科及皿蛛科,在2015和2016年的占比分别为89.11%和83.13%。1#、2#和3#茶园蜘蛛的优势类群∶丰盛类群∶常见类群∶稀有类群在2015年分别为3∶2∶2∶2、2∶3∶3∶2和4∶1∶1∶4;2016年分别为2∶3∶2∶4、2∶3∶3∶4和3∶2∶1∶1。由此表明,2#茶园蜘蛛的群落结构分布较优。
2.2 不同管理类型茶园蜘蛛多样性
不同的管理方式、周围生境以及植被覆盖度对茶园生态系统影响较大。根据结网与否和有无捕食行为,将蜘蛛划分为结网型和游猎型。2015—2016年,3种类型茶园中均以游猎型蜘蛛为主,主要包括平腹蛛、狼蛛、管巢蛛、蟹蛛、跳蛛、猫蛛、圆颚蛛、皿蛛8科,个体数分别为1 998和2 131头,且游猎型蜘蛛在各茶园的分布相似,均以跳蛛科和皿蛛科个体数最多;结网型蜘蛛相对较少,主要包括球蛛、园蛛、漏斗蛛和肖蛸蛛4科,个体数分别为128和182头。
由表2可知,2015—2016年蜘蛛个体数表现为2#茶园>1#茶园>3#茶园,且茶园间均差异显著(P<0.05);蜘蛛类群数在2015年表现为2#茶园>1#茶园>3#茶园(P<0.05),2016年表现为2#茶园、1#茶园>3#茶园(P<0.05)。对于Shannon-Wiener多样性指数,2015年表现为2#茶园>1#茶园、3#茶园(P<0.05),2016年表现为2#茶园、1#茶园>3#茶园(P<0.05);Margalef丰富度指数2年均表现为2#茶园、1#茶园>3#茶园;Simpson优势度指数2年均表现为3#茶园>2#茶园、1#茶园(P<0.05);Pielou均匀度指数在3种类型茶园间无显著差异。综上所述,蜘蛛个体数、类群数较多的2#茶园生物多样性较高,稳定性较好,对外界环境的变化有较强的适应力,其次为1#茶园,3#茶园最低;茶园不同的管理方式及生境复杂程度对蜘蛛类群数、个体数有重要影响,对群落多样性及稳定性有不同的表现形式;年际间环境变化对类群数、Shannon-Wiener多样性有一定影响。

表2 蜘蛛群落特征指数Table 2 Spiders community characteristic index
由图2可知,2月中下旬茶园蜘蛛多样性指数开始增大,7—11月多样性指数较高,群落处于较稳定状态。3种不同防治类型茶园多样性的动态变化存在差异,其中2#茶园的Shannon-Wiener多样性和Margalef丰富度指数较高,表明不同防治方法影响了茶园蜘蛛群落的动态变化。

图2 蜘蛛多样性指数Fig.2 Spiders diversity index
2.3 不同类型茶园蜘蛛群落空间序列多样性
由表3和4可知,2015和2016年生态环境较好的2#茶园蜘蛛在茶丛中、下层个体数较多,分别占66.34%和70.08%;地表最少,分别占8.40%和6.44%,且地表与其余各层均存在显著差异;同样,1#茶园蜘蛛个体的空间分布与2#茶园一致,中下层较多,分别为65.33%和72.19%,地表最少,分别为11.85%和10.03%;3#茶园蜘蛛在中下层的占比分别为69.80%和85.62%,地表占比最少,分别为14.11%和0.00%,且各层间差异显著。由此可见,蜘蛛群落主要分布于茶丛中、下层,上层和地表蜘蛛数量较少。1#、2#和3#茶园蜘蛛的Shannon-Wiener多样性和Margalef丰富度指数均表现为上层、中层、下层>地表(P<0.05)。
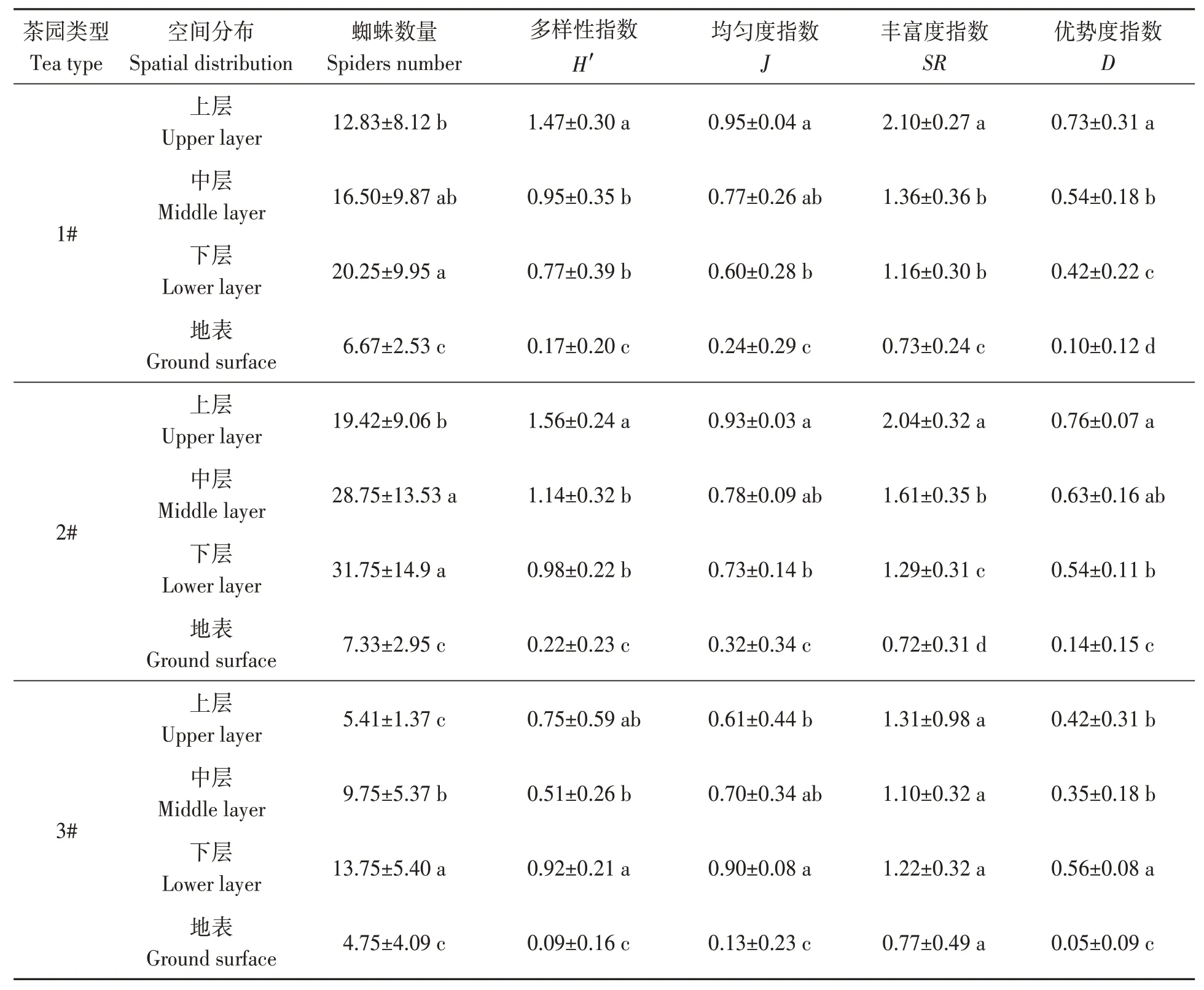
表3 2015年蜘蛛群落空间序列多样性Table 3 Spatial sequence diversity of spider communities in 2015
2.4 不同类型茶园蜘蛛和叶蝉个体数时间序列变化
由图3可知,2015和2016年蜘蛛个体数量均表现为2#茶园>1#茶园>3#茶园;且1#、2#茶园蜘蛛数量的动态变化趋势一致,分别在6和4月呈现峰值,3#茶园分别于5和6月呈现峰值。冬季气温低,蜘蛛活动能力减弱,因此,12月中旬至2月上旬蜘蛛数量呈现下降趋势。

图3 蜘蛛和叶蝉个体数随时间变化Fig.3 Number of spiders and leafhoppers varies with time
2015年,2#茶园蜘蛛数量在2月下旬至3月中旬处于迅速增长期,3月下旬至5月中旬缓慢增长,5月下旬至6月中旬迅速增长,6月下旬至7月中旬迅速下降,7月下旬至9月中旬出现波动性下降,于10月跌至第2个谷,至11月中旬缓慢上升;1#茶园蜘蛛数量在2月下旬至4月中旬为迅速增长期,4月下旬至5月中旬缓慢增长,至6月中旬迅速增长至峰值;3#茶园在2月下旬至4月中旬缓慢增长,4月下旬至5月中旬迅速增长,5月下旬至11月上旬呈波动缓慢下降趋势。2016年,2#茶园蜘蛛在2月下旬至4月中旬迅速上升,4月下旬至5月中旬缓慢下降,5月下旬至7月中旬迅速下降,7月下旬至8月缓慢下降,其后至11月下旬呈现缓慢波动性变化;1#茶园蜘蛛数量在2月下旬至4月中旬迅速增长,至7月中旬持续性下降至第1个谷,随后至11月下旬呈现缓慢波动变化;3#茶园蜘蛛数量在2月下旬至4月中旬缓慢增长,之后呈现波动性变化至8月中旬,8月下旬至9月中旬迅速下降,至11月上旬缓慢波动变化。综上所述,2015和2016年2#茶园的蜘蛛数量动态变化趋势较一致,迅速增长初始期一致,但峰值出现的时间略有不同;3#茶园的动态变化波动较缓,2015年4月至5月迅速增长,波动较大。由此表明,植被覆盖度的深浅、有无缓冲带及人为影响的强弱对蜘蛛数量均有一定影响;同一年份内不同类型茶园蜘蛛迅速增长期的长短及增长速度存在差异。
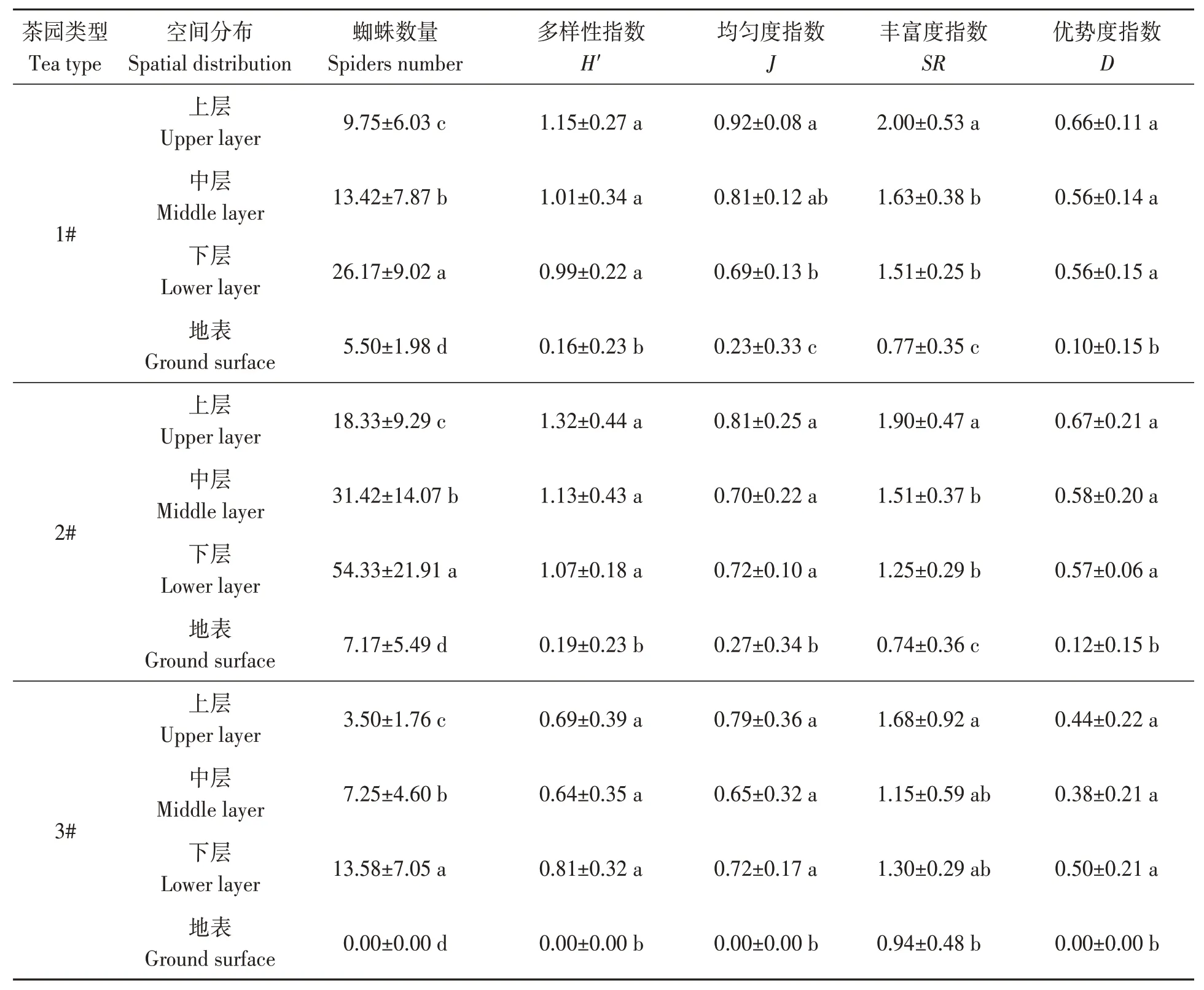
表4 2016年蜘蛛群落空间序列多样性Table 4 Spatial sequence diversity of spiders communities in 2016
2015和2016年2#、1#茶园的叶蝉个体数变化趋势均为一致的双峰曲线,峰值分别出现在5、10月和6、10月;3#茶园与1#、2#茶园存在一定差异。2015—2016年1#和2#茶园叶蝉数量在2月初迅速升高,5月中旬至第1个峰值,5月下旬至7月上旬迅速降低;8月初至10月迅速上升至第二峰,之后迅速下降。3#茶园由于2015年化学农药施用不及时导致3—5月叶蝉爆发,之后逐渐平缓;2016年由于及时施用化学农药叶蝉的数量增长缓慢,6月最高,之后缓慢下降,整体波动较小。
由表5可知,2015—2016年叶蝉数量均表现为1#茶园、2#茶园>3#茶园(P<0.05)。综合分析发现,蜘蛛与叶蝉存在明显的跟随效应,生态环境较好的2#茶园可以更好地调控叶蝉数量变化。

表5 假眼小绿叶蝉差异分析Table 5 Analysis of the difference of Leafhoppers
3 讨论
3.1 保护茶园生态结构、构建合理缓冲带可以增加蜘蛛群落多样性和稳定性
生物多样性作为衡量生物群落结构、群落生物多样性、生态系统稳定性及复杂程度的重要指标,能够反映生态环境间的差异性[22-23]。生物群落多样性作为群落生态学目前的研究热点之一,研究表明,良好的植被覆盖有利于促使蜘蛛群落多样性增加[24];蜘蛛群落多样性与周围环境、茶园本身生态环境及人为干扰密切相关,茶园及周边气候条件、管理、生态条件和捕食关系是造成蜘蛛群落结构产生变化的关键因子[25];蜘蛛数量及类群数在不同生境中存在差异,受周围环境及管理方式的影响较大,随着生态环境的改善,个体数及类群数逐渐增大,群落多样性及稳定性增加[26]。本研究显示,2015和2016年2#茶园的蜘蛛个体数分别是1#茶园的1.6和2.0倍,是3#茶园的2.6和4.2倍,存在明显缓冲带及茶园间作大型乔木的2#茶园稳定性及多样性最好,1#茶园次之,单一的3#茶园多样性及稳定性较差。茶园间作大型乔木及草丛增加了茶园的植被覆盖度,改善了茶园小气候,茶园周边种植大型落叶乔木,在一定程度上改善了茶园周边的生态环境,增加了缓冲带,进而使茶园抵御外部环境变化的能力增强。良好的生境不仅为蜘蛛提供了庇护[27],小气候的改善也为蜘蛛的繁衍及生存提供了优渥的食物来源及生存条件。因此,2#茶园的蜘蛛数量较多,且类群丰富。3#茶园由于过度开发导致茶园及周边生态环境遭到严重破坏,形成单一茶园,夏季高温及降雨直接作用于茶园内部,使节肢动物失去庇护,蜘蛛的食物来源匮乏,茶园抵御外部风险的能力减弱,蜘蛛群落的重建速度远远不及破坏速度,导致茶园生物量减少,生物多样性降低,而蜘蛛控制害虫的能力有限,导致蜘蛛多样性降低,稳定性变差。3种类型茶园的管理方式不同,2#茶园人为干扰较少,且不使用化学农药,茶园内部间种相思树和大型乔木,四周生态环境良好,种植有较多景观树,植被覆盖度深,3—10月采茶期每隔7 d采茶1次,每年整枝1次,期间再无任何人为因素干扰;1#茶园植被覆盖度较浅,定期人工锄草和采茶,虽然无化学农药的使用,但脆弱的生态环境导致昆虫抵制外部环境变化的能力减弱,易导致昆虫迁移;3#茶园每月不定期施用化学农药,导致大量蜘蛛和害虫被杀死。因此,2#茶园的蜘蛛群落多样性及时空分布优于1#和3#茶园。
3.2 良好的生境条件可以促进蜘蛛合理的时空分布,提高蜘蛛对叶蝉的调控作用
蜘蛛生殖方式和生存环境是自然选择的结果,也是蜘蛛为了生存对自然的选择;蜘蛛捕食和繁衍的活跃程度是对其生存环境优劣的度量[25,28]。茶园存在明显缓冲带、植被覆盖深度和合理减少人为干扰都对蜘蛛群落的组成和空间结构有直接影响[29-30]。本研究于2015—2016年调查了3种不同管理类型的茶园,2#茶园上、中和下层的蜘蛛数量约是地表蜘蛛数量的1.14倍以上,且2#茶园上、中、下层蜘蛛的多样性和丰富度均高于3#茶园。不同的生境条件是影响蜘蛛空间分布的重要因素,植被覆盖度高、人为因素干扰少的茶园稳定性较好,丰富了茶园节肢动物的种类,大量的游猎型蜘蛛和结网型蜘蛛聚集茶园茶丛,使茶园中、上部物种丰度较高。植被覆盖度较高的2#茶园为游猎型蜘蛛提供了良好的捕食和生存环境,促使地表蜘蛛的多样性和丰富度增高。1#茶园虽然也有植被覆盖,但覆盖度较低,且定期锄草容易使地表裸露,使游猎于地表的蜘蛛失去生存和庇护空间,导致蜘蛛多样性降低。3#茶园无植被覆盖,定期人工锄草和施用化学农药致使地表和茶丛裸露,化学农药的施用会直接杀死地表和茶丛中游猎型和结网型的蜘蛛,使茶园蜘蛛数量减少,多样性降低。由此可见,科学合理的管理可以保护茶丛中游猎型蜘蛛群落的多样性及稳定性;构建良好的生态环境可以提高蜘蛛群落多样性和稳定性,降低蛛蝉比。因而,构建合理的缓冲带、增加茶园四周及内部植被覆盖深度、合理减少人为干扰可以更好地优化蜘蛛群落的时空结构分布,提高对叶蝉的调控作用,有利于茶园的生态防治。
