地热水中硼与碳酸盐类矿物共沉淀过程研究
2022-11-29正安婷黄丽浈郭雅婷徐红艳
荣 立,正安婷,黄丽浈,郭雅婷,徐红艳
(长江大学资源与环境学院,湖北 武汉 430100)
0 引言
硼是维持动植物生长发育必需的元素[1],但硼的过量摄入会使人体及动物慢性中毒,造成肝、肾功能损害等严重后果[2],还会抑制植物生长[3],产生生理病害。作为重要的可再生清洁能源,地热水资源的合理开发利用具有显著的环境效益和经济效益。但具有岩浆热源的高温地热水常有着较高的硼含量[4],若从泉口或地热井口直接排出,将会对地热区地表沉积物和土壤环境造成一定程度的污染[5]。
地热区碳酸盐类矿物(钙华)广泛分布,地热流体从泉口排放到地表过程中往往会形成碳酸盐类矿物(钙华)。有研究表明,硼能够与粘土矿物、碳酸盐类矿物、有机质等表面活跃的羟基官能团进行配位体交换,从而被吸附到固相沉积物中[6-8]。鉴于硼酸根离子和碳酸根离子的化学结构及地球化学行为的相似性,可推断热泉中的硼将以与碳酸盐矿物共沉淀的方式向固相迁移并蓄积。这一过程在一定程度上可以抑制流体中的硼直接排放到地表环境内造成的危害。本文通过室内模拟过饱和富硼地热水中碳酸盐类矿物的沉淀过程,探讨硼与碳酸盐类矿物共沉淀的微观机理,并分析不同反应条件对该过程的影响,以期为我国地热资源的合理开发利用及地热水环境污染防治提供理论依据和借鉴思路。
1 材料与方法
1.1 实验仪器与样品配置
UV-5500紫外分光光度计、UPT-II-20T超纯水机、FD-1A-50冷冻干燥机。
500 mg/L硼标准贮备溶液的制备:准确称取2.82 g硼酸(H3BO3)于烧杯中,充分溶于去离子水后转入1 000 ml容量瓶中并定容至标线。
氯化钙标准贮备溶液的制备:准确称取22.2 g氯化钙(CaCl2)于烧杯中,充分溶于去离子水后转入1 000 ml容量瓶中并定容至标线。
乙酸铵贮备溶液的制备:准确称取50 g乙酸铵于烧杯中,充分溶于去离子水后转入100 ml容量瓶中并定容至标线。
人工地热水的制备:取160 ml的500 mg/L硼标准贮备溶液、20 ml乙酸铵贮备溶液和100 ml氯化钙标准贮备溶液于2 000 ml容量瓶中,定容后转入烧杯,通入适量氨气或CO2气体,调节溶液pH至8.0±0.1,即得到2L硼含量为40 mg/L,pH=8的人工地热水。
1.2 硼与碳酸盐类矿物共沉淀实验
初始溶液中硼浓度的影响:在制备人工地热水时,通过改变500 mg/L硼标准贮备溶液的加入量,使得人工地热水中硼浓度梯度为0、20 mg/L、40 mg/L、60 mg/L、200 mg/L、400 mg/L、500 mg/L。将2L不同硼含量的人工地热水转入特制密闭容器中(图1),以确保反应过程中不与外界产生气体交换。将密闭容器置于恒温水浴锅中,设置反应温度为25℃,通入适量氨气或CO2气体,调节溶液pH至8.0±0.1。待溶液pH稳定后,再分别加入1.477 8 g碳酸锂粉末进行反应。反应过程中通过通入氨气或CO2气体来保证溶液pH稳定于8.0±0.1,同时使用旋转搅拌器加快并控制反应速率。待反应进行12 h后离心过滤,随后将所得固体样本冷藏一天后于冷冻干燥机中干燥,再取0.1 g固体样品,加入适量0.1 mol/L的HCl进行消解,测定其消解后的硼浓度,用于计算硼与碳酸盐矿物共沉淀的量。
反应温度的影响:将2L硼含量为40 mg/L的人工地热水转入特制密闭容器并置于恒温水浴锅中,设置反应温度梯度为25℃、45℃、65℃、85℃,分别通入适量氨气或CO2气体,调节溶液pH至8.0±0.1。待溶液pH稳定后,再分别加入1.477 8 g碳酸锂粉末,余下操作步骤同上,测定固体样本消解后的硼浓度并计算硼与碳酸盐矿物共沉淀的量。
反应过程中pH的影响:将2 L硼含量为40 mg/L的人工地热水转入特制密闭容器并置于恒温水浴锅中,设置反应温度为25℃,通入适量氨气或CO2气体调节溶液pH,设置pH梯度为7±0.1、7.5±0.1、8±0.1、8.5±0.1、9±0.1、9.5±0.1、10±0.1。待溶液pH稳定后,再分别加入1.477 8 g碳酸锂粉末,余下操作步骤同上,测定固体样本消解后的硼浓度并计算硼与碳酸盐矿物共沉淀的量。
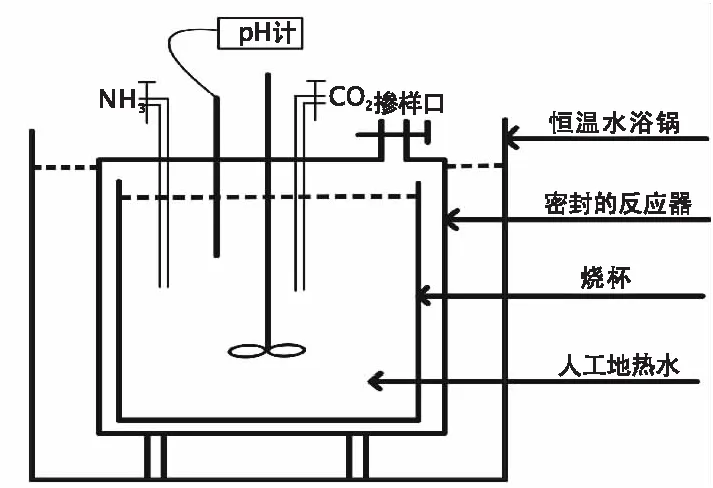
图1 硼与碳酸盐类矿物共沉淀实验装置
1.3 硼的测定
溶液中B的浓度采用甲亚胺-H酸分光光度法进行测试,该方法的检出浓度为0.03 mg/L,测定上限为5.0 mg/L。其原理为:在pH=5.2的乙酸铵和盐酸缓冲溶液中,硼与甲亚胺-H酸生成可溶于水的甲亚胺H-硼酸棕黄色化合物,其最大吸收波长在410~420 nm处。该化合物显色速度较慢,6 h后发色完全,在30 h内稳定(其摩尔吸光系数ε= 6×103)。多种金属离子在水中易与显色试剂生成沉淀,其颜色对测试结果有不同程度干扰,可用EDTA加以掩蔽。
2 结果与讨论
本次研究基于刘明亮(2018)[4]对藏南典型高温高硼地热区地热水样的分析(表1),设定人工地热水中硼含量为40 mg/L、pH=8.0、温度为25℃,并对刘明亮(2018)的实验方案加以改进和完善。在刘明亮(2018)的实验方案中,为了模拟自然环境下方解石的形成,采用的方法是使CaCl2提供的Ca2+离子与Na2CO3提供的CO32-离子反应,由此形成方解石沉淀。需要说明的是,由于CaCl2与Na2CO3都易溶于水,因而生成方解石沉淀的过程较为迅速,与自然环境下的形成过程不符,且反应速度过快,可能导致硼来不及通过反应进入方解石沉淀中,从而影响反应结果。本次研究采用Li2CO3代替Na2CO3提供CO32-,Li2CO3可溶但不易溶于水,因此可使生成方解石沉淀的过程缓慢进行,达到模拟自然环境下形成过程的效果。且由于反应过程较缓慢,也更易通过改变单一反应条件来探究不同条件对硼与方解石共沉淀过程的影响。同时,本次研究还扩大了初始溶液中B浓度的范围并严格控制了反应过程中溶液的pH,使获得的结果更加准确。
2.1 初始溶液中硼浓度的影响
不同初始硼浓度下硼与碳酸盐矿物共沉淀的测试结果见于表1,绘制关系曲线见于图2。从图2中可以看出,随着初始溶液中硼浓度的升高,硼与方解石共沉淀中的硼含量(固相中B浓度)升高,与前人的研究结果相一致[9]。当溶液中总硼浓度相同时,共沉淀中的硼含量与刘明亮(2018)的结果相差不大,但是要远高于Kitano et al. (1978)的实验结果。其可能原因是Kitano et al. (1978)的实验中,采用了使CO2从重碳酸钙溶液中逸出的方法模拟自然环境下方解石的生成,但该方法会使反应过程中溶液pH变化较大,从而影响实验结果。而本次研究采用的方法是使CaCl2提供的Ca2+离子与Li2CO3提供的CO32-离子反应,由此形成方解石沉淀,并严格控制了反应过程中溶液的pH,故共沉淀中的硼含量较Kitano et al.(1978)高得多。
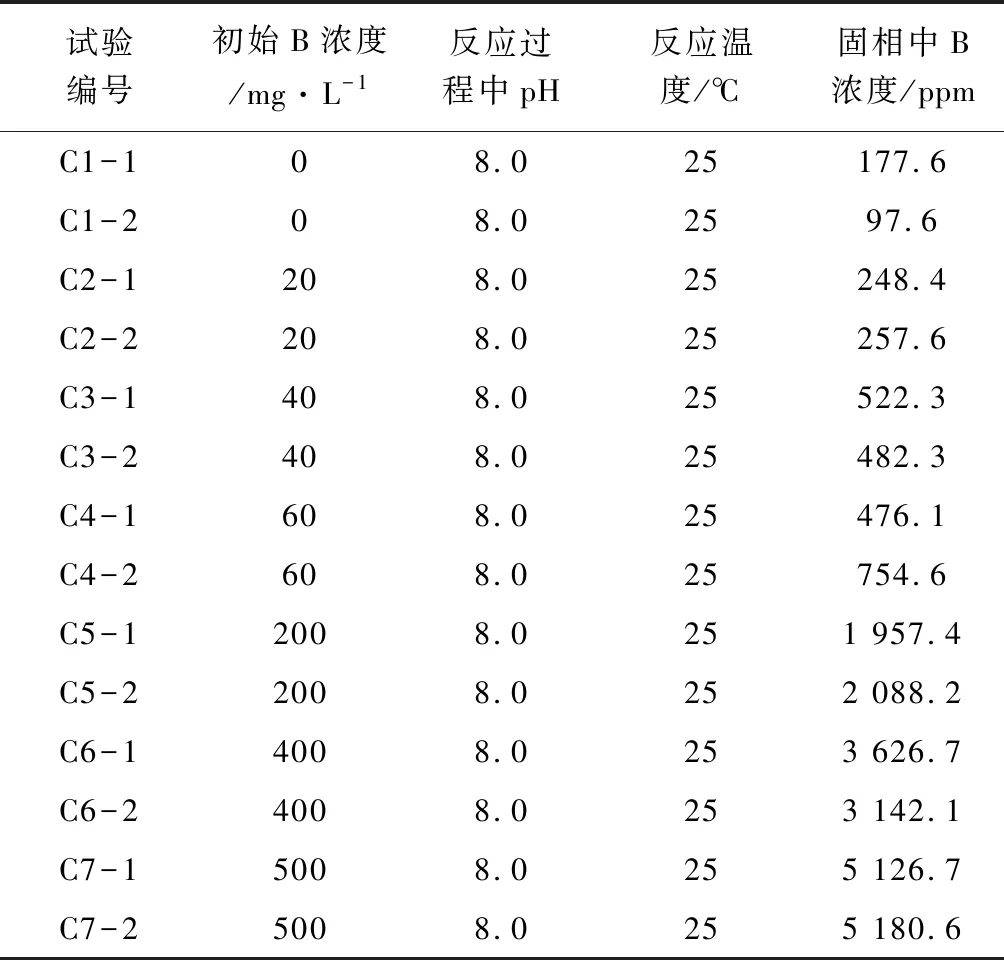
表1 初始溶液中硼浓度对固相中硼浓度的影响
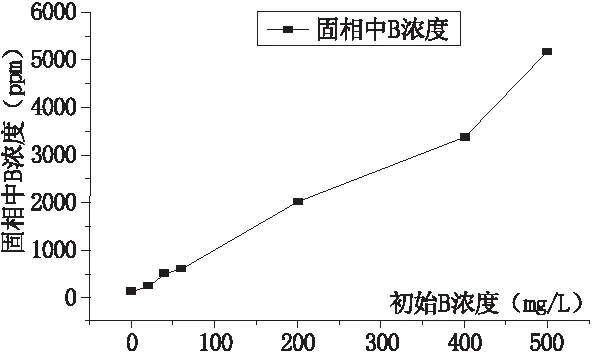
图2 固相中B浓度随初始溶液中硼浓度的变化
2.2 反应温度的影响
不同反应温度下硼与碳酸盐矿物共沉淀的测试结果见于表2,绘制关系曲线见于图3。从图3中可以看出,随着反应温度的升高,共沉淀中的硼含量(固相中B浓度)降低,当反应温度升高到85℃时,共沉淀中硼含量仅有240 ppm左右(表2),且随着温度的增加,共沉淀中硼含量的变化量逐渐变小,即温度对共沉淀中硼含量的影响逐渐减小。该实验结果与刘明亮(2018)的研究结果相反,其原因可能是刘明亮(2018)的实验中采用了Na2CO3与CaCl2反应生成方解石沉淀,其反应速度较快,生成方解石沉淀较迅速。而 B以三面体(主要以H3BO3形态为主)或四面体(主要以B(OH)4-形态为主)结构置换碳酸盐类矿物中的 CO32-这一过程是吸热反应,因此升高温度加快了这一过程的反应速度,也增加了共沉淀中硼的含量。本实验中Li2CO3与CaCl2反应较缓慢,而升高温度能够提升反应速度,加速方解石的形成,导致硼来不及通过反应进入方解石沉淀中,且该影响远大于温度对B置换碳酸盐类矿物中CO32-这一过程的影响,故随着温度的升高,共沉淀中的硼含量降低。而随着温度的增加,温度对Li2CO3与CaCl2反应速度的影响逐渐较小,也导致了共沉淀中硼含量的变化量逐渐变小。
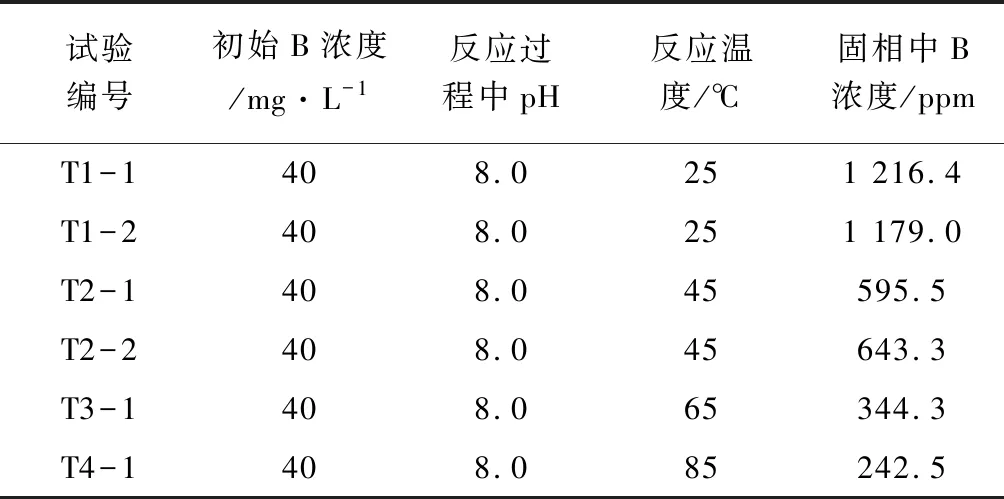
表2 反应温度对固相中硼浓度的影响
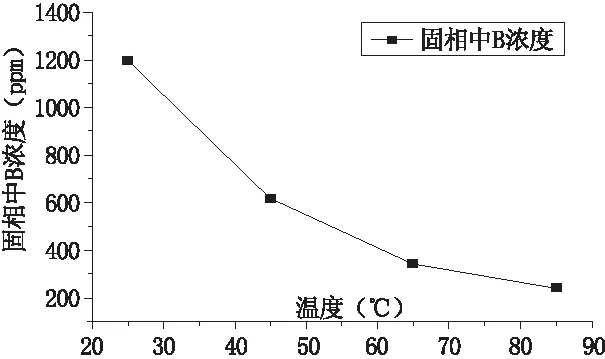
图3 固相中B浓度随反应温度的变化
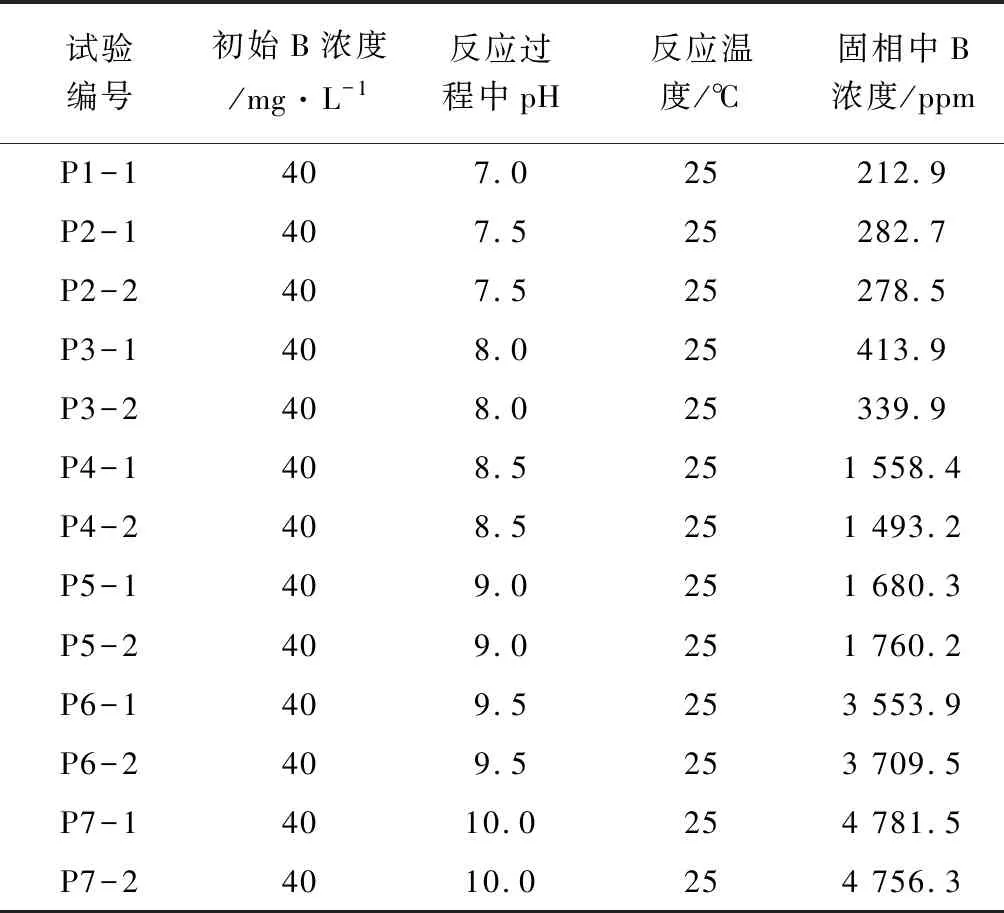
表3 pH对固相中硼浓度的影响
2.3 pH的影响
不同pH下硼与碳酸盐矿物共沉淀的测试结果见于表3,绘制关系曲线见于图4。从图4中可以看出,随着pH的升高,共沉淀中的硼含量(固相中B浓度)升高,当pH由7升高至8时,共沉淀中的硼含量增加不明显,而当pH由8升高至8.5时,共沉淀中的硼含量显著增加。当pH由8.5升高至9时,共沉淀中的硼含量增加不明显,而当pH由9升高至10时,共沉淀中的硼含量显著增加。从本次研究的观测结果并不能解释该现象,而其他学者在这方面已有一定程度的研究。Mavromatis等(2015)[10]研究了在可控 pH条件下,硼与方解石和霰石共沉淀的机理,结果显示硼与方解石和霰石共沉淀中硼的含量随着溶液pH的升高而增加,与本研究结果一致。截至目前,pH 对硼与碳酸盐类矿物共沉淀过程的影响还存在较多争议,有待日后更进一步的研究。
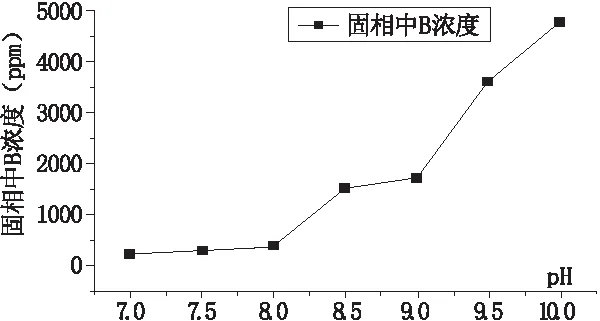
图4 固相中B浓度随pH的变化
3 结语
利用Li2CO3可溶但不易溶于水的特性,更恰当地还原了硼与方解石共沉淀过程,得到如下结论:
(1)随着初始溶液中硼浓度升高,共沉淀中硼含量升高。
(2)随着反应温度升高,由于温度对方解石形成的影响大于对B置换方解石中CO32-的影响,导致共沉淀中硼含量降低。
(3)随着pH升高,共沉淀中硼含量升高。本次实验无法解释该现象,有待深入研究。
