定量CT研究乳腺癌病人新辅助化疗前后身体组分变化对其术后恢复的影响
2022-11-29郑小敏王传彬
郑小敏 王传彬
乳腺癌是女性最常见的恶性肿瘤,占女性癌症的30%,发病率呈逐年上升趋势,且发病逐渐年轻化[1]。新辅助化疗(neoadjuvant chemotherapy,NAC)是指在实施局部治疗前所做的全身化疗,以期降低肿瘤分期,缩小手术范围,降低复发风险[2-3]。身体组分是指骨密度(bone mineral density,BMD)、肌肉含量以及体部脂肪含量。既往研究[4-6]表明,化疗期间身体组分的变化与化疗相关的毒性及营养不良有关,而术前营养状况又会影响病人的术后恢复。近年来,定量CT(quantitative CT,QCT)在量化身体组分的含量中凸显出独特的优势,能够全面、准确、高效地测量身体组分的信息,并且广泛应用于骨质疏松症的诊断[7]。目前,国内外罕有文献报道QCT测量的身体组分与乳腺癌病人术后恢复的关系。本研究旨在应用QCT测量乳腺癌病人NAC前后的身体组分参数,探讨NAC前后身体组分的变化对乳腺癌病人术后恢复的影响。
1 资料与方法
1.1 研究对象 回顾性选取2019年1月—2021年7月于中国科学技术大学附属第一医院经手术病理确诊的乳腺癌女性病人85例,年龄32~71岁,平均(52.51±3.47)岁。纳入标准:①临床病历资料完整;②行NAC联合乳腺癌改良根治术;③NAC前7 d内与治疗结束7 d内行QCT扫描。排除标准:①L1、L2椎体有囊性、硬化性或肿瘤性病变;②有椎体骨折及手术史;③合并其他原发肿瘤;④NAC前已行放疗、内分泌治疗等其他治疗。85例病人中绝经前47例,绝经后38例;TNM分期Ⅱ期31例,Ⅲ期54例;雌激素受体(estrogen receptor,ER)/孕激素受体(progesterone receptor,PR)(+)56例,ER/PR(-)29例;人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)(+)31例,HER2(-)54例;肿瘤平均直径(3.5±1.2)cm。
1.2 设备与方法 采用美国GE Discovery 750 HD 64层CT设备行常规CT扫描。病人取仰卧位,双手上举。扫描范围为L1椎体上缘至L5椎体下缘。扫描同时将QCT固体体模(V5.0,Mindways,美国)放置于检查者腰部下方,测量前常规校准。扫描参数:管电压120 kV,管电流250 mA,准直器宽度40 mm,旋转时间0.8 s/r,螺距1.375,矩阵512×512,FOV 400 mm×400 mm,层厚1.25 mm,层间距1.25 mm。
1.3 数据测量 将原始图像传至QCT图像后处理工作站(Model 4 QCT Pro系统,美国,Mindways公司),使用Mindways QCT Pro软件进行分析。按照《中国定量CT(QCT)骨质疏松症诊断指南(2018)》[7]测量L1、L2椎体BMD,计算其平均值。兴趣区(ROI)选取在椎体中心位置,避开骨皮质和椎静脉沟,包括尽可能多的骨松质(图1)。由于L3椎体层面肌肉和脂肪的面积与全身肌肉和脂肪的含量有很强的相关性[8],按照《美国放射学院、儿科放射学会和骨骼放射学会关于定量CT扫描应用指南(2018版)解读》[9],测量椎后肌群的肌肉面积,选取L3椎体中部层面的薄层横断面影像为测量层面,沿多裂肌及竖脊肌边缘手动勾画ROI,按预设阈值,软件自动获得ROI内的肌肉面积(muscle area,MA)、L3水平的皮下脂肪面积(subcutaneous fat area,SFA)和内脏脂肪面积(visceral fat area,VFA)(图2)。BMD和MA测量由2名分别有6年和8年骨肌影像诊断经验的医师独立完成,每名医师各测量1次,取2名医师的平均值作为最终测量结果。QCT参数变化值=(NAC前QCT参数值-NAC后QCT参数值)/NAC前QCT参数值,并根据QCT各参数变化值的中位数将病人分为参数变化≤中位数组、参数变化>中位数两组,即BMD变化≤8.7%组(43例)和BMD变化>8.7%组(42例);MA变化≤3.6%组(43例)和MA变化>3.6%组(42例);SFA变化≤4.5%组(43例)和SFA变化>4.5%组(42例);VFA变化≤4.5%组(43例)和VFA变化>4.5%组(42例)。

图1 椎体BMD测量示意图。A、B图分别为横断面和矢状面CT平扫影像,在椎体中心位置标记ROI。

图2 QCT身体组分测量示意图。A图示于L3 CT层面测量腰部椎后肌群肌肉面积(绿色光圈内黄色区域),B图示于L3 CT层面测量皮下脂肪面积(绿色光圈外蓝色区域)和内脏脂肪面积(绿色光圈内蓝色区域)。
1.4 治疗方法及观察指标 所有病人均行NAC+乳腺癌改良根治术。记录病人每天腋窝日引流量及腋窝引流管拔管时间。出院后随访6个月,统计病人皮下积液、皮瓣坏死、上肢水肿、感染的并发症发生情况。
1.5 统计学方法 采用SPSS 20.0软件进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示,2组间比较采用t检验;非正态分布的计量资料以中位数[M(P25,P75)]表示。计数资料以例(%)表示,2组间比较采用χ2检验。采用组内相关系数(ICC)分析2名医师测量数据的一致性,ICC<0.4表示一致性差,0.4≤ICC≤0.75表示一致性中等,ICC>0.75表示一致性良好。P<0.05为差异有统计学意义。
2 结果
2.1 NAC前后QCT参数的比较NAC后MA、SFA和VFA均小于NAC前(均P<0.05),NAC前后BMD差异无统计学意义(P>0.05),详见表1。NAC前后BMD、MA、SFA、VFA变化值的中位数分别为8.7%(3.1%,12.3%)、3.6%(1.2%,7.4%)、4.5%(1.9%,8.3%)和5.4%(2.7%,9.6%)。
2.2 2 名观察者测量NAC前后QCT参数的一致性分析2名医师测量NAC前后BMD和MA的一致性均较好(均ICC>0.75),见表2。
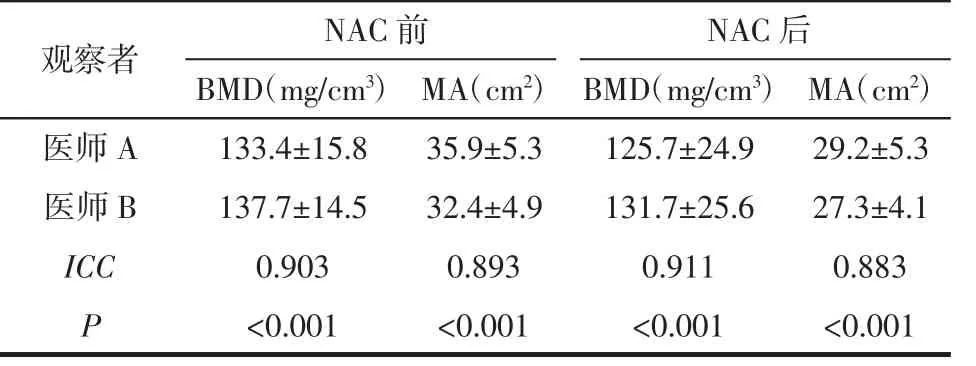
表2 2名观察者测量NAC前后QCT参数的一致性分析
2.3 QCT各参数变化2组间术后资料比较MA变化≤3.6%的病人术后腋窝日引流量、拔管时间以及皮下积液和上肢水肿的发生率均低于MA变化>3.6%的病人(均P<0.05)。按BMD、SFA、VFA变化中位数分组的各自2组间的术后资料比较,其差异均无统计学意义(均P>0.05)。详见表3。

表3 QCT各参数变化2组间术后资料的比较
3 讨论
近年来,NAC因其能够增加局部晚期乳腺癌的根治切除率而逐渐成为研究的热点[10-11]。在NAC期间,由于化疗药物的毒性容易使病人出现恶心、呕吐、腹泻、食欲减低等不良反应,导致营养状况欠佳;营养不良可致机体对手术的应激反应、愈合能力和免疫功能降低,从而影响病人的术后恢复[12-13]。目前对营养状况的评估多限于体质量等单一参数,缺乏全面、准确、定量的指标。身体组分是指体内各种成分的含量,包括骨骼、肌肉、脂肪、水和矿物质等,使用QCT可以对身体的BMD、肌肉和脂肪进行定量评估。《中国定量CT(QCT)骨质疏松症诊断指南(2018)》[7]提出QCT可进行三维BMD测量,不易受脊柱退变、体位、血管钙化等的影响,测量时选择L1、L2椎体。椎后肌群在维持脊柱稳定性、保持体位及协调躯干运动等方面发挥着重要作用,其退变程度是诊断肌肉减少的重要指标之一[14]。也有研究[8]发现,在CT影像上的L3椎体层面,所测量的肌肉和脂肪面积与全身肌肉和脂肪含量有很强的相关性。以往研究[15-16]常以L3椎体中部层面椎后肌群肌量作为肌肉减少症的诊断依据。另外,笔者既往关于肝癌QCT的2项研究[17-18]中均选取L3椎体中部层面的薄层横断面作为测量层面,沿多裂肌及竖脊肌边缘手动勾画ROI,获得肌肉面积。因此,本研究测量了乳腺癌病人NAC前后L1、L2水平的BMD以及L3水平的椎后肌群肌肉和脂肪面积,2名医师测量NAC前后BMD和MA的一致性均较好(均ICC>0.75),与笔者既往研究[18]结果相似。
本研究结果显示,NAC前后MA变化≤3.6%的病人术后腋窝日引流量、拔管时间以及皮下积液和上肢水肿的发生率均低于MA变化>3.6%的病人,提示NAC后肌肉的减少不利于乳腺癌病人的术后恢复。近年来,有报道发现肌肉减少与胃肠道肿瘤病人术后恢复及并发症的发生有关。例如,在一项对470例胃癌手术病人和一项对234例结直肠癌手术病人的研究中发现相似的结果,肌肉减少组住院时间明显较长,肌肉减少是术后并发症的独立危险因素[19-20]。此外,Reisinger等[21]对310例结直肠癌手术病人的研究发现,肌肉减少与术后脓毒症的发生密切相关。目前尚无关于肌肉变化与乳腺癌病人术后恢复的具体研究,但Lee等[22]通过观察246例局部晚期乳腺癌病人NAC期间的肌肉变化发现,在治疗期间肌肉损失与NAC疗效不佳显著相关。
乳腺癌改良根治术后常规在腋下或者局部留置引流管,拔管的时间根据引流量和术后恢复的情况而定,鉴于本研究纳入病人的手术均由同一手术团队实施,减少了因医生手术水平不同带来的偏倚。本研究发现NAC后MA变化>3.6%的病人腋窝日引流量明显增加,拔管时间明显延长。分析原因,NAC后肌肉减少明显的病人,蛋白质分解加速,免疫球蛋白、补体生成减少,胶原合成缺乏,从而降低了组织的自我修复能力,导致术后引流量增加,拔管时间延长[23]。
皮下积液、皮瓣坏死、上肢水肿和感染是乳腺癌改良根治术后的常见并发症[24-25]。本研究发现NAC后MA变化>3.6%的病人皮下积液和上肢水肿的发生率明显增加,高于MA变化≤3.6%的病人。皮下积液与腋窝引流量有关,腋窝引流量的增加形成皮下积液,导致术后引流时间延长,此结果进一步证实了肌肉减少可影响乳腺癌病人的术后恢复。乳腺癌术后上肢水肿最常见的原因是由于清扫腋窝淋巴结,导致淋巴回流受阻。术后早期上肢功能的锻炼可以预防上肢水肿的发生[26]。肌肉减少明显的病人可能体质较弱,手术后早期功能锻炼较少,导致上肢水肿的发生增加。Yabe等[27]对行全乳腺切除术的乳腺癌病人研究发现,肌肉减少是术后皮瓣坏死的危险因素,而本研究中MA变化≤3.6%与MA变化>3.6%的病人术后皮瓣坏死的发生率差异无统计学意义,可能是由于样本量较少以及治疗方案不同所致,后期需继续扩大样本量进行更深入的分析。
化疗药物具有抑制骨细胞增殖、分化,影响骨基质矿化的作用,可引起骨量减少。近年有研究[28]表明,乳腺癌病人化疗与骨病密切相关,而骨质疏松发生率与乳腺癌死亡率呈显著相关。而本研究结果显示NAC前后BMD差异无统计学意义,分析原因可能是与样本量较小有关。本研究结果还显示NAC后SFA、VFA均有所降低,机体脂肪按照分布主要分为内脏脂肪和皮下脂肪,脂肪丢失作为营养不良的一部分,与多种肿瘤的不良预后相关[18,29]。笔者既往研究[17]发现VFA的变化是肝癌病人经导管动脉化学栓塞术治疗预后的独立危险因素,而骨密度、SFA的变化与预后无关。本研究结果显示BMD、SFA、VFA的变化对乳腺癌病人的术后恢复无显著影响(均P>0.05),与笔者上述既往研究不完全相符,考虑到可能是本研究样本量较小,后续需扩大样本量进一步研究。
综上所述,QCT可对身体组分进行测量,NAC后肌肉的减少不利于乳腺癌病人的术后恢复。但本研究尚存在以下不足:①仅对腰部椎后肌群的单一层面进行了测量,对肌肉的减少只能进行初步观察和分析;②研究病例样本量较少,同时没有进行多中心研究。后续将扩大样本量进一步研究并改良测量方法,从而更全面地评估肌肉的含量。
