老年女性卵泡刺激素升高在阻塞性睡眠呼吸暂停引发阿尔兹海默病中作用的初步探讨
2022-11-29张红莉何权瀛
张红莉 何权瀛
2022年3月3日,中国科学院深圳理工大学生命健康学院、中国科学院深圳先进技术研究院叶克强团队在《Nature》发表其最新研究成果,首次提示卵泡刺激素(FSH)水平升高是老年女性比男性更易患阿尔兹海默病(AD)的重要原因,引起国内学者的关注,健康报(2022年3月4日)和中华医学信息导报(2022年3月12日)对此进行报道。该研究结果显示,切除卵巢的雌性小鼠血清FSH水平急剧升高,其与大脑神经元表达的受体结合,可激活大脑中CCAAT/增强子结合蛋白β/天冬酰胺内肽酶(C/EBPβ/AEP)通路,从而导致AD的发生[1]。据悉,该团队下一步将针对特定风险基因ApoE4与FSH的关系进行机制层面的深入研究,以解释ApoE4女性携带者更易患AD的原因。同时他们还将针对FSH特异性抗体进行临床前研究,以期为AD带来新的治疗策略。2022年3月15日Lemprière[2]在《Nature Reviews Neurology》上发表了一篇述评肯定了这一观点。女性绝经期更易发生AD的机制比较复杂,FSH在其中的作用有待进一步研究,本文将对此问题进行探讨。
一、老年期卵巢功能、雌激素水平与FSH水平变化的关系[3]
当女性进入围绝经期及绝经期,卵巢结构会发生一系列变化,如功能减退和衰老,在围绝经期卵巢萎缩、变小、质地变硬,绝经前期卵巢大小约为3.5 cm×2.0 cm×1.5 cm,绝经后1~2年可缩小为2.0 cm×1.5 cm×0.5 cm,绝经后期和晚期可进一步缩小为1.5 cm×0.75 cm×0.5 cm,同时表面皱缩,质地变硬;随着年龄增加,围绝经期卵巢中卵泡数量逐渐减少,甚至消失。相应的,女性绝经前期雌激素水平降低,血清中雌二醇水平峰值仅为年轻女性的50%,为10~15 pg/ml,绝经期后6~10年降至最低水平,绝经10年后血中雌二醇水平降低为卵泡期(生育期)的10%左右。
此情况下,机体会通过反馈机制,即通过下丘脑-垂体刺激FSH的分泌,这种反应始于绝经期前数年,因此FSH水平升高(>40 mIU/ml)是女性卵巢功能减退的征象和绝经期的确诊依据,绝经1年时FSH和促黄体生成素(LH)可分别达到早期卵泡期的13.4倍和3倍。绝经期2~3年时FSH和LH水平升高并分别为卵泡期的18.4倍和3.4倍,达到最高峰,之后FSH和LH水平不再升高,而是稳定在一定水平。在这个过程中,FSH和LH水平同时升高是女性机体的一种反馈机制。但是这种反馈的作用并不是很大,因为女性的衰老,包括生殖系统的衰老是不可抗拒的自然规律。
二、女性雌激素水平降低是发生OSA的重要原因
许多报道显示,在绝经后女性人群中OSA患病率明显上升。女性生育期OSA的患病率明显低于男性,然而进入女性更年期后,男女两性OSA患病率的差异明显减少,认为其主要原因在于雌激素对于OSA的发病具有保护作用。Dancey等[4]研究发现绝经后女性OSA患病率是绝经前女性的2倍。Netzer等[5]对年龄为24~72岁的53例女性进行调查,发现OSA组患者体内孕激素水平较对照组低;随着年龄增加,女性围绝经期OSA患病率增加,此外还发现呼吸暂停低通气指数(AHI)上升,二者呈正相关;绝经后女性AHI≥5次/小时的呼吸睡眠紊乱患病率较绝经前增加2.6倍,AHI≥15次/小时的呼吸睡眠紊乱患病率较绝经前增加3.5倍,绝经前期则无此现象发生,提示绝经和女性呼吸睡眠紊乱的患病率有非常重要的相关性。Bixler等[6]对1 000例女性和741例男性的调查结果发现,绝经前女性OSA的患病率为0.6%,绝经后且未应用激素替代治疗(HRT)的女性患病率为2.7%,与男性OSA的患病率一致,而绝经后采用HRT的女性OSA患病率仅为0.5%。多年来有关HRT的作用一直存在争议,早期观察研究资料显示,HRT可减少冠心病的发病率及其病死率,但最近一些随机研究,包括女性健康创意(WHI)研究显示,绝经多年的女性应用HRT并无诸多益处,相反会增加冠心病和乳腺癌的发病风险,但其后对WHI研究资料按年龄分层,进行随机观察研究和Meta分析,结果一致认为绝经期后开始采取HRT可减少冠心病的发病率及其病死率,还可显著减少绝经期的各种症状,降低骨质疏松及骨折的发生风险,从而改善生活质量[7]。
相关研究显示,OSA患者血清孕酮(P)、雌二醇(E2)水平与AHI呈负相关(r=-0.513,P=0.010;r=-0.426,P=0.031),与最低血氧饱和度呈正相关(r=0.449,P=0.027;r=0.517,P=0.023);E2水平与觉醒指数呈负相关(r=-0.446,P=0.029),而与其他睡眠监测指标之间无显著相关性(P>0.05),表明围绝经期及绝经后女性OSA的发生与体内雌激素、P水平下降具有相关性[8]。综合考虑多种证据显示,在女性OSA发病过程中,女性雌激素发挥一定作用。据推测,绝经期对于睡眠呼吸的作用是多方面的,包括对上气道肌肉和呼吸驱动的调节及上气道解剖结构的改变,中年以后出现体重增加,脂肪组织在颈部沉积,均可影响到上气道的开放功能,此外年龄增加本身对于睡眠呼吸障碍的发生也可能有更大的作用[9]。上述研究均提示女性雌激素水平降低在女性OSA的发病中起到重要作用。
三、OSA与AD的关系
AD是一种神经系统退行性疾病,其以睡眠障碍与认知功能障碍进行性进展为主要临床表现,在老年人群尤其是老年女性中多发,是老年人最常见的神经系统退行性疾病。AD患者的睡眠节律与睡眠结构明显紊乱,表现为睡眠潜伏期延长、夜间多醒、慢波睡眠减少、总睡眠时间减少及白日嗜睡增多等睡眠紊乱现象,此外,还可出现激越综合征,表现为梦魇、幻觉及夜间的行为异常。OSA患者合并多种认知功能障碍,如注意、警觉、记忆与执行功能下降。很多研究发现,OSA的认知功能障碍可能会从早期的轻度认知功能障碍发展为AD[10]。
老年人中OSA高发,AD也是其常见的神经系统退行性病变,早期研究认为两者可能是各自独立的疾病,近十年来研究者观察到OSA与AD常常共存,两者之间关系密切。一项前瞻性研究结果发现,AD组患者合并睡眠呼吸障碍达42.9%,而对照组仅为4.3%,且AD患者痴呆程度与AHI显著相关[11]。Xu等[12]采用简易智力状态检查(MMSE)量表探讨重度OSA患者整体认知功能情况,结果发现重度OSA组与对照组的MMSE量表结果差异显著,而MMSE评估的认知功能障碍往往提示患者进展为AD的风险较高。一项研究纳入近300例老年女性OSA患者,平均年龄82.3岁,入组时均无AD、均为中-重度OSA(AHI均≥15次/小时),平均随访4.7年,结果表明与对照组(AHI<15次/小时并匹配其他因素)相比,老年女性OSA组患者认知功能损伤严重,后期AD发病率更高,发生AD风险OR值为1.85(校正其他影响因素后);同时发现影响整体认知功能最显著的因素是氧饱和度下降指数(ODI),因此推测睡眠呼吸暂停可能会导致脑功能障碍[13]。
四、OSA促进AD发生的可能机制
OSA促进AD发生的机制尚不完全明确,初步认为可能包括以下几个方面:
1.β-淀粉样(Aβ)蛋白沉积假说:Aβ蛋白沉积假说是目前被广泛接受的AD最主要的发病机制。Aβ是一种由淀粉样前体蛋白(APP)经β-与γ-分泌酶的蛋白水解作用而产生的含有39~43个氨基酸的多肽,可由多种细胞产生,循环于血液、脑脊液与脑间质液中。Aβ蛋白沉积于中枢神经系统,形成沉积斑块,引发神经不良反应,从而导致中枢神经系统萎缩、退化与神经元丢失及老年斑形成,最终导致认知障碍发生[14]。OSA的病理特征是夜间反复发生呼吸暂停与低氧血症。Seino等[15]的多项研究表明,缺氧可上调APP表达,减少Aβ蛋白的清除,促进Aβ蛋白沉积作用,并产生神经不良反应,诱导认知障碍发生。
2.Tau蛋白过度磷酸化:Tau蛋白过度磷酸化是AD的另一可能病理机制。微管系统是神经细胞骨架成分,可参与多种细胞功能。微管由微管蛋白与微管相关蛋白组成,Tau蛋白是含量最高的微管相关蛋白。正常脑组织中,Tau蛋白的功能是与微管蛋白结合促使其聚合形成微管,并与形成的微管结合维持微管稳定性,降低微管蛋白分子的解离。AD患者脑组织中Tau蛋白发生过度磷酸化,从而丧失正常生理功能。相关研究表明缺氧通过细胞外信号相关激酶系统促进Tau蛋白磷酸化,进而使神经退行性改变,这可能是OSA诱导AD的另一种机制[13]。
3.神经系统氧化应激与炎症反应:氧化应激与炎症反应是OSA、AD认知功能障碍的共同机制。神经系统氧化应激与炎症反应可促进、上调Aβ蛋白在神经系统中的沉积及Tau蛋白磷酸化,进一步损伤皮层和海马神经元细胞,上调细胞内钙离子水平,诱导caspase(如caspases-3、caspases-8、caspases-10)过表达,从而诱导细胞凋亡、灰质体积萎缩,最终影响神经认知功能。一项研究结果发现,慢性间歇缺氧可诱导小鼠海马细胞内钙超载,caspase-3等表达水平增加,同时水迷宫实验检测结果显示小鼠认知功能障碍明显[13]。
近年来也有一些研究评估持续气道正压通气(CPAP)治疗对于合并OSA的AD患者认知功能的作用。相关文献报道,同时患有OSA与AD的患者(AHI≥30次/小时)CPAP治疗3个月后随访3年,3年中患者认知功能下降速度较对照组明显减慢,甚至或可在某种程度上改善患者的认知功能障碍及睡眠状态[16]。此外有研究显示,应用CPAP治疗OSA患者可减少其认知功能下降程度,改善睡眠状态;同时治疗OSA可能有助于稳定脑脊液中的Aβ蛋白和Tau蛋白水平,相应改善个体认知功能和白天的状态[17]。但是也有相反的研究结果,有研究结果发现与对照组(未进行CPAP治疗)相比,连续3周CPAP治疗组患者的认知功能并无明显改善[18]。对此有学者提出,OSA患者所发生的记忆功能障碍至少需要为期6个月的CPAP治疗才能部分恢复,因此强调对于改善OSA患者的认知功能进行CPAP的治疗时间是一个关键因素[19]。
睡眠呼吸暂停与AD存在共病现象,两者均可导致以学习记忆为主的广泛认知功能障碍。间歇缺氧可导致氧化应激、炎症反应、信号通路的异常激活,引起神经元细胞损伤、星形胶质细胞和小胶质细胞的异常活化、海马微血管系统改变、体内代谢紊乱,从而使与认知功能相关的脑部区域组织损伤,特别是海马区域,最终引起认知功能障碍[20]。这可能是OSA促进AD发生发展的主要原因之一。总之,我们认为雌激素水平降低是导致OSA患病率升高的重要原因,而OSA又可严重损害认知功能,因而认为OSA与AD关系密切,在此过程中FSH水平升高只是一个附带现象,可能并不是引发AD的重要原因,三者之间的关系见图1。
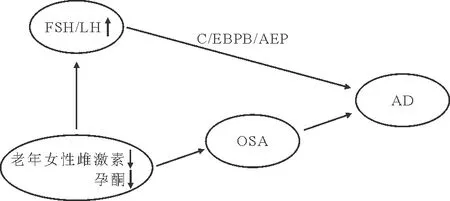
图1 女性更年期雌激素水平、OSA与AD之间的关系
