初发点滴型银屑病患者皮损表面的微生物菌群结构发生变化
2022-11-28张嘉张凯云陈涛赵娟王红梅薛迎芳张国惠
张嘉, 张凯云, 陈涛, 赵娟, 王红梅, 薛迎芳, 张国惠
1.包头市中心医院,2.内蒙古科技大学包头医学院,包头 内蒙古 014040
银屑病是环境和遗传共同作用的非传染性、慢性炎症性疾病,临床表现为红斑基础上的鳞屑、斑片、斑块皮损,病理表现为角质形成细胞增殖加速,角化过度或角化不全[1]。银屑病患者角质形成细胞过度增殖并且伴随炎症浸润,可导致皮肤菌群失调及机体免疫耐受性下降,诱发银屑病加重或发作[2]。部分银屑病患者在皮损出现前有前驱的上呼吸道感染症状,同时在鼻咽处发现细菌与病毒的异常分布[3-4],提示银屑病发病可能与微生物菌群失调有关。随着基因组学理论与技术的高速发展,16S rDNA测序技术已成熟运用于银屑病患者微生物菌群结构分析中[5],银屑病患者肠道菌群已被证实出现明显的微生物菌群失调[6]。
为进一步探究银屑病发病与皮肤表面微生物菌落失调之间是否具有直接或间接的关系,本研究采用16S rDNA测序技术分析初发点滴型银屑病患者皮损表面菌群结构,探究银屑病患者皮损表面菌群组成与银屑病发病的相关性,明确上呼吸道感染是否能够影响点滴型银屑病患者皮损表面微生物的结构,希望通过探究银屑病发病与皮肤表面微生物菌落失调之间的关系,形成以微生物稳态纠正为靶点的治疗方向。
1 对象与方法
1.1 实验对象
纳入2020年12月至2021年6月于包头市中心医院皮肤科就诊的初发点滴型银屑病的患者18例,点滴型银屑病确诊标准:① 临床表现:浸润性粟米至蚕豆大、表面附有白色鳞屑的丘疹、斑丘疹,散在或密集分布, Auspitz征阳性。② 皮肤镜下出现银屑病特征性表现(亮红色背景,点状血管或小球状血管,血管一致性分布,可见白色鳞屑,出现环状血管或者发夹样血管为特异诊断)。纳入标准:①首次发病且诊断为点滴型银屑病的患者;②年龄5~65岁;③近2个月内未系统使用任何抗生素、免疫抑制药物和糖皮质激素者,1 周内未外用抗生素;④24 h 内未冲澡或搓澡;⑤否认其他器质性疾病者。排除标准:① 患有其它皮肤性疾病、近期有皮肤创伤或感染未愈者;② 患有糖尿病、肝病、肾病等其他可能导致皮肤表面微生物菌群改变者。将18例银屑病患者按照是否伴随上呼吸道感染分为上呼吸道感染实验组(银屑病上感组,9例)、非上呼吸道感染实验组(银屑病非上感组,9例)。对照组选取同年龄段9例健康人。三组年龄(F=0.13,P=0.876)、性别(F=0.14,P=0.872),银屑病上感组与非上感组病程(t=0.88,P=0.391)比较,组间差异均无统计学意义(表1),具有可比性。患者均签署知情同意书,研究经本院伦理委员会审批通过。

表1 三组一般资料Table 1 Characteristics of the three groups
1.2 主要试剂
DNA抽提试剂盒(Thermo Scientific),Phusion High-Fidelity PCR Master Mix with GC Buffer(New England Biolabs),Gene JET 胶回收试剂盒(Thermo Scientific)。
1.3 实验方法
1.3.1 标本采集 用无菌水润湿无菌棉签,加压顺时针方向擦拭躯干、四肢红色皮疹处,每次擦拭时间不小于30 s,擦拭后将无菌棉签放入无菌离心管中,将离心管置于-20 ℃冰箱中保存。对照组取材部位及方法与患者组一致。
1.3.2 样本DNA的提取 采用CTAB法提取皮肤表面微生物DNA,在360 nm 紫外灯下观察电泳条带情况,检测所提取DNA的纯度和浓度。
1.3.3 PCR 扩增和纯化 取适量的上述基因组DNA样品于离心管中,加入无菌水稀释样品至1 ng/μL。选择16S V4 区进行测序,引物为515F-806R,515F:5′-GTGCCAGCMGCCGCGGTAA-3′;806R:5′-GGACTACHVGGGTWTCTAAT-3′;PCR 反应体系30 μL:Phusion Master Mix(2×) 15 μL,Primer(2 μM) 3 μL(6 μM),gDNA(1 ng/μL) 10 μL(5-10 ng),H2O 2 μL;反应程序:98 ℃预变性1 min;98 ℃,10 s,50 ℃,30 s,72 ℃,30 s,30个循环;72 ℃,5 min。使用2%琼脂糖胶电泳纯化PCR 产物,选择主带大小在400~450 bp之间的序列,使用Thermo Scientific公司Gene JET胶回收试剂盒,处理目标条带,收集PCR 产物。
1.3.4 文库构建和上机测序 使用Illumina公司TruSeq DNA PCR-Free Library Preparation Kit建库试剂盒进行构建,采用Qubit进行定量和文库检测,文库检测合格后,使用NovaSeq 6000进行上机测序。
1.4 统计学处理
将有效序列按照97%相似性进行Operational Taxonomic Unit聚类[7],组内物种差异采用α多样性分析[8],组间物种差异采用β多样性分析[9],组间具体物种分析采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 OTU 聚类分析
将有效序列进行聚类分析,发现本次实验OTU聚类结果共有6 596条,其中门(Phylum)、纲(Class)、目(Order)、科(Family)、属(Genus)、种(Species)分别发现80、145、314、502、 1 192、672种。根据OTUs聚类结果制作韦恩图,可见三组样本中含有相同物种,也含有该组的特有物种(图1)。

图1 维恩图
绘制初发点滴型银屑病上感组、非上感组、正常人群对照组三组在门水平物种相对丰度柱形图(图2),可见优势物种为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria),上述三组的前三优势物种丰度分别为厚壁菌门 19.65%、32.68%、20.29%;变形菌门分别为46.13%、32.39%、39.14%;放线菌门分别为26.31%、26.10%、32.67%,三组间优势门物种丰度差异无统计学意义(厚壁菌门、变形菌门、放线菌门P值分别为0.056、0.065、0.320)。由三组间在属水平物种相对丰度柱形图(图3)可见,细菌丰度由高到低的前9名分别为棒状杆菌属(Corynebacterium)、葡萄球菌(Staphylococcus)、Allorhizobium-neorhizobium-Pararhizobium-Rhizobium、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)、微球菌属(Micrococcus)、栖水菌属(Enhydrobacter)、丙酸杆菌属(Cutibacterium)、乳酸杆菌属(Lactobacillus),而链球菌属(Streptococcus)排第12位。

图2 门水平上物种相对丰度柱形图

图3 属水平上物种相对丰度柱形图
2.2 属水平丰度聚类
根据所有样本在属水平的物种注释及丰度信息,选取了丰度排名前35的属,绘制成热图(图4)。横向观察该图,初发点滴型银屑病上感组优势物种为假单胞菌属、栖水菌属、考克氏菌属(Kocuria)、异常球菌属(Deinococcus)、芬戈尔德菌属(Finegoldia);初发点滴型银屑病非上感组优势物种为嗜冷杆菌属(Psychrobacter)、Turicibacter、芽孢杆菌属(Bacillus)、罗姆布茨菌属(Romboutsia)、微球菌属、副球菌属(Paracoccus)、Sandaracinobacterium、Jeotgalicoccus。纵向观察该图可见,每个样本在属水平优势物种的相对丰度大小均不同。

图4 物种丰度聚类热图
2.3 α多样性分析
采用Alpha Diversity进行组内样本物种多样性进行分析。稀释曲线检验实验样品数据是否合理(图5),根据已抽取的测序数据量与对应的指数值构建曲线(cutoff=59852),随着随机提取测序数据的增加,后端曲线趋于平坦,本次实验样品数据合理。使用Qiime软件(Version 1.7.0)计算Alpha多样性指数,包含Observed-species、Chao1、
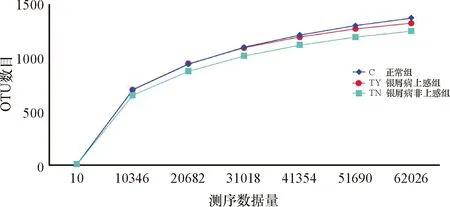
图5 样本稀释性曲线
Shannon、Simpson、ACE和Goods-coverage指数。单因素方差分析3组间 α 多样性,各组间差异均无统计学意义 (表2)。
2.4 Beta多样性分析
采用Beta多样性比较三组间微生物群落构成,评估微生物群落间的差异。通过wilcox 秩和检验分析三组组间物种Beta多样性差异,箱形图(图6)展示如下,对照组与银屑病上感组(P=0.003)、非上感组(P<0.05)比较,差异具有统计学意义,而银屑病上感组与非上感组间无明显差异(P=0.062)。

表2 α 多样性指数的比较Table 2 Comparison of alpha diversity index
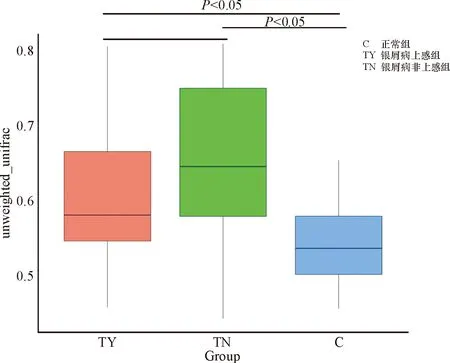
图6 基于Unweighted Unifrac的 Beta多样性箱形图
考虑到皮肤表面微生物菌落结构为生态结构,采用无度量多维标定法(non-metric multi-

图7 基于Unweighted Unifrac的 NMDS分析
dimensional scaling,NMDS)对三组间物种组成进行结构分析(图7)。结果显示,正常组实验样本较为聚类集中,银屑病非上感组和上感组实验样本较为分散,且聚集区域不同,说明正常组微生物菌落结构不同于初发点滴型银屑病组。
2.5 组间差异性物种分析
正常组与银屑病非上感组对比,在门水平,正常组Campylobacterota门丰度较高;在纲水平,正常组γ-变形菌纲丰度较高,在属水平,正常组的丙酸杆菌属、劳森菌属(Lawsonella)、放线菌属(Actinomyces)、Auricoccus-Abyssicoccus丰度较高。正常组与银屑病上感组对比,在属水平,正常组劳森菌属丰度较高,银屑病上感组未明确定义周蝶菌属(unidentifiedWeeksellaceae)丰度较高;银屑病上感组与非上感组对比,在纲水平,银屑病上感组γ-变形菌纲丰度较高;在目水平,银屑病上感组假单胞菌目(Pseudomonadales)丰度较高;在属水平,银屑病上感组栖水菌属、假单胞菌属丰度较高,差异均有统计学意义 (均P<0.05,表3)。
2.6 组间LEfSe分析
为进一步验证组间物种差异性,采用LEfSe(LDA Effect Size)分析银屑病上感组、非上感组和正常组三组间物种丰度数据,寻找组间具有统计学差异的Biomarker。将LDA阈值设置为4,发现LDA数值大于4的Biomarker有11个,初发急性点滴型银屑病上感组与其他组对比具有极其显著差异的物种为Gammaproteobacteria、Pseudomonadales、Enhydrobacter、Rhizobiales、Pseudomonadaceae、Pseudomonas;正常组与其他组对比具有极其显著差异的物种为Dermabacteraceae、Brachybacterium、Propionibacteriaceae、Cutibacterium、Propionibacteriales;银屑病上感组中未发现极其显著差异的物种。LDA值分布柱状图见图8,进化分支图见图9。
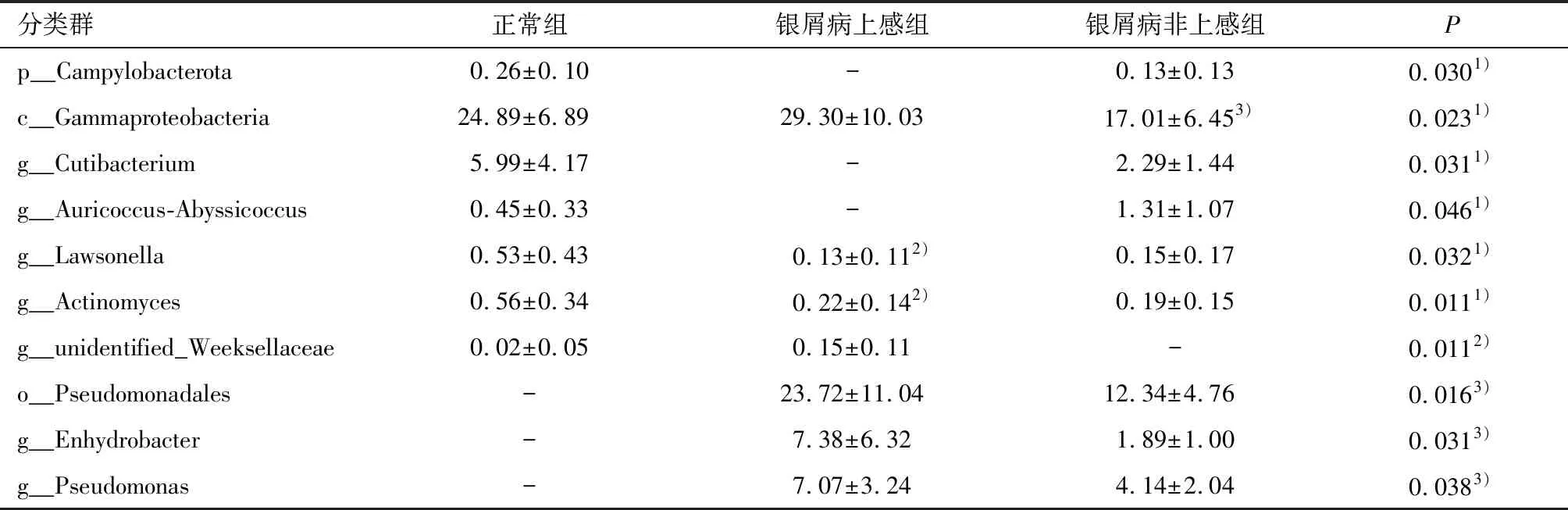
表3 三组间皮肤表面微生物的丰度 (mean±SD)Table 3 The abundance of microorganisms on skin surface among three groups (mean±SD)

图8 LDA值分布柱状图

图9 进化分支图
3 讨论
在银屑病患者皮损表面微生物菌群分析中,Gao等[10]发现在门水平银屑病患者皮肤放线菌门和变形菌门丰度下降,厚壁菌门丰度增加,在属水平,链球菌属和葡萄球菌属丰度增加;而另有研究发现在银屑病患者皮损中放线菌门、变形菌门丰度增加[11],研究结果的不同可能与取材方法不同相关。
本研究采用16S rDNA 测序初发点滴型银屑病患者与健康人群皮肤表面微生物,发现正常组人群皮肤痤疮杆菌属丰度明显高于银屑病非上感组,与Fyhrquist[12]、Langan等[13]研究结果相似。丙酸痤疮杆菌在银屑病患者皮损表面的减少可能与抓挠皮肤相关,搔抓皮肤可破坏皮肤屏障,使病原菌进入皮肤。在真皮深层甚至外周血液中都会发现一些表皮定植的细菌,它们与免疫细胞接触,引起先天性和获得性炎症[14]。丙酸痤疮杆菌是一种保护性共生菌,是皮肤微生物的重要组成部分,在皮肤动态平衡中起着重要作用,是人类皮肤微生物群的哨兵[15]。在皮肤免疫中,丙酸痤疮杆菌可以调节CD4+T细胞的免疫应答[16],促进体内辅助性T细胞1型(Th1)细胞的激活[17],清除细胞内病原体,发挥丙酸痤疮杆菌竞争优势,抑制致病微生物的定植,从而起到保护皮肤作用。有研究在IB型和Ⅲ型丙酸痤疮杆菌中发现了一个能够产生抗菌肽的基因簇[18],抗菌肽的出现可从一定程度上抑制病原菌的生长繁殖,起到皮肤屏障作用。
本研究还发现初发点滴型银屑病非上感组放线菌属和劳森氏菌属丰度比正常人群低,而Weeksellaceae属丰度较高,具体机制不明,上述菌属与银屑病发病机制的研究目前停留在菌群差异方面[19-20]。 本实验未发现链球菌属在各组之间的差异性,但有学者发现化脓性链球菌可通过超抗原诱导的T细胞活化参与银屑病发病,真皮层中的链球菌超抗原直接与人类白细胞抗原、巨噬细胞、树突状细胞和角质形成细胞上的DR同种型分子(HLA-DR)结合,导致白介素-1和肿瘤坏死因子-α释放,从而增强炎症反应,这可能引发或加剧银屑病炎症[21]。化脓性链球菌还可通过皮肤淋巴细胞相关抗原阳性T细胞与表皮细胞的相互作用,诱导产生IL-9、IL-17A和IFN-γ,参与银屑病发病过程[22],推测这一差异性结论的出现可能与取材部位不同相关。
除上述细菌外,皮肤表面真菌的异常分布也可能参与银屑病的发病过程,马拉色菌是人体皮肤表面常见的一种真菌,可通过调控细胞因子的释放参与银屑病的发病过程,马拉色菌通过Toll样受体2途径触发细胞因子IL-8的释放[23],IL-8可上调角质细胞中转化生长因子-β、热休克蛋白70和整联蛋白的表达[24],同时激活补体并募集中性粒细胞,诱导炎症细胞向真皮迁移[25],从而导致角质形成细胞过度增殖,加速银屑病发病进程。马拉色菌可下调Th2细胞诱导的IL-4、IL-10及IL-13等细胞因子,参与银屑病的发病机制[26]。
本研究将初发点滴型银屑病分为上呼吸道感染组和非上呼吸道感染组进行研究发现,上呼吸道感染组栖水菌属、假单胞菌属丰度都较高,这两个菌属都属于γ-变形菌纲,与Wang等[27]研究结果相似。提示在后续的银屑病皮损微生物研究中应该将银屑病患者是否具有上呼吸道感染症状纳入实验因素,将具有上呼吸道感染症状和不具有上呼吸道感染症状的患者分开比较,可能更具科学性。
综上所述,银屑病患者皮损表面微生物菌群结构发生了一定变化,但具体原因不明,需进一步研究银屑病患者皮损表面微生物菌群稳态变化,了解皮肤菌群失调是否为诱发或加重银屑病发病的因素。在探讨银屑病发病机制的过程中,通过调整银屑病患者皮损表面微生物菌群稳态,可为银屑病的治疗带来新的诊疗思路。
