基于响应面的苦荞萌发工艺优化及抗氧化活性研究
2022-11-28郭丽丽李小兰孙杰杨晓莹王小敏秦楠
郭丽丽,李小兰,孙杰,杨晓莹,王小敏,秦楠
山西中医药大学中药与食品工程学院(晋中 030619)
苦荞是一种营养价值很高的药用及食用植物,广泛种植于中国、日本、俄罗斯、欧洲等国家和地区。苦荞中含有蛋白质、脂肪、维生素、矿物质,以及极为丰富的生物活性成分——黄酮类化合物,具有明显的降血糖、降血脂、降血压、抗肿瘤、抗氧化、消除体内自由基、增强免疫力及保护心脑血管等多种功效,被开发为胶囊、片剂、粉末、醋和茶等多种功能食品形式,备受消费者青睐。然而,苦荞籽粒所具有的苦、涩、硬等感官特性,加之未加工苦荞中存在的较多抗营养因子,在一定程度上限制了苦荞原料的广泛开发利用,因此,有必要对苦荞资源的合理加工及应用途径进行研究,在满足民众对食品多样化与营养化消费需求的同时,增强对该资源利用的产业化和丰富化。
研究表明,苦荞籽粒经萌发处理后,不仅因质地改变而提高其中蛋白质和淀粉的生物利用度,降低或消除有毒、有害、抗营养物质含量,更重要的是可提高γ-氨基丁酸、游离氨基酸等生物活性物质的含量,尤其是芦丁、槲皮素等黄酮类活性化合物含量显著增加,抗氧化能力也明显增强,这表明萌发是提升苦荞食用品质和营养价值的有效途径。不同的发芽条件会造成发芽能力、生物代谢途径、代谢物合成种类和数量等方面的差异,进而影响苦荞芽的营养和功能特性,研究苦荞籽的萌发工艺对于有效富集苦荞资源中的生物活性成分,从而促进对其合理开发利用具有重要意义。试验采用响应面法对苦荞麦的萌发工艺进行系统研究,对萌发过程中芦丁、槲皮素等黄酮类化合物的含量进行实时监测,并比较萌发前后苦荞麦的抗氧化活性,以期为促进苦荞及其黄酮类物质的深度开发利用、研制和开发新型苦荞食品提供可靠的理论依据。
1 材料与方法
1.1 材料与试剂
苦荞籽粒(山西田泽杂粮种子有限公司);芦丁标准品(批号195128)、L-抗坏血酸标准品(批号190120),均来自上海融禾医药科技公司;槲皮素标准品(批号C12110861,上海麦克林生化科技有限公司);2, 2-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS,批号AK112904,合肥博美生物科技有限责任公司);1, 1-二苯基-2-苦肼基(DPPH,批号CD29142801,北京酷来搏科技有限公司);乙腈、甲醇、磷酸(均为色谱级,天津市北辰方正试剂厂);超纯水(娃哈哈饮用水有限公司);其余试剂如亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇、过硫酸钾、硫酸铜、甲醇为分析纯。
1.2 仪器与设备
HH-4数显恒温水浴锅(金坛市杰瑞尔电器有限公司);U1tra-3600紫外可见分光光度计(北京普源精电科技股份有限公司);GZX-9030MBE电热鼓风干燥箱(上海博讯实业有限公司医疗设备厂);SB25-120超声波清洗机(宁波新芝生物科技股份有限公司);TD4Z-WS湘立离心机(湖南湘立科学仪器有限公司);AR223CN电子天平(常州奥豪斯仪器有限公司);RIGOL L-3000高效液相色谱仪(北京普源精电科技股份有限公司)。
1.3 试验方法
1.3.1 苦荞萌发及处理方法
苦荞萌发及处理参考文献[1]。将苦荞种子进行去杂、筛选、清洗等预处理,去除原料中的未成熟、不饱满粒,得到干净均匀的苦荞种子。将种子置于浸湿的纱布中,采用4层纱布垫底、2层纱布覆盖的方式对种子进行萌发处理。萌发后的种子置于60 ℃电热鼓风干燥箱干燥2 h,脱壳,磨成粉末待用。
1.3.2 发芽率测定
每组苦荞麦种子样品为100粒,每次萌发完成后统计发芽种子数量,按式(1)计算发芽率[2]。
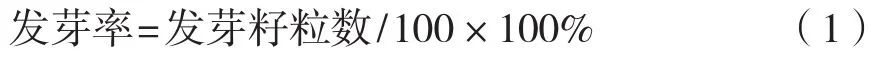
1.3.3 总黄酮含量测定
准确称取1.0 g苦荞粉末,精确至0.001 g,置于100 mL三角瓶中,加入30 mL 70%甲醇溶液,在50 ℃下超声浸提30 min后于3 000 r/min离心10 min,上清液用70%甲醇溶液定容至50 mL作为待测液。分别准确量取5.0 mL试样待测液及0.0,1.0,2.0,3.0,4.0,5.0和6.0 mL 0.2 mg/mL的芦丁标准溶液置于25 mL容量瓶,加水至6 mL,加1 mL 5%亚硝酸钠溶液,摇匀后放置6 min,加1 mL 10%硝酸铝溶液,摇匀后放置6 min,加10 mL 4%氢氧化钠溶液,加水至刻度,摇匀,静置15 min,于508 nm测定标准液及待测液的吸光度[3]。以芦丁标准溶液浓度为横坐标,相应吸光度为纵坐标,制得标准曲线并得到线性回归方程y=9.668 8x+0.017(R2=0.994 0),继而将待测液吸光度代入方程求出样品中的总黄酮浓度,按照式(2)得总黄酮含量(X,mg/g)。

式中:C为计算所得的测定液总黄酮浓度,mg/mL;V1为测定溶液总体积,25 mL;V2为待测液取样体积,5 mL;V3为待测液总体积,50 mL;m为苦荞粉末质量,1.0 g。
1.3.4 苦荞萌发工艺的单因素试验
选取苦荞种子若干组,每组100粒,分别在一定的浸泡时间(6,8,10,12和14 h)、萌发时间(48,53,58,63和68 h)和萌发温度(15,20,25,30和35 ℃)下进行萌发,分别测定发芽率和总黄酮含量,并计算综合评分,其中各因素固定水平为浸泡时间8 h、萌发时间58 h、萌发温度25 ℃。
采取加权法计算综合评分,将发芽率和总黄酮含量两者的权重均设为50。

1.3.5 苦荞萌发工艺的响应面试验
在单因素试验基础上,进一步研究浸泡时间(A)、萌发时间(B)和萌发温度(C)3个因素之间的交互作用,以由发芽率和总黄酮含量组成的综合评分为指标,采用Design-Expert软件进行Box-Behnken三因素三水平响应面试验(共17组),从而确定最优的苦荞萌发工艺。响应面因素水平编码表如表1所示。

表1 响应面试验因素与水平
1.3.6 苦荞萌发过程中芦丁和槲皮素的动态变化
按最佳萌发工艺进行苦荞萌发,并分别精密称取1.500 g萌发0,6,12,18,24,30,36,42,48,54和59 h并经研磨过0.180 mm孔径(80目)筛的苦荞粉末,用40 mL 70%甲醇溶液超声提取30 min后抽滤,提取液用70%甲醇溶液定容至50 mL,得样品溶液。进行HPLC分析,记录芦丁和槲皮素的峰面积,采用外标法进行含量测定,绘制苦荞中芦丁和槲皮素随萌发过程的动态变化曲线。其中:芦丁含量测定所用的标准曲线为y=25.662x-195.04,R2为0.999 7,线性范围为10~100 μg/mL;槲皮素含量测定所用的标准曲线为y=34.544x-108.37,R2为0.999 6,线性范围为10~50 μg/mL。
HPLC色谱条件[4]:Agilent ZORBAX EXTEND-C18色谱柱(4.6 mm×250 mm,5 μm),进样量10 μL,洗脱流速0.7 mL/min,柱温35 ℃,DAD检测器,检测波长256 nm,流动相为乙腈(A)-0.2%磷酸水溶液(B)。洗脱程序:0~8 min,15%~22% A;8~20 min,22% A;20~30 min,22%~30% A;30~32 min,30%~15% A。
1.3.7 萌发前后苦荞的抗氧化活性比较
用70%甲醇溶液提取发芽前后苦荞麦中的总黄酮(50 ℃下超声浸提30 min),将提取液旋转蒸发至干得总黄酮提取物,进行体外抗氧化活性测定。
DPPH·清除能力的测定参照文献[5]。分别取1 mL阳性对照VC和总黄酮提取物的系列稀释溶液(0.2,0.4,0.6,0.8和1.0 mg/mL)置于试管中,分别加入2 mL 0.1 mmol/L DPPH·自由基溶液,振荡均匀后避光静置20 min,在517 nm波长处测吸光度(A1)。以2 mL无水乙醇代替 DPPH溶液,同上测得各管吸光度(A2);以1 mL无水乙醇代替样品液为空白组,同上测得各管吸光度(A0)。DPPH·清除率按式(4)计算。
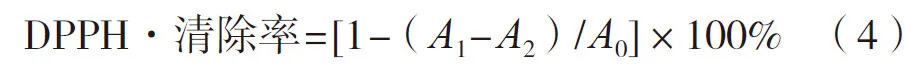
ABTS+·清除能力的测定参照文献[6]。取7.4 mmol/L ABTS二胺盐和2.6 mmol/L过硫酸钾各1 mL,混合后暗处反应12 h,用无水乙醇稀释40倍,得在734 nm处吸光度为 0.70的ABTS+·工作液。分别取1 mL阳性对照VC和总黄酮提取物的系列稀释溶液(0.2,0.4,0.6,0.8和1.0 mg/mL)置于试管中,分别加入2 mL ABTS+·工作液,振荡均匀后避光静置30 min,在734 nm波长处测吸光度(A1)。以2 mL无水乙醇代替ABTS+·溶液,同上测得各管吸光度(A2);以1 mL无水乙醇代替样品液为空白组,同上测得各管吸光度(A0)。ABTS+·清除率计算同式(4)。
1.4 数据处理
采用Origin 9.0软件绘图,试验结果为3次平行的平均值。
2 结果与讨论
2.1 单因素试验
2.1.1 浸泡时间对苦荞种子萌发的影响
随着浸泡时间的延长,苦荞籽发芽率整体呈升高趋势(图1A),这是因为通过浸种处理可活化相关酶类,从而使苦荞种子解除休眠,促进后续萌发[7]。浸泡时间12 h时,发芽率达到85.67%,继续延长浸泡时间,发芽率增长不显著。与此同时,总黄酮含量也随浸种时间的延长而逐渐上升,这可能与不断升高的萌发程度有关系。随着浸种时间的延长,发芽率不断升高,萌发程度不断增强,使得总黄酮含量不断增大[8]。总黄酮含量在浸种12 h时为11.18 mg/g,浸种时间继续延长2 h,总黄酮含量增加0.26 mg/g,故从萌发效率兼顾生产的角度考虑,选择浸泡时间12 h为响应面设计的0水平,此时综合评分也较高(96.85分,图1B)。
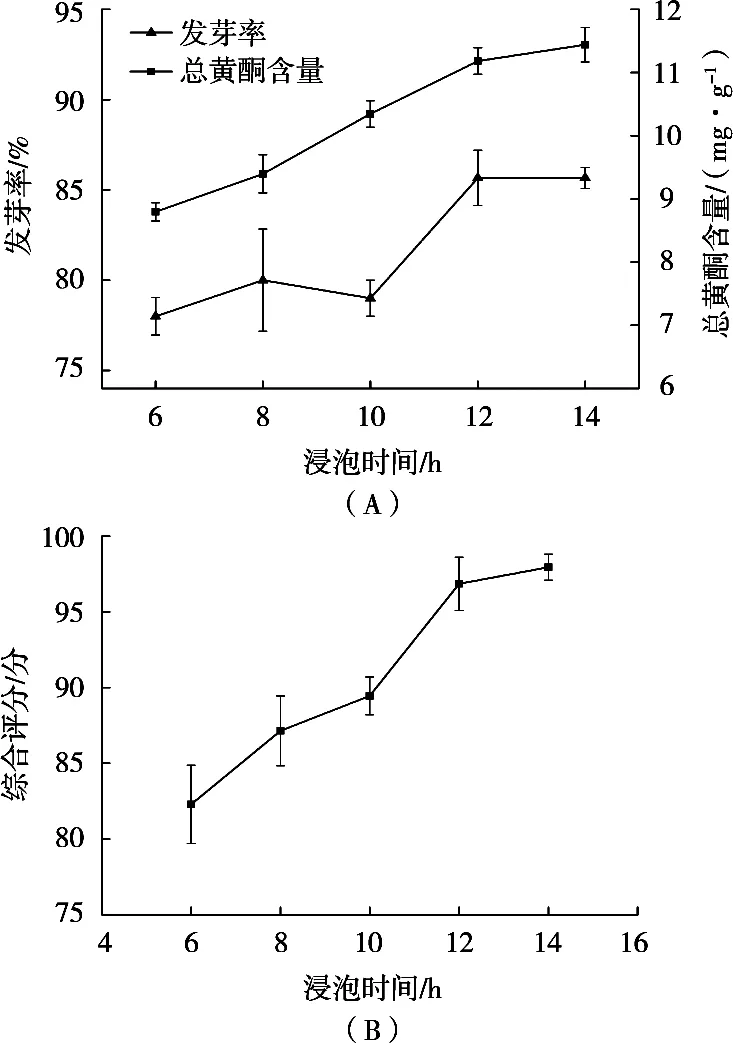
图1 浸泡时间对苦荞发芽率和总黄酮含量(A)及综合评分(B)的影响
2.1.2 萌发时间对苦荞种子萌发的影响
由图2(A)可知,随着萌发时间的延长,发芽率不断升高,而总黄酮含量先增长后降低,萌发时间58 h时,总黄酮含量达到最高,说明适当延长萌发时间可在一定程度上提高总黄酮含量,但过长的萌发时间可能会过多消耗苦荞种子中的营养物质[9],从而使得总黄酮含量降低,与Zhou等[10]的研究结果相一致。结合综合评分(图2B),选取58 h为响应面设计中萌发时间因素的0水平,此时综合评分为95.81分。

图2 萌发时间对苦荞发芽率和总黄酮含量(A)及综合评分(B)的影响
2.1.3 萌发温度对苦荞种子萌发的影响
在合理的萌发温度下,适度升高温度可以促进植物萌发。但温度过高会导致苦荞籽粒中的酶类物质失去催化活力,从而抑制萌发。由图3(A)可知,萌发温度25 ℃时,发芽率和总黄酮含量均达到最大,这表明随着萌发的进行,总黄酮含量不断升高,当萌发受到抑制时,总黄酮的生物合成也随之受到影响。彭涛等[11]以营养成分芦丁和烟酸含量变化为指标,发现苦荞萌发的最佳温度为25 ℃,与试验结果一致。蔡利等[12]以种子萌发率和总黄酮含量为指标研究了苦荞种子萌发条件,结果也表明25 ℃为最佳温度。然而,朱云辉等[13]采用苦荞发芽富集γ-氨基丁酸,通过优化条件,发现苦荞发芽最佳温度为32 ℃。这说明不同萌发条件会影响苦荞中营养活性成分的合成累积,在接近室温的温度下萌发利于黄酮类化合物的合成转化,而略高于室温的温度更利于氨基酸类化合物的富集形成。综上,选取萌发温度25 ℃为响应面设计的0水平,此时综合评分为95.87分(图3B)。
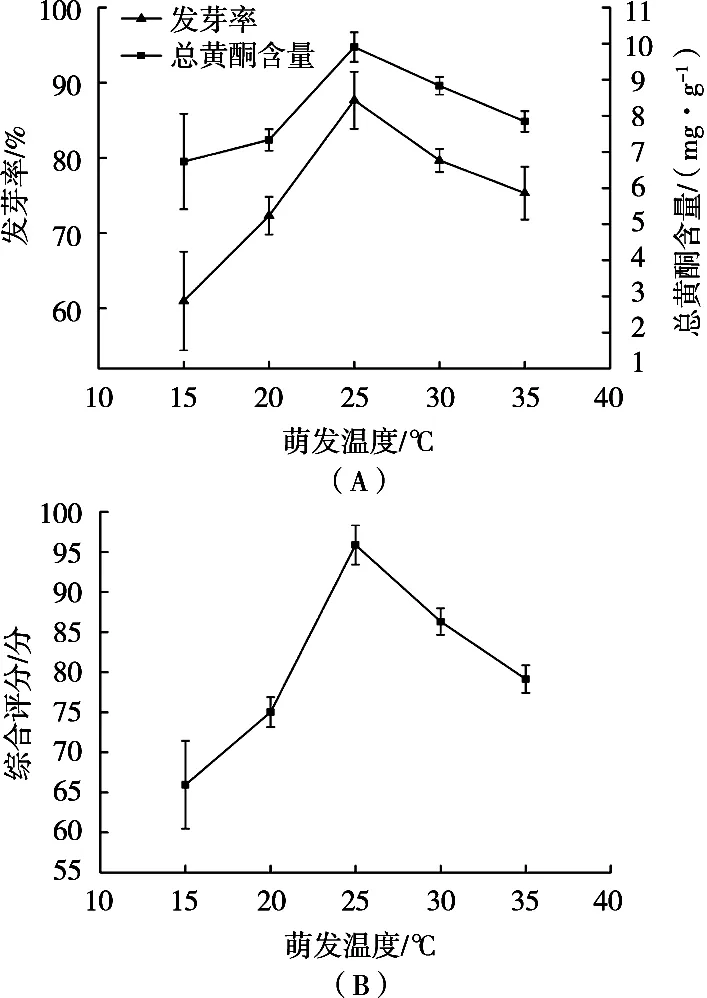
图3 萌发温度对苦荞发芽率和总黄酮含量(A)及综合评分(B)的影响
2.2 响应面试验
2.2.1 响应面试验设计及结果
17组响应面试验结果如表2所示。

表2 响应面试验设计及试验结果
2.2.2 模型建立及显著性分析
运用Design-Expert 8.0.6软件对试验数据进行多元回归拟合,得到二次多项回归方程Y=97.47+2.86A+3.07B-3.67C-0.35AB-5.33AC-5.27BC-21.00A2-12.26B2-7.67C2。对回归方程进行方差分析,结果如表3所示。模型达到极显著水平(P<0.01),失拟项不显著(P>0.05),模型R2和Radj2分别为0.991 1和0.979 7,说明该模型具有较高的显著性,与真实数据拟合程度好。由F值可以看出,各因素对综合评分的影响程度为萌发温度>萌发时间>浸泡时间,且3个因素的一次项及二次项对综合评分的线性效应均极显著。交互项中浸泡时间和萌发温度相互作用、萌发时间和萌发温度相互作用对综合评分影响极显著。

表3 响应面模型方差分析
2.2.3 响应面的交互作用分析
采用Design-Expert 8.0.6软件对试验结果进行二次响应面回归分析,结果如图4所示。
由图4(A)可知,综合评分随着浸泡时间和萌发时间的延长而提高;到达一定范围,综合评分不再增加,即曲面图的顶点处。继续延长浸泡和萌发时间,综合评分开始下降。相应的等高线接近圆形,表明这2个因素无显著交互作用,与表3方差分析结果相一致。类似地,图4(B)和4(C)分别反映综合评分随浸泡时间和萌发温度及萌发时间和萌发温度的变化,大致呈先上升后下降趋势。就等高线而言,浸泡时间和萌发温度相互作用及萌发时间和萌发温度相互作用的等高线均呈椭圆形,表明图4(B)和4(C)中的两因素交互作用较显著,与方差分析结果一致。

图4 两因素相互作用对综合评分影响的响应面图
2.2.4 验证试验
根据Design-Expert 8.0.6软件运行结果,以综合得分最大值为指标,得到苦荞萌发的最优条件:浸泡时间12.18 h、萌发时间58.69 h、萌发温度23.81 ℃,在此条件下模型预测的综合评分为98.47分,发芽率为88.94%,总黄酮含量为11.93 mg/g。考虑到实际操作,将最优条件调整为浸泡时间12 h、萌发时间59 h、萌发温度24 ℃,对苦荞麦进行3次平行萌发,并按前述进行分析检测,在该条件下发芽率为89.00%±1.00%,总黄酮含量为11.97±0.06 mg/g,验证试验综合评分98.67±0.79分,接近模型预测值,说明所设计优化的萌发工艺较合理。经萌发后,苦荞中总黄酮含量较萌发前(5.56±0.20 mg/g)提高115.3%。
2.3 苦荞萌发过程中芦丁和槲皮素含量的动态变化
由图5可以看出,随着苦荞的萌发,芦丁和槲皮素含量均呈上升趋势,但芦丁含量的增加总体明显于槲皮素,这与石磊等[14]的研究结果类似,也与胡俊君等[15]所观察到的苦荞全粉中芦丁、槲皮素等活性成分含量随苦荞发芽期(0~4 d)的变化趋势相一致。Kim等[16]研究表明,随着萌发的进行,品种Hokkai T 8苦荞籽粒中的芦丁含量逐渐下降,而品种Hokkai T 10籽粒中的芦丁含量不断上升,这表明苦荞萌发期间活性成分的动态变化规律与苦荞品种有关。试验中,芦丁含量在萌发24 h后增长明显,而槲皮素含量的增加主要发生在萌发初期6~12 h内。萌发至59 h时,芦丁和槲皮素含量分别达到5.61和2.20 mg/g,芦丁含量较未萌发时的2.04 mg/g提高1.75倍,这表明萌发后的苦荞具有更高的营养价值,更适用于苦荞相关功能食品的开发。

图5 混合标准品的高效液相色谱图(A)及苦荞萌发过程中芦丁、槲皮素的含量变化(B)
2.4 体外抗氧化活性的研究
通过测定比较萌发前后苦荞对DPPH·和ABTS+·自由基的体外清除能力,结果表明萌发后苦荞的抗氧化活性有所增强,且抗氧化活性与浓度呈正比(图6),与周小理等[17]、王静波等[18]研究结果相一致。1 mg/mL的苦荞麦芽对DPPH·和ABTS+·自由基的清除率分别为95.83%和97.64%,是同浓度下阳性对照VC清除能力的96.91%和98.63%,较同浓度下未萌发苦荞的92.04%和92.24%分别提高4.11%和5.53%。有研究表明,苦荞芽中的VC、总黄酮以及芦丁含量与其自由基清除能力呈显著正相关[19]。Ryu等[20]通过相关分析进一步证实芦丁是苦荞茶中最主要的抗氧化物质。试验中,苦荞经萌发后芦丁和总黄酮含量均大幅提高,这在一定程度上解释了苦荞麦芽抗氧化活性有所增强的现象。

图6 萌发前后苦荞对DPPH·自由基(A)和ABTS+·自由基(B)的清除能力
3 结论
试验采用单因素结合响应面法优化苦荞萌发工艺,结果表明,将苦荞籽粒室温浸泡12 h后在24 ℃下萌发59 h,发芽率和总黄酮含量均较高,分别为89.00%和11.97 mg/g。采用HPLC法动态监测苦荞萌发过程中黄酮类成分芦丁和槲皮素的含量变化,结果表明芦丁和槲皮素含量均随萌发过程的进行而增加,但芦丁含量的增加主要发生于萌发24 h后,而槲皮素含量的增加主要发生于6~12 h的萌发初期,且槲皮素含量的整体增长幅度小于芦丁含量。体外抗氧化活性分析表明,萌发后苦荞的抗氧化活性较萌发前有所增强,说明萌发有利于富集芦丁、槲皮素等黄酮类物质,从而提高苦荞抗氧化活性。由此可见,苦荞麦芽是一种可用于抗氧化功能食品开发的优良资源,可用于开发苦荞芽茶、苦荞芽饮料、苦荞芽饼干、苦荞芽酸奶等功能食品。
